丁酸介导下肠道菌群与宿主免疫互作机制的研究进展
2021-11-04梁开阳孙志洪谭支良
梁开阳,孙志洪,谭支良,刘 勇*
(1. 西南大学动物科学技术学院,重庆 400700; 2. 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙 410125)
菌群来源的丁酸作为免疫调节因子,在先天免疫细胞的产生、转移及功能发挥等重要免疫学过程中起重要调节作用;丁酸经多种途径调节机体适应性免疫活性,包括激活细胞表面受体G蛋白偶联受体(G-protein-coupled receptors,GPCRs)、抑制组蛋白去乙酰化酶(histone deacetylase,HDAC)和代谢整合等机制[1-2]。因此,本文将聚焦于产丁酸菌-丁酸-宿主免疫系统之间的互作关系,系统地概述产丁酸菌及丁酸对宿主先天性免疫和适应性免疫系统的影响及其潜在的互作机制。
1 肠道菌群代谢产物-丁酸的生成途径
肠道菌群作为机体最大的隐形器官,通过调控宿主营养素代谢和机体免疫状态而维持机体健康稳态。在哺乳动物大肠厌氧微生物的作用下,碳水化合物(carbohydrate,CHO)被降解发酵产生大量的短链脂肪酸(short chain fatty acids,SCFAs),包括乙酸、丙酸、丁酸,其中丁酸(butyrate)在调节宿主能量代谢、肠道内环境和宿主免疫系统中发挥重要作用。目前已知丁酸的微生物代谢通路中,乙酰辅酶A(acetyl-CoA)通路是最主要的途径,丁酰辅酶A(butyrate phosphate)通过丁酰辅酶A:乙酰辅酶A转移酶(butyryl-CoA:acetate CoA-transferase,BUT)和丁酸激酶(butyrate kinase,BUK)产生丁酸[3-4],如图1所示。

图1 肠道菌群代谢生成丁酸的主要代谢路径Fig.1 The major metabolic pathways of butyrate by gut microbes
丁酸生成菌(butyrate-producing bacteria,BPB)是宿主肠道中重要的功能菌群,主要存在于盲肠和结肠,以厚壁菌门(Firmicutes)为主,还包括梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)等;而在属水平上则有毛螺菌属(Lachnospiraceae)、梭菌属(Clostridium)、真杆菌属(Eubacterium)、粪杆菌属(Faecalibacterium)、丁酸弧菌属(Butyrivibrio)、罗斯菌属(Roseburia)和厌氧菌属(Anaerostipes)等[5-7]。丁酸梭菌(Clostridiumbutyricum)作为肠道中最常见的丁酸生成菌之一,具有强大的产丁酸能力,并在调节机体免疫方面起着重要作用[6]。近年来,新型BPB如Mediterraneibacterbutyricigenes[8],Collinsellaaerofacienssubsp.shenzhenensissubsp. nov.[5]和Clostridiumcompostisp. nov.[7]等也被不断发现和分离培养。
2 丁酸调控肠道免疫的研究进展
2.1 丁酸调控肠道先天性免疫的研究进展
先天免疫系统(innate immune system,IIS)是由一系列先天性淋巴细胞(innate lymphoid cells,ILCs)和补体系统构成,通过炎症反应产生非特异性防御系统[9]。主要效应是以化学因子(包括细胞因子)作为信号分子,将免疫细胞召集到感染或炎症区域,激活免疫系统来促进清除外源病原、感染细胞、坏死细胞或抗体-抗原复合体[10-11]。丁酸在炎症性肠病中可抑制先天性免疫中树突状细胞(dendritic cell,DC)、巨噬细胞(macrophage,MΦ)和中性粒细胞(neutrophils,NE)等细胞的过度活化,下调炎症因子而减轻局部肠道炎症。
DC是抗原呈递的重要场所,也是连接先天和后天免疫系统的重要纽带,主导T细胞反应的激活和稳衡。菌群代谢产物丁酸通过调节DC表面功能蛋白的表达而影响其分化、成熟过程及功能特性。在丁酸的作用下,人类DC的成熟会延迟,其特征是DC的形成和CD80、CD83、CD1a和II类组织相容性复合体 (major histocompatibility complex,MHC)等分子(这些分子在成熟的树突状细胞中高度表达)表达受到抑制[12],并下调CD54、CD86和II型人白细胞抗原(HLA)的表达以抑制DC表型分化[12];此外,通过作用于GPR109A和HDAC的方式,丁酸能抑制LPS诱导的人单核细胞来源DC细胞的成熟和代谢,并调节它们使初始CD4+T细胞向产生IL-10的调节性T细胞分化[13]。最近一项研究发现,丁酸以作用于细胞GPR41、GPR109A和抑制HDAC的方式上调CD103+CD11b+DC中转化生长因子(transforming growth factor-β,TGF-β)和全反式维甲酸(all-trans-retinoicacid,ATRA)的生成,增加结肠黏膜内B细胞分泌型IgA(secretory immunoglobulin A,SIgA)的表达而维持肠道免疫稳态[14]。
MΦ是丁酸的重要靶点细胞,其相互作用维持MΦ调控的肠道免疫稳态[14]。例如,丁酸通过抑制HDAC3来驱动单核细胞向MΦ的分化,和抑制T细胞产生促炎因子IL-17a,从而增加MΦ对病原菌的吞噬能力[15]。另外,丁酸通过促进MΦ中具有抗菌功能的钙蛋白酶(calprotectin)的表达,也可以增强MΦ对菌群的杀菌能力[1,16]。添加GPCRs抑制剂-百白咳毒素,结果并不影响丁酸增强MΦ的抗菌功能,表明丁酸作用于MΦ的方式并非依赖于GPCRs[1],而是通过作用于HDAC,丁酸使MΦ细胞中促炎因子(NO、IL-6和IL-12)表达下调并抑制肠道炎症发生[17]。丁酸的抗炎效果在体外也得到了验证,其可减少MΦ细胞株RAW264.7分泌促炎因子TNF-α、IL-1β和IL-6(LPS诱导),而增加抗炎因子IL-10的生成[18];推测,产丁酸共生菌可能通过下调宿主肠道MΦ中促炎因子的表达,降低肠道对共生菌的免疫反应而维持肠道菌群共生微环境。
自然杀伤细胞(natural killer cell,NK)的激活受到一系列细胞表面抑制和激活受体信号的严格调控,这些受体与靶细胞配体相互作用。免疫受体NKG2D触发NK和MΦ细胞的初级活化,并作为信号源刺激CD8+T细胞和T细胞的活化[19],而丁酸又被证明能够上调NK细胞中NKG2D配体MICA/B表达[20],这表明丁酸可能作用于NKG2D诱导NK细胞发挥免疫效应。此外,丁酸钠通过抑制肿瘤细胞中的HDAC而增加Ⅰ MHC的表达,导致NK细胞杀伤敏感性增强[20]。
除了调控上述几种免疫细胞之外,丁酸还能与NE的GPR43受体结合,降低NE促炎因子如TNF-α、IL-6和IL-12等的表达,通过NE调节活性氧的产生以及增加它们吞噬细胞微生物和颗粒的能力,对人类或啮齿动物NE进行的研究表明,丁酸能减少TNF-α的产生,最近的一项研究报道了在接受丁酸盐灌肠的小鼠的葡聚糖硫酸钠诱导的结肠炎模型中NE募集和炎症减弱,因此说明,丁酸能够调控NE招募、效应器功能和存活等诸多方面的功能[18,21]。在炎症反应中,丁酸可诱导激活肠道上皮细胞(intestinal epithelial cells,IECs)、NE和嗜酸性粒细胞(eosinophils)中GPCRs的高表达,抑制HDAC,导致核因子κB(nuclear factor kappa-B,NF-κB)失活,减少促炎因子的产生,进而降低炎症反应[22-23]。同时,丁酸盐还被证实可抑制小鼠与人的肥大细胞(mast cell)脱颗粒,通过抑制肥大细胞中的HDAC活性(而非GPCRs受体途径),引起组蛋白乙酰化的重新分布,并下调BTK、SYK和LAT启动子区乙酰化水平,这对于抑制炎症因子产生和下游信号转导引发的炎症疾病具有积极作用[24]。
肠道菌群降解碳水化合物生成丁酸,而丁酸作为先天性免疫细胞(包括DC、NK、MΦ和NE等细胞)HDAC的抑制剂,通过增加细胞内组蛋白的乙酰化程度,诱导抗炎因子的产生,激活其他免疫细胞,从而降低局部炎症反应和维持肠道局部稳态。肠道菌群代谢产物-丁酸介导的肠道菌群与宿主先天性免疫细胞间的复杂关系网如图2所示。
2.2 丁酸调控肠道适应性免疫的研究进展
除作为先天性免疫细胞的适配体发挥免疫调节作用之外,丁酸还能增加体外结肠上皮细胞产生细胞因子和趋化因子,包括TNF-α、IL-6、CXCL1和CXCl10,炎症介质的产生是应对炎症刺激时结肠中白细胞的充分招募和T淋巴细胞的激活所必需的,并通过DC和MΦ的激活/分化直接影响淋巴细胞[21]。丁酸调控适应性免疫主要是通过免疫细胞招募、激活及促抗体分泌等多种途径来作用于适应性免疫细胞(包括效应B细胞和T细胞),调控宿主长期记忆性免疫和短期免疫应答,来对抗恶性炎症反应和维持宿主免疫稳态[21,25]。
效应B细胞(effector B cell)能分泌多种抗体对抗病原菌入侵,菌群代谢物丁酸作为信号分子和能量物质可促进B细胞转化为效应B细胞并产生抗体。丁酸作为能量物质调节B细胞的能量代谢,增加乙酰辅酶A产生和促进氧化磷酸化、糖酵解和脂肪酸合成而调节能量代谢过程,为抗体生成提供能量基础[26]。最近一篇综述阐明,丁酸作用于效应B细胞是通过抑制HDAC的方式,而非GPCRs依赖性途径[27],通过刺激IECs中TGF-β表达,丁酸诱导B细胞的分化,产生IgA浆细胞的类转换(class-switched recombination,CSR)反应[14, 28];或者直接接触B细胞,促进B细胞活化和IgA、IgG的产生[26]。胞苷脱氨酶(adenosine deaminase,AID)和B细胞诱导成熟蛋白-1(B lymphocyte-induced maturation protein,Blimp-1)对于抗体产生和抗体反应至关重要[29-30],但高表达的AID和Blimp-1也会引发自身免疫性疾病[31]。最新研究发现,菌群代谢产生的丁酸影响B细胞的表观遗传机制,下调B细胞AID和Blimp-1表达、体细胞突变、浆细胞分化和抗体产生[27],并且抑制B细胞的IgE的CSR,减轻IgE介导的过敏性反应[27]。在其他研究中也发现,AID缺乏或者低表达的小鼠,能够减少自身抗体的产生和延缓疾病发生[32]。这与前面阐述丁酸支持B细胞的抗体反应相矛盾,原因与丁酸使用的剂量有关,在低剂量时,丁酸适度增强CSR,支持抗体反应,而在高剂量时,减轻过敏反应[27]。此外,菌群代谢物丁酸调控色氨酸代谢菌(Allobaculum、Bifidobacterium和Rhodosprillaceae_unclassified),使色氨酸代谢成血清素并进一步生成5-羟基吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA),5-HIAA作为适配体激活调节性B细胞(Bregs)的芳基烃受体(aryl-hydrocarbon receptor,AhR),诱导CD19+CD21hiCD24hiBregs产生抗炎因子IL-10,并阻断B细胞生发中心和浆细胞的分化,证实补充丁酸可缓解全身性自身免疫疾病的发生[33-34]。
丁酸调节T细胞的激活和效应反应,诱导T细胞向其他细胞转化,丁酸来源的乙酰基进入T细胞乙酰辅酶A池,通过影响组蛋白乙酰化水平和细胞因子的产生发挥作用[35]。适应性免疫系统产生的两种主要的效应T细胞是辅助T细胞(helper T cell,Th)和调节T细胞(regulatory T cells,Tergs)。Th细胞的特征在于CD4和转录因子(T-bet,GATA3和RORγt)的特异性表达,以此影响其他免疫细胞激活和分化的细胞因子释放[35-36]。DC细胞、单核细胞、MΦ等免疫细胞可分泌促炎细胞因子,例如IL-1β、IL-8和IFN-γ,参与炎症反应的早期应答和放大,这些因子可激活初始CD4+T细胞[37],根据释放的特定细胞因子,CD4+T细胞会进一步分化为不同的Th亚群,如Th1、Th2、Th17等[38]。Park等[39-40]证明,丁酸可促进Th17和Th1效应细胞的生成,Th17细胞能产生细胞因子IL17和IL-22,IL-22可促进AMPs的产生,增强上皮再生,这有利于维持肠道上皮细胞功能,促进与共栖微生物的稳态对话。此外,丁酸可促进细胞代谢,增强mTOR信号通路元件的活性和调节T细胞的葡萄糖代谢来改变T细胞的代谢过程,可增强CD8+T细胞效应功能[41],改变CD8+T细胞的记忆电位,促进记忆细胞长期存活[42]。最近的研究还表明,丁酸直接作用于CD8+T细胞,导致CD8+T细胞的启动增强和IFN-γ反应增强[43]。
Tregs在肠道中大量存在,并能抑制饮食和肠道菌群刺激的有害反应[44],在微生物信号诱导下,丁酸通过GPR43受体作用于FOXP3位点和促进组蛋白H3乙酰化,调节Tregs的增殖,并增加T细胞中IL-18的产生来调节免疫和组织炎症[41,45-46]。Singh等[47-48]证明,丁酸能通过DC细胞表面GPR109A受体,促进初始T细胞转化为FOXP3+Treg细胞,增加抗炎细胞因子IL-10的分泌,并抑制它们向产生促炎因子IFN-γ的细胞分化。与直接加入丁酸的效果一致,用产丁酸的梭状芽胞菌接种无菌小鼠,也能显著增强Tregs的分化。另外,通过对人类原生菌群的选择筛选,分离出CD4+FOXP3+Treg的诱导菌株,结果显示,产丁酸菌ClostridiaclustersIV、ClostridiaclustersXIVa和ClostridiaclustersXVIII也能够促进Treg的增殖和分化[28]。总的来说,这些细菌代谢产物-丁酸的抗炎作用包括增加TGF-β、IL-10等抗炎因子生成、改变MΦ和DC呈递抗原能力和增强T细胞初始反应,根据免疫环境的不同,丁酸可以促进效应T细胞和受体T细胞免疫效应[49](图3)。
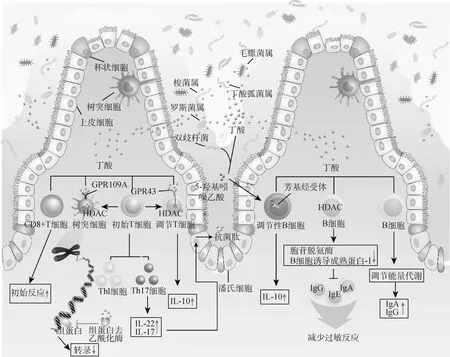
图3 丁酸参与肠道菌群与机体获得性免疫的互作网络Fig.3 Butyrate-mediated complex network between gut microbes and host adaptive immunity
3 肠道菌群-丁酸-宿主免疫轴间的互作
动物肠道菌群与免疫系统之间的互作平衡是抵抗病原体入侵、阻止炎症发生的关键。碳水化合物被肠道菌群代谢为SCFAs,参与宿主免疫、肠道菌群结构及肠道稳态等重要生理过程,丁酸作为重要信号分子,在宿主先天性免疫和适应性免疫中扮演重要角色,同时通过影响宿主免疫状态和肠道微环境调控肠道菌群结构。本部分内容着重于对肠道菌群-丁酸-宿主免疫轴间的互作关系进行阐述(图4)。
IECs接收来自共生微生物或侵入病原体的信号,并通过调节黏膜屏障将信号传递给固有层免疫细胞来应答肠道内环境的变化。肠道中致病菌(Salmonella、Shigella、E.coli)的入侵导致上皮屏障受损,诱发炎症反应[50-51],产丁酸菌如Bifidobacterium、Lactobacill等又可代谢生成丁酸发挥重要作用,增强上皮屏障[52-53],丁酸是调控人初级IECs和IEC细胞系表达的主要代谢物,能够调节IECs周转速率和屏障功能,以及调节炎症和感染刺激后的反应[54]。在结直肠癌细胞中,丁酸可抑制HDAC,减缓细胞周期和降低诱导细胞凋亡的基因表达。通过GPR109A,丁酸能够增加有助于肠上皮稳态的细胞因子IL-18的产生,维持缺氧诱导因子(hypoxia-inducible factor, HIF)的稳定化作用[55-56],HIF是直接参与组织完整性维护的转录因子,调节AMPs和肠上皮紧密连接蛋白的产生[57],并在微生物防御和清除异种生物方面起着重要作用[58]。Toll样受体(Toll-like receptor, TLRs)是一类广泛存在于多种生物体内的配体结合受体,是机体先天免疫系统的重要组成部分,IECs在受到丁酸的刺激后,通过降低TLR4的表达和炎性细胞因子(IL-6、TNF-α)的产生,来维持肠道菌群的平衡并调控微生物以及毒素对肠道的入侵[59-60]。IDO-1由IECs产生,作为调节免疫反应的效应分子,维持肠道稳态,Martin-Gallausiaux等[54,61]发现,丁酸通过降低STAT1水平和HDAC抑制剂性质双重调节抑制IDO-1的表达。宿主防御肽构成了大量的天然广谱抗菌素,是几乎所有生命形式中重要的第一道免疫线,丁酸能促进IECs分泌AMPs,如组织蛋白酶抑制剂cathelicidin LL-37和CAP-18[21]。除此之外,丁酸通过Warburg效应会抑制结肠癌细胞增殖,但低浓度促进结肠隐窝细胞增殖,高浓度促进结肠绒毛细胞凋亡[62]。
Paneth细胞是小肠上皮细胞谱系之一,位于小肠隐窝底部,它能分泌AMPs,如防御素(defensins)、抗菌蛋白(RegIIIγ)、溶菌酶(lysozyme),并通过杀微生物活性来促进肠道先天免疫[63]。肠道菌群组成和代谢物影响宿主免疫力,将丁酸微注射到肠管腔中,发现其通过作用于Paneth细胞表面的GPR41受体分泌产生α-defensin[64]。微生物群会随着α-defensin水平的差异而变化[65],分泌的α-defensin作用于肠道微生物,杀死致病菌Salmonellatyphimurium、Acinetobacterbaumannii和Enterococcusfaecium,并增加有益菌Akkermansiamuciniphila、Bifidobacteriumadolescentis和Bifidobacteriumlongum的丰度,促进肠固有免疫[64]。在仔猪日粮中添加0.2%的丁酸,能减少因大肠杆菌侵袭诱导的炎症反应,在体内外显著上调defensin水平,并减少粪便中大肠杆菌数量[66]。Paneth细胞数量的减少和形态上的异常导致了肠道菌群的失调,通常会减少defensin的分泌或导致其功能障碍,进而促使肠道疾病的发生[67]。因此,产丁酸菌通过生成丁酸,促进Paneth细胞defensin分泌增加,调节肠道菌群结构以维持肠道内稳态。宿主与肠道菌群相互作用还可通过肠道微生物-肠道-脑轴双向进行调控,丁酸刺激肠道迷走神经传入大脑,通过自主神经系统调节肠道运动和改变肠道上皮通透性,并改善血脑屏障和肠道屏障的完整性,以减少因有害菌入侵引发的炎症性疾病[68]。
细菌群落组成变化的触发因素很多,丁酸作用动物肠道的生理变化构成一个重要因素,通过调节免疫反应影响肠道屏障功能,从而可能间接修饰肠道细菌群落。肠屏障由完整的单层上皮细胞组成,细胞间紧密连接蛋白维持肠上皮的结构完整性和正常功能,丁酸钠处理明显上调动物机体肠上皮细胞紧密连接蛋白ZO-1、Occludin的基因表达,增强肠黏膜的屏障功能,维持肠黏膜的完整性[69]。大量的研究也表明,无论是口服丁酸梭菌,还是其代谢产物丁酸盐都能增加肠道紧密连接蛋白表达[70-73]。生长因子如GLP-2、IGF-1、EGF有益于动物肠道的发育,丁酸通过促进它们在肠道中合成增加,进而改善肠形态,促进肠道细胞发育,增强吸收功能,维持上皮屏障功能[74-76]。免疫途径的缺陷可能损害屏障功能,细菌发生易位,从而导致炎症反应。在其他病理条件下,肠道菌群也会发生变化,例如,在炎性肠病和糖尿病患者的肠道中发现产丁酸菌显著减少[77-78],如Roseburia、Clostridiales、prausnitzii等,表明产丁酸菌或者丁酸是疾病抗性的重要因素[79-80]。一方面,肠道菌群结构决定丁酸产量。在肠道内丁酸浓度受肠道共生菌组成和比例的影响,微生态失调可导致丁酸含量发生变化。典型例子是将双歧杆菌和产丁酸菌一起培养,双歧杆菌较强的代谢能力使产丁酸菌的竞争力降低[81]。另一方面,丁酸浓度会反向调节菌群结构,通过口服丁酸盐,肠道内Lachnospiraceaeblautia、Lachnospiraceaemarvinbryantia,、LachnospiraceaeNK4A136group和Faecalibacteriumprausnitzii等产丁酸菌的丰度降低[82],说明丁酸补充剂可能是反馈抑制产丁酸菌组成与活性,或下调了参与丁酸生产的微生物基因表达。丁酸处理对回肠和结肠中的总细菌数没有影响,但增加其中部分微生物丰度,如Acinetobacter、Actinobacillus、Facklamia、Globicatella、Kocuria和Rothia等菌属[83],另有研究发现,对生长猪静脉注射丁酸钠,Clostridiaceae、Ruminococcaceae、Lachnospiraceae和Anaerotruncus等梭菌属丰度增加[65,84]。此外,肠道中丁酸的浓度还受膳食纤维摄入量、肠道滞留时间、宿主微生物代谢产物的影响[7]。
4 小结与展望
肠道菌群与宿主间的对话机制成为目前研究的热点,而丁酸作为肠道菌群碳水化合物最重要的功能性代谢产物之一,被宿主靶向识别,可通过多种作用机制诱发先天和适应性免疫调节反应,从而增强或改善宿主免疫状态。此外,肠道共生菌通过分泌丁酸作为信号分子调节宿主免疫状态而影响肠道菌群结构与丰度,形成复杂的肠道菌群-丁酸-宿主免疫间的复杂互作关系,但除了本文所概述的三者互作关系之外,丁酸参与宿主免疫和肠道菌群功能结构的新作用机制还有待进一步研究。探明三者间的作用关系和作用机理,对维持肠道乃至机体免疫稳态具有重要意义。
