NF-κB信号通路调控奶牛乳腺炎的分子作用机制
2021-11-04李宇航罗仍卓么王兴平魏大为
李宇航,罗仍卓么,王兴平*,杨 箭,马 云, 魏大为
(1.宁夏大学农学院,银川 750021; 2.宁夏回族自治区反刍动物分子细胞育种重点实验室,银川 750021)
乳腺炎是奶牛养殖业中一种发病率极高的疾病,可影响奶牛的健康,给牧场造成巨大的经济损失[1]。因此,如何降低奶牛乳腺炎的发病率,保证奶牛健康、提高乳品质量和经济效益的是生产者面临的问题。为解决上述问题,奶牛乳腺炎抗性分子育种技术亟待研发,而奶牛乳腺炎分子调控网络解析可为上述问题奠定理论基础。为探索奶牛乳腺炎发生和发展的分子调控机制,学者们挖掘到了上百个参与调节奶牛乳腺炎的基因或基因位点[2-5],其中,核转位因子-κB(nuclear factor kappa-B,NF-κB)信号通路是奶牛乳腺炎的主要参与者,可诱导促炎性细胞因子及趋化因子的产生[6],在乳腺炎症调节中发挥巨大作用[7-8]。本文综述了奶牛乳腺炎病因及病理变化,以及多种分子通过NF-κB信号通路调控奶牛乳腺炎的作用机制,以期为相关领域的深入研究提供参考。
1 奶牛乳腺炎病因及病理变化
1.1 奶牛乳腺炎的致病因素
奶牛乳腺炎是由病原微生物、奶牛个体、环境及饲养管理等多种原因引起的复杂疾病。引起奶牛乳腺炎的病原微生物主要有细菌、真菌、支原体和病毒等,其中大肠杆菌(E.coli)、金黄色葡萄球菌(S.aureus)、无乳链球菌(S.agalactiae)和乳房链球菌(S.uberis)较为常见[9]。以E.coli为代表的革兰阴性菌可引起临床乳腺炎,而S.aureus等革兰阳性菌通常可引起临床症状不太明显的亚临床乳腺炎[10]。奶牛个体因素是影响奶牛乳腺炎抗性和易感性的主要因素[11-12]。乳腺炎具有遗传性,发病率高的母牛其后代发病率也会偏高,另外,高产奶牛易患乳腺炎也同样具有遗传性[13-14]。此外,奶牛饲料营养成分、牛舍的温湿度和粪污污染等环境卫生状况极大程度地影响着乳腺炎的发生。在现代化牧场中,集约化养殖的挤奶设备也大大增加了乳腺炎的患病率[15]。在上述引发奶牛乳腺炎的多个因素中,个体因素是抗乳腺炎育种的突破口,也是学者们近年来的主要研究热点,试图挖掘乳腺炎抗性和易感性相关的基因或基因位点,以期为培育抗乳腺炎奶牛的新品种提供新的分子素材。
1.2 奶牛乳腺炎的病理变化
病原微生物通过乳头管入侵乳腺组织后,快速增殖,致使乳腺被感染,从而导致乳区血管扩张,血流缓慢,毛细血管通透性增加,局部血流障碍[16]。此外,血液中炎性介质增多,肥大细胞和巨噬细胞产生和分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1(interleukin-1,IL-1)、白介素-6(interleukin-6,IL-6)、白介素-8(interleukin-8,IL-8)和白介素1β(interleukin-1β,IL-1β)等多种促炎细胞因子诱导嗜中性粒细胞从血液进入乳腺组织中,加剧炎症反应[17]。长期的炎症反应可使乳腺小叶损伤、炎性细胞浸润、上皮细胞增生和乳腺淋巴结肿大,严重时可导致乳池及输乳管等组织坏死和萎缩,直至丧失泌乳功能,同时,出现乳汁絮状沉淀、异味和体细胞数增加[18-20],致使奶牛产奶量下降、乳品质降低和治疗成本增加,以及母牛被过早淘汰,给牧场造成巨大的经济损失。
2 NF-κB信号通路与机体免疫
NF-κB广泛存在于各种细胞内,其家族有5个成员,分别为:RelA(p65)、RelB、c-Rel、NF-κB1(p50)和NF-κB2(p52)[21],它们都包含能结合DNA的Rel同源结构域,通过形成二聚体而正向或负向调控多种功能基因的转录[22],从而参与调节细胞免疫、应激反应、增殖和凋亡等多种生物学过程[23-24]。
NF-κB信号通路由多种蛋白质组成,主要包括二聚体转录因子(NF-κB/Rel)、与NF-κB相互作用的NF-κB抑制蛋白(inhibitor of NF-κB,IκB)和上游的IκB蛋白激酶(I kappa B kinase,IKK)等[25]。NF-κB信号通路是免疫系统正常发育和形成、淋巴器官生成、病原体识别、炎症、启动先天免疫反应和适应性免疫反应所必需的[21]。通常NF-κB与相关基因的启动子结合,进而启动炎性细胞因子(TNF-α、IL-1β和IL-6等)、趋化因子(CXCL-8、CCL2和CCL5等)和粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)等基因的转录[26-27],从而调节人和其他动物的机体免疫以及多种类型的炎症性疾病[25]。NF-κB的激活通常是源于两种不同通路之一进行信号转导的结果,被称为经典的和非经典的NF-κB信号通路(图1)[28],这两种通路的末端都存在多种类型的NF-κB、IκB和IKK,他们共同构成了NF-κB信号通路的核心[29-30]。众所周知,先天免疫是抵御病原体入侵的第一道防线,Toll样受体家族(toll-like receptors,TLRs)是一类可以识别多种微生物成分并诱导先天性免疫反应的主要传感器[26]。经典的NF-κB信号通路中,病原微生物感染宿主细胞后,受到TLRs、IL-1和TNF-α等刺激,IKK被激活,致使磷酸化IκB降解,从而使p65、p50从细胞质转移到细胞核,这一过程使NF-κB通路由抑制状态迅速转变为活化状态,从而引起炎症反应[31]。与经典的NF-κB信号通路相比,非经典通路通常导致更持久的NF-κB活化反应[29],通过淋巴毒素β受体(recombinant lymphotoxin beta receptor,LTβR)、B细胞激活因子受体(B cell activating factor receptor,BAFF-R)和CD40配体等特异性受体激活,IKKα磷酸化,p100被激活并降解,随后形成p52/RelB异源二聚体,转移到细胞核并调节下游靶基因转录[32]。

图1 NF-κB信号通路调节机体免疫Fig.1 NF-κB signaling pathway regulates immunity
3 NF-κB信号通路与奶牛乳腺炎
作为调节炎症的关键信号通路,NF-κB通路在许多炎症性疾病中扮演着重要的角色。病原体侵染奶牛乳腺组织可激活NF-κB及其信号通路,参与调节乳腺炎症。近年来,NF-κB信号通路作为奶牛乳腺炎分子治疗的重要靶点被广泛研究,并取得了重要进展。
3.1 奶牛乳腺炎对NF-κB活性的影响
NF-κB有两种活性形式,一种与IκB结合以非活化的形式存在于细胞质中,另一种是受到刺激后IκB磷酸化发生降解,迅速进入细胞核,以活化的形式结合DNA[33]。与健康奶牛相比,感染乳腺炎的奶牛由于受致病细菌的刺激,NF-κB信号通路被激活,乳腺上皮细胞中NF-κB活性升高(这种活性与IL-8和GM-CSF表达高度相关),导致相关炎症蛋白(如黏附分子、趋化因子和细胞因子)的表达水平增加,从而触发了细胞炎症反应[6,34-35]。此外,Boulanger等[6]研究发现,在健康奶牛乳体细胞中检测不到有活性的NF-κB复合物,而在临床型乳腺炎奶牛乳体细胞中NF-κB的活性很高,在亚临床型乳腺炎牛乳体细胞中NF-κB的活性略有升高,说明奶牛乳腺炎可增加NF-κB活性。
3.2 NF-κB信号通路在奶牛乳腺炎中的调控作用
NF-κB信号通路的活化与奶牛乳腺炎症反应密切相关。目前研究发现,多种mRNA、非编码RNA和生物活性物质均可通过不同方式影响NF-κB活性及其信号通路,进而调节奶牛乳腺炎的发展。
3.2.1 mRNA通过NF-κB通路调节奶牛乳腺炎 奶牛乳腺炎的发生和发展过程受多个机体免疫和炎症相关的编码基因共同调节。近年来,学者们就E.coli及S.aureus引起的乳腺炎开展了很多编码基因调控奶牛乳腺炎的分子机制研究,主要集中在NF-κB相关的信号通路上。
TLRs在识别多种微生物和激活先天免疫系统中起着关键作用,越来越多的证据表明,TLRs及其配体在炎症、肿瘤发生和自身免疫紊乱等多种病理条件下具有重要意义[36]。目前,在牛中已发现10个成员(TLR1~10)[37],其中,Toll样受体2(toll-like receptor 2,TLR2)和Toll样受体4(toll-like receptor 4,TLR4)可识别革兰阳性菌和革兰阴性菌表面的病原体相关模式分子,进而激活细胞内NF-κB信号通路[38]。
TLR4途径介导的NF-κB信号通路也受到其他mRNA的调节。过表达泛素样修饰剂1连接酶1(ubiquitin-fold modifier1-specific ligase 1,UFL1)可抑制TLR4的表达、IκBα的降解和p65的磷酸化,从而抑制促炎性细胞因子的表达,降低内质网凋亡、自噬和氧化应激,减轻炎症反应和细胞损伤[39],说明,UFL1通过调节NF-κB的转录活性和靶基因的表达在乳腺炎症反应中发挥抑制作用。Sirtuin7(SIRT7)是一种NAD+依赖性脱乙酰酶,参与核糖体RNA合成、蛋白质合成、DNA损伤反应、代谢和肿瘤发生等多种生物学过程[40]。Chen等[41]研究发现,SIRT7在患有乳腺炎的奶牛乳腺组织和LPS处理的奶牛乳腺上皮细胞中表达量下调,可减弱TLR4、转化生长因子活化激酶结合蛋白1(TAK1-binding protein 1,TAB1)和p-TAK1的上调,抑制NF-κB通路活化,从而下调炎性细胞因子、活性氧(reactive oxygen species,ROS)和NO的表达,进而抑制细胞炎症及细胞凋亡。
除以上mRNA外,还有一些mRNA可以通过NF-κB通路发挥作用。细胞色素氧化酶P4501A1(cytochromes P4501A1,CYP1A1)基因在乳腺炎奶牛的乳腺组织和炎性上皮细胞(inflammatory epithelial cells,INEs)中的表达均显著下调[42]。Zhang等[42]研究发现,在LPS诱导的奶牛乳腺炎中超表达CYP1A1基因可促进乳腺上皮细胞增殖,并且通过抑制NF-κB信号通路的激活而抑制TNF-α和IL-6的表达,从而减轻乳腺上皮细胞炎症反应。脂肪酸结合蛋白3(fatty acid binding proteins 3,FABP3)在奶牛乳腺上皮细胞及外周血白细胞中均高丰度表达,可通过介导过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)的表达来抑制NF-κB通路活化,从而调控LPS诱导的奶牛乳腺炎症反应[43]。Szperka等[44]发现,牛FLICE样抑制蛋白(flice-like inhibitory protein,FLIP)的高表达阻断了LPS和TNF-α诱导的NF-κB依赖性基因产物的上调,表明牛FLIP能够作为一种抗凋亡信号分子发挥作用,还具有下调NF-κB依赖性基因表达的额外能力。在感染S.aureus的荷斯坦奶牛中,蛋白颗粒复合体9基因(trafficking protein particle complex 9,TRAPPC9)位点对白介素-17(interleukin-17,IL-17)有极显著正相关效应,并且分析发现,血清IL-17与NF-κB含量呈极显著正相关,说明TRAPPC9有可能通过IL-17而增强NF-κB信号通路的活化能力,最终影响了奶牛对S.aureus型乳腺炎的抗性[45]。虽然以上mRNA均可通过NF-κB调节奶牛乳腺炎症,但具体调节机制尚未阐明,仍需要进一步探索。
3.2.2 miRNA通过NF-κB通路调节奶牛乳腺炎 微小RNA(microRNA,miRNA)是一类长度约20~25个核苷酸所组成的内源性非编码RNA,可通过与mRNA 3′UTR结合来抑制靶基因的翻译,从而调节细胞增殖分化、发育、稳态和疾病进展等多种生物学过程[46-47]。Li等[48]研究发现,IKKα是miR-223、miR-15a和miR-16的靶点,在人单核-巨噬细胞分化过程中,上述miRNA的表达下调,使IKKα蛋白显著增加,从而促进p52的产生,这一途径是通过抑制NF-κB靶基因来防止新的巨噬细胞过度激活,同时,为新的NF-κB信号通路的激活做好准备。miR-223可能是炎症的负调节因子,可靶向IKKα和转录激活因子3(signal transduction and activator of transcription 3,STAT3)基因,通过NF-κB信号通路调节单核细胞和巨噬细胞分化而调节机体炎症[48-49]。Li等[50]发现,miR-145可通过抑制二磷酸腺苷核糖基化因子6(adenosine diphosphate ribosylation factor 6,ARF6)的表达阻断和减少NF-κB信号通路,从而抑制炎症因子的分泌,起到改善巨噬细胞炎症状态的作用。在奶牛乳腺炎中,Chen等[51]研究表明,包括miR-223在内的25个miRNA在乳腺炎奶牛中的表达量显著下降,而10个与NF-κB信号通路相关的mRNA(RelA,Rel,p105,p100,IκBα,IκBβ,IκBδ,IκBζ,Bcl-3和IKKα)的表达量均显著增加,推测出这些miRNA 可抑制NF-κB信号通路中的基因表达,以维持奶牛的免疫平衡。上述结果说明,在乳腺炎奶牛中,一些低水平的miRNA降低了对NF-κB信号转导基因的抑制作用,从而促进免疫相关基因表达,进而参与了抵抗细菌侵袭的免疫应答。
现有报道表明,miR-146a和miR-214通过靶向NF-κB信号通路相关基因调节奶牛乳腺炎症(图2)。Wang等[52]研究发现,与健康奶牛相比,感染S.aureus或E.coli型乳腺炎奶牛的乳腺组织中miR-146a的表达量显著上调,可显著抑制牛肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor related factor 6,TRAF6)及其下游NF-κB的mRNA 和蛋白表达水平,从而抑制炎症介质TNF-α、IL-6和IL-8的产生。上述结果证明,miR-146a通过下调TLR4/TRAF6/NF-κB通路发挥炎症负反馈调节作用。促有丝分裂原蛋白激酶活化激酶14(mitogen-activated protein kinase kinase kinase 14,MAP3K14)是NF-κB信号通路上肿瘤坏死因子受体相关因子3(tumor necrosis factor receptor related factor 3,TRAF3)的下游基因,TANK结合激酶1(TANK-binding kinase 1,TBK1)是TLR信号通路上TRAF3的下游基因[27,36]。Song等[53]对奶牛乳腺上皮细胞中的miR-214进行干扰或过表达,发现miR-214可通过靶向抑制活化T细胞核因子3(nuclear factor of activated T cells C3,NFATc3)和TRAF3的表达,并间接抑制下游MAP3K14(NF-κB和肿瘤坏死因子信号通路关键基因)、TBK1(TLRs信号通路基因)及炎性细胞因子IL-6和IL-1β的表达,从而调节奶牛乳腺炎。此外,miR-155模拟物转染小鼠乳腺上皮细胞可促进TNF-α和IL-1β的分泌,增强TLR2的表达,并激活NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路相关蛋白质的磷酸化,表明miR-155可促进S.aureus诱导的小鼠乳腺炎症[54]。然而,miR-155是否参与NF-κB信号通路介导的奶牛乳腺炎症,至今未见文献报道,有待进一步研究。

图2 miRNA通过NF-κB信号通路调节奶牛乳腺炎Fig.2 miRNA regulates bovine mastitis through NF-κB signaling pathway
3.2.3 lncRNA通过NF-κB通路调节奶牛乳腺炎 长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200个核苷酸的非编码RNA。许多功能性lncRNA已被鉴定为各种生理和病理过程中的关键调节因子[55-56],近年来,人类各种疾病的组织中检测到大量差异表达的lncRNA[57]。越来越多的证据表明,lncRNA在炎症反应中发挥着重要的作用,成为多种炎症的生物标志物[58],但是,lncRNA通过NF-κB信号通路调节奶牛乳腺炎的报道较少。
NF-κB信号通路介导的lncRNA在奶牛乳腺炎中的研究,目前,仅lncRNA XIST、lncRNA LRRC75A-AS1和lncRNA H19有相关研究报道(图3)。Özdemir和Altun[59]在正常及感染牛分枝杆菌(M.bovis)的奶牛乳腺组织中,发现有1 310个差异表达mRNA和57个差异表达lncRNA(包含19个新的差异表达lncRNA)。M.bovis感染的奶牛乳腺组织通常通过NF-κB通路产生免疫应答,lncRNA-mRNA共表达网络在NF-κB和磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositide 3 kinases/protein kinase B,PI3K-Akt)通路中发挥作用,有助于了解奶牛乳腺组织中M.bovis免疫应答的分子机制[59]。在E.coli或S.aureus诱导的奶牛乳腺炎中,lncRNA XIST可通过抑制NF-κB通路的激活和促炎症细胞因子的形成,来延缓细胞凋亡、维持细胞活力和促进细胞增殖[60]。活化的NF-κB通路可促进XIST和NOD样受体蛋白3 (NOD-like receptor protein,NLRP3)炎症小体的表达,同时,XIST负反馈调节NF-κB/NLRP3炎症小体通路,从而介导炎症过程,表明XIST在奶牛乳腺炎中可抑制过度和持续的炎症过程[60]。Wang等[61]研究发现,lncRNA LRRC75A-AS1通过靶向LRRC75A基因,使紧密连接蛋白表达量增加,调节细胞的通透性,抑制细菌的侵袭及黏附能力,并通过抑制NF-κB信号通路的激活减轻乳腺炎症反应。在奶牛乳腺炎中,lncRNA H19的过度表达通过促进炎性细胞因子的分泌和NF-κB通路的激活,增强奶牛乳腺上皮细胞系(mammary alveolar cell-T,MAC-T)的免疫应答,在炎症结束时,lncRNA H19的过度表达上调了紧密连接蛋白,恢复了血乳屏障,有利于被感染乳腺的功能恢复[62]。综上所述,目前,仅有3个lncRNA在奶牛乳腺炎中开展了调控机制研究。与所筛选的差异表达lncRNA的数量相比,仍有很多差异表达lncRNA在NF-κB信号通路中的调控作用及其在奶牛乳腺炎中的作用机制有待于进一步探索。

图3 LncRNA通过NF-κB信号通路调节奶牛乳腺炎Fig.3 LncRNA regulates bovine mastitis through NF-κB signaling pathway
3.2.4 circRNA可能通过NF-κB通路调节奶牛乳腺炎 环状RNA(circular RNA,circRNA)是一类呈封闭环状的非编码RNA,结构稳定,不易受RNA外切酶影响,其表达具有组织特异性[63]。CircRNA分子富含miRNA的结合位点,起到miRNA分子海绵的作用,进而间接实现对miRNA靶基因的调节[64],广泛参与人体和动物体的多种生理学及病理学的调控过程[65]。
目前为止,circRNA关于对奶牛乳腺炎方面调控的研究仅有极少数文献报道。王兵兵[66]研究发现,circLPP在奶牛乳腺感染炎症后的表达水平显著上调,通过circLPP/miR-615/SPRED3(sprouty related EVH1 domain containing 3)相互调控作用而诱导炎性细胞因子分泌,降低乳腺上皮细胞的活力并抑制其增殖,从而参与乳腺炎发展过程。张彭媛[67]发现,circKIAA在炎症状态下的奶牛乳腺组织及LPS诱导的乳腺上皮细胞中表达均明显高于正常组,circKIAA可通过对miR-326的海绵吸附作用而促进炎性细胞因子和上调B淋巴细胞瘤-2基因(Bcl-2)的表达,进而抑制乳腺上皮细胞的增殖并诱导其凋亡。值得注意的是,circRNA可通过NF-κB调节人和小鼠的炎症过程(图4)。小鼠circ_1639充当miR-122的海绵,靶向调节肿瘤坏死因子受体超家族13C(tumor necrosis factor receptor superfamily 13C,TNFRSF13C)基因,促进NF-κB通路的激活,从而加重酒精性肝炎[68];circRNA_09505通过miR-6089/AKT1/NF-κB轴加重类风湿关节炎小鼠的炎症和关节损伤[69];circ-RELL1通过miR-6873-3p/髓样分化因子88(MyD88)/NF-κB轴调节人内皮细胞的炎症反应[70];circ_0054633通过NF-κB信号通路减轻了LPS诱导的大鼠急性肺损伤[71]。另外,circ-Sirt1可通过与NF-κB p65直接相互作用,进而抑制NF-κB的激活[72]。综上所述,circRNA可以通过NF-κB信号通路调节人或大鼠、小鼠模型的一些炎症性疾病。但是,迄今为止,在牛中没有circRNA通过NF-κB信号通路调节炎症的研究报道。不同物种基因序列和功能上具有相似性,因此,推测circRNA也有可能通过NF-κB通路而调节奶牛乳腺炎,有待于进一步探索,这也可为学者们的进一步研究提供新思路。

图4 CircRNA通过NF-κB信号通路调节炎症Fig.4 CircRNA regulates inflammation through NF-κB signaling pathway
3.2.5 生物活性物质通过NF-κB通路调节奶牛乳腺炎 中草药在预防及治疗疾病中发挥着显著的作用,其中,许多已被证明对多种疾病有免疫调节、抗炎和抗氧化等生物学功能,并且能对病原菌产生明显的抑制效果[73-74]。中草药对疾病的作用主要依赖于其中的生物活性物质[75]。生物活性物质具有种类多、无药物残留、不产生耐药性和刺激较小等优点,在奶牛乳腺炎的治疗上有较大的优势和潜力[76-77]。近年来,学者们进行了多种生物活性物质对奶牛乳腺炎的调控机制研究,发现这些生物活性物质大多都是通过NF-κB信号通路而调节奶牛乳腺炎症过程(表1),这些重要进展可为治疗奶牛乳腺炎新型药物和饲料添加剂的研发提供理论参考。

表1 不同生物活性物质通过NF-κB信号通路对奶牛及模式动物乳腺炎的调节作用
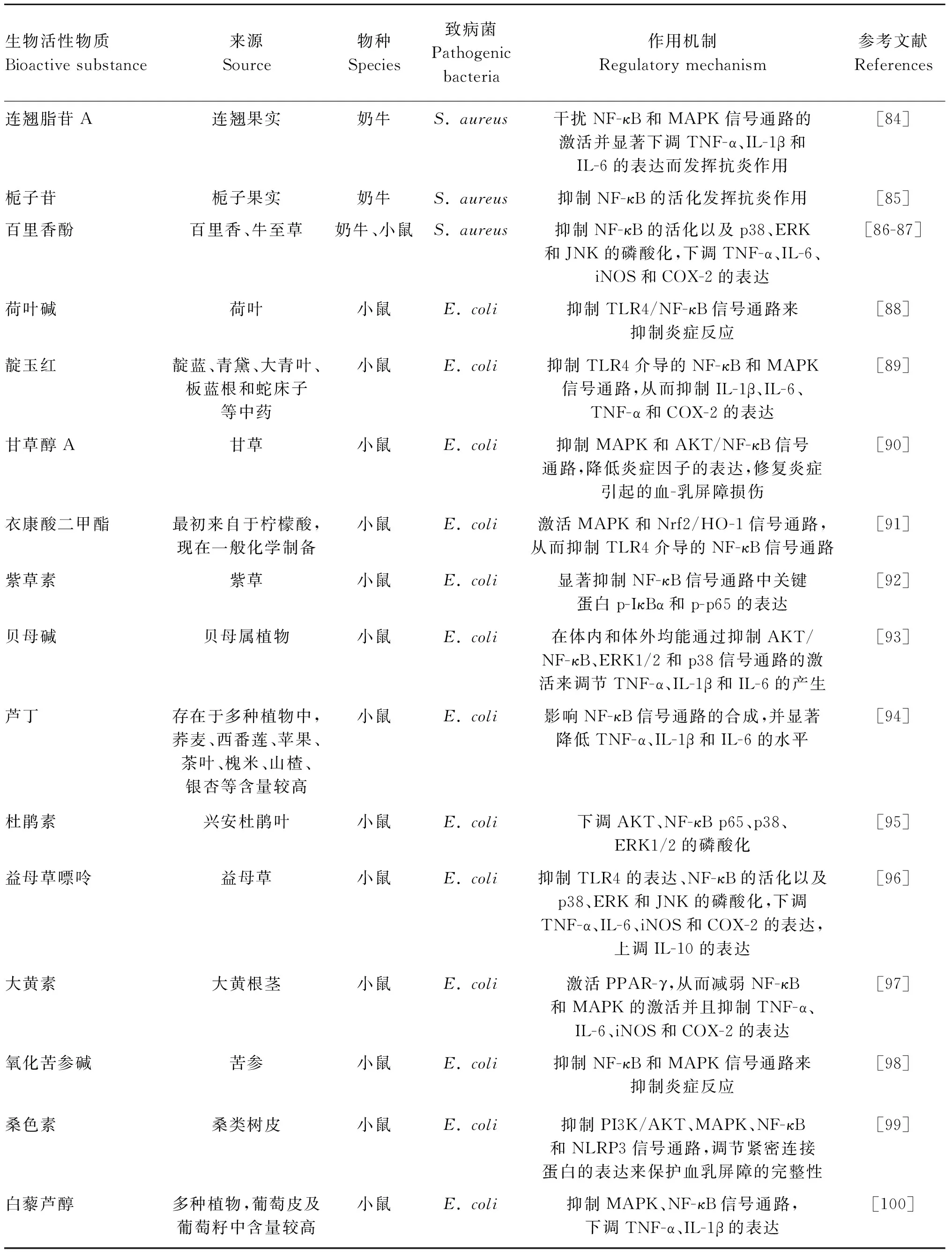
(转下页 Carried forward)
4 展 望
NF-κB作为细胞内重要的转录调节因子,已成为奶牛乳腺炎研究的重要靶点,调控NF-κB信号通路是控制奶牛乳腺炎的有效策略。近年来,学者们研究了部分mRNA和非编码RNA通过NF-κB调节乳房炎的分子作用机制。同时,已发现较多生物活性物质可通过NF-κB通路对乳腺炎产生联合治疗效果。但是,上述研究大部分仅集中在细胞水平上,亟待开展在实验动物及奶牛活体水平的验证。此外,非编码RNA通过NF-κB信号通路对奶牛乳腺炎的调控作用机制研究较少,尤其是circRNA暂未见报道。因此,更多非编码RNA通过NF-κB通路对奶牛乳腺炎的分子调控机制仍然需要深入研究。探明NF-κB通路的调节机制,可为奶牛乳腺炎的生物治疗、乃至生物活性药物研发与应用奠定基础,将有助于实现奶牛安全健康养殖和提高牧场经济效益。
