猪RNA聚合酶Ⅱ单克隆抗体的制备与应用
2021-11-04田小欢任瑞敏赵书红曹建华
田小欢,刘 茹,孙 艳,任瑞敏,余 梅,3,赵书红,3,曹建华,3*
(1. 华中农业大学 农业动物遗传育种与繁殖教育部重点实验室,武汉 430070; 2. 华中农业大学 农业农村部猪遗传育种重点实验室,武汉 430070; 3. 华中农业大学 生猪健康养殖协同创新中心,武汉 430070)
哺乳动物的基因转录主要由RNA聚合酶(RNA polymerase, RNA Pol)执行,可分为Pol Ⅰ、Ⅱ和Ⅲ 3类。虽然3种酶的结构具有相似性,都是高度保守的多亚基组成复合物,且都具有RNA合成功能,但它们识别不同的启动子区域,并需要一系列启动子特异结合的复合物协同作用才能启动转录[1-2]。RNA Pol Ⅱ(RNAPⅡ或Pol2)作为哺乳动物细胞内最活跃、调节机制最复杂、研究最多的的一类RNA聚合酶,存在于核质中,是由12个亚基组成的分子量为550 ku的巨大复合物[3],指导mRNA、snRNA、miRNA和1ncRNA等的合成[4]。RNAPⅡ大亚基的羧基末端(Rbp1)具有独特的结构,由Y-S-P-T-S-P-S七肽重复序列组成,称为羧基末端结构域,这段结构在物种间具有保守性。在高等真核生物中,七肽重复52次,丝氨酸2和丝氨酸5是激酶活性的靶点,并经历动态磷酸化循环。RNAPⅡ作为一个巨大的蛋白质复合物,由数十种蛋白质组成,通过各亚基的特异性作用以及基础转录因子和辅因子的协调作用,在转录的起始、延伸和终止等过程中发挥作用,最近有研究证明,RNA聚合酶的亚基有可能也是转录调节因子的额外靶标[5-6]。聚合酶复合物系统协同发挥功能,有效地完成RNA的合成,其研究对于理解生命形式的生长、繁殖和进化至关重要。目前,针对RNAPII的商业化抗体多是多克隆抗体,批次之间存在较大差异,导致在进行免疫学相关试验如ChIP-seq时,产生较高的假阳性信号,极大的影响了结果的准确性,因此亟待需要一种特异性强、结合速度快、无批次差异的单克隆抗体。
本试验利用生物信息学方法针对猪RNAPII设计免疫原,将其化学合成后免疫小鼠,融合获得杂交瘤细胞,进而提纯得到单克隆抗体,从而为猪的生物学研究提供重要的试验材料。
1 材料与方法
1.1 试验材料
1.1.1 细胞及供试动物 猪肺泡巨噬细胞系3D4/21(ATCC,CRL-2843)、骨髓瘤细胞系SP2/0(ATCC,BFN60806599)、Bal b/c雌性4~8周龄小鼠(实验动物中心)。
1.1.2 主要试剂 BCA法蛋白质浓度测定试剂盒(碧云天,货号P0012);RPMI1640培养基(Thermo Fisher Scientific,A1049101);HRP标记的羊抗鼠IgG(Sigma,A9309)、弗氏完全佐剂(Sigma,F5881)、弗氏不完全佐剂(Sigma,F5506)、HAT 混合盐(Sigma,H0262);FITC 标记的羊抗鼠 IgG(Thermo Fisher,F2761);无菌石蜡(环凯微生物,029110);小鼠单克隆抗体 Ig 类/亚类/亚型鉴定用 ELISA 试剂盒(洛阳佰奥通实验材料中心,C060101-L);G DynaBeads(Life,10004D);蛋白酶K(Ambion,AM2546); NEBNext Ultra II DNA prep kit(NEB,E7645s)。
1.2 抗原多肽制备
猪RNAPII多肽序列来自NCBI蛋白数据库(XP_020923484.1),全长为1 959个氨基酸。通过PredictProtein分析蛋白质的二级结构(https://predictprotein.org/)、TMHMM预测跨膜区(http://www.cbs.dtu.dk/services/TMHMM/)、SignalP分析信号肽(http://www.cbs. dtu.dk/services/SignalP/)以及用NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对基因的特异性进行分析,同时采用ABCpred预测B细胞表位(https://webs.iiitd.edu.in/raghava/abcpred/)。综合以上分析结果,选择靠近C末端的氨基酸序列YSPTSPSYSPTSPS作为抗原进行化学合成,通过巯基偶联到KLH(Keyhole Limpet Hemocyanin)上作为免疫原,通过巯基偶联到BSA(Bovine Serum Albumin)上作为筛选原。
1.3 动物免疫及抗血清ELISA检测
1.3.1 动物免疫 使用化学合成的抗原免疫5 只发育4~8周龄的雌性Bal b/C小鼠,1~6次免疫均采用腹部皮下分点注射,剂量为100 μg·只-1;冲击免疫时采用尾静脉注射,剂量为200 μg·只-1。POLR2A-KLH偶联蛋白和佐剂以1∶1混匀(首免采用完全弗氏佐剂乳化,二免至六免采用不完全弗氏佐剂乳化);操作时间:首免3周后进行第二次免疫,二免至六免,间隔均为2周,在六免之后第36天进行冲击免疫,免疫原用生理盐水混匀,剂量为200 μg·只-1。 在冲击免疫3 d后进行采血,血清离心,4 000 r·min-1离心15 min,取上清。
1.3.2 抗血清ELISA检测 包被POLR2A,用包被缓冲液稀释至1 μg·mL-1,用1×PBS按照以下梯度稀释免疫后小鼠血清:1∶1 000,1∶2 000,1∶4 000, 1∶8 000,1∶16 000,1∶32 000,1∶64 000,1∶128 000, 100 μL·孔-1按照稀释倍数从小到大依次加入到酶标板中,同时设置阳性血清、未免疫血清阴性对照和PBS空白对照,进行ELISA检测,计算阳性血清与阴性血清之比(positive/negative,P/N),当P/N≥2.1时出现相近比值的最大稀释倍数,为抗体效价。
1.4 细胞融合及筛选
选择1只无菌制备且免疫达标的小鼠进行融合和筛选亚克隆[7],筛选两次亚克隆后,获得稳定分泌的杂交瘤细胞株。亚克隆细胞株以及建株细胞采用间接ELISA方法检测:用包被缓冲液稀释筛选原C-YSPTSPSYSPTSPS + BSA至1 μg·mL-1,用1×PBS缓冲液按照以下梯度进行稀释1∶1 000,1∶2 000, 1∶4 000,1∶8 000,1∶16 000,1∶32 000,1∶64 000, 1∶128 000,100 μg·孔-1按照稀释倍数从小到大依次加入反应孔中,同时设置好阳性(免疫后小鼠血清1∶1 000稀释)和阴性对照孔(1%BSA),进行ELISA检测,用酶标仪测定波长为450 nm处的OD值。
1.5 单克隆抗体腹水的制备、纯化和鉴定
1.5.1 单克隆抗体腹水制备 取4~8周龄的雌性Bal b/c小鼠,腹腔注射液体石蜡,然后将对数生长期的杂交瘤细胞用无血清培养基洗涤并悬起,计数5×105个·mL-1,悬浮的细胞腹腔注射。约7 d后待小鼠腹部有明显隆起时开始收集腹水。取出的腹水于4 ℃ 4 000 r·min-1离心10 min。小心吸出中间的腹水收集于离心管中,-20 ℃保存。
1.5.2 单克隆抗体的纯化及效价鉴定 采用Protein G亲和层析法按说明书从腹水中纯化抗体。并使用Bradford测定法测定浓度,通过SDS-PAGE验证单抗纯度,将纯化后的抗体保存于-20 ℃,并通过间接ELISA方法检测效价。
1.5.3 单克隆抗体的亚型鉴定 将获得的单克隆抗体用小鼠单克隆抗体亚类鉴定试剂盒进行亚型鉴定,按试剂盒说明书操作。
1.6 Western blot进行特异性鉴定
将猪肺泡巨噬细胞3D4/21接种至6孔板上,生长至对数生长期时收集细胞,提取总蛋白。将总蛋白进行SDS-PAGE电泳,然后转移到0.45 μm PVDF膜上,在室温下用5%脱脂乳封闭2 h后,将膜与一抗(1∶1 000稀释)在4 ℃下孵育过夜。用PBST洗涤3次后,将HRP偶联的山羊抗鼠IgG加入膜中,在37 ℃下孵育1 h后,用PBST清洗膜,最后显影曝光观察结果。
1.7 ChIP-seq检测抗体富集性
将 107个猪肺泡巨噬细胞3D4/21与1%甲醛在室温下交联10 min。通过细胞裂解获得染色质,然后在冰上超声处理(Sonics, VCX130)6 min。将10 μg ChIP级抗体与 100 μL蛋白G DynaBeads在4 ℃下孵育2 h。将染色质和抗体包被的磁珠在旋转仪上于4 ℃共免疫沉淀过夜。通过蛋白酶K在55 ℃消化过夜,将ChIP DNA解交联。根据说明书要求,通过使用NEBNextUltra II DNA文库制备试剂盒,对ChIP DNA进行文库制备。使用 Illumina HiSeq3000 平台对ChIP-seq文库进行高通量测序,使用双端测序模式(2×150 bp)。
2 结 果
2.1 免疫血清效价检测
采用上述动物免疫方法中涉及的步骤对5只雌性Bal b/c小鼠进行免疫,5次免疫之后采用ELISA方法检测血清效价,由图1可知,1~4号小鼠血清效价均可达到1∶128 000,第五只小鼠血清效价较低,低于1∶50 000,其效价结果与Control组类似。
2.2 细胞融合及阳性克隆筛选
对4号小鼠的细胞融合检测结果进行分析,共构建10个细胞融合样本,即1~10号,每个融合细胞样本存在8个重复,即A-H,再从各个重复中挑选12个融合细胞株进行ELISA检测,编号为1~12号,一共进行了960株细胞上清检测。最终,挑选以下 40 株细胞上清(编号分别为1B3、1B5、1E9、1E12、2G1、2H1、2C10、2B11、2B12、3D1、3E5、3H5、3H6、4F2、4E5、4H8、4H9、5G3、5B5、5G7、6A1、6C7、6E9、6B12、7F3、7C4、7A7、7G11、8H4、8D5、8A7、8A8、9A2、9D3、9G4、9C6、10D1、10F2、10H10、10D12)进行Western blot(WB)检测,结果如图2所示,共挑选7系8株细胞,编号分别为2B11、3E5、4F2、7A7、8A8、9A2、10F2、10H10,8株细胞上清的WB检测结果显示,在250 ku位置处存在明显条带,然后根据WB检测结果进行两次或三次亚克隆,最后筛选阳性单克隆进行细胞定株。
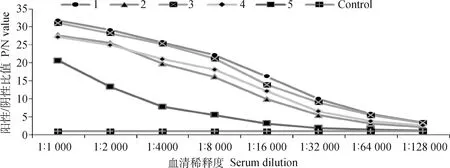
采集5只小鼠(编号1~5)的血清进行ELISA检测,结果以阳性/阴性比值(P/N)表示The sera of 5 mice (numbered 1-5) were collected for ELISA test, and the results were expressed as the positive/negative value (P/N)图1 血清效价检测Fig.1 Serum titer test graph

T.曝光时间;1~40.细胞融合上清编号:1B3、1B5、1E9、1E12、2G1、2H1、2C10、2B11、2B12、3D1、3E5、3H5、3H6、4F2、4E5、4H8、4H9、5G3、5B5、5G7、6A1、6C7、6E9、6B12、7F3、7C4、7A7、7G11、8H4、8D5、8A7、8A8、9A2、9D3、9G4、9C6、10D1、10F2、10H10、10D12。A. 1~26号融合上清的Western blot检测结果;B. 27~40号融合上清的Western blot检测结果;C. 阳性(AK151-M01、AK151-M04)和阴性抗体对照Western blot图T. The exposure time; 1-40. Number of cell fusion supernatant: 1B3, 1B5, 1E9, 1E12, 2G1, 2H1, 2C10, 2B11, 2B12, 3D1, 3E5, 3H5, 3H6, 4F2, 4E5, 4H8, 4H9, 5G3, 5B5, 5G7, 6A1, 6C7, 6E9, 6B12, 7F3, 7C4, 7A7, 7G11, 8H4, 8D5, 8A7, 8A8, 9A2, 9D3, 9G4, 9C6, 10D1, 10F2, 10H10, 10D12. A.Western blot detection results of the fusion supernatant of 1-26; B. Western blot detection results of the fusion supernatant of 27-40;C. Western blot diagram of positive (AK151-M01, AK151-M04) and negative antibody control图2 杂交瘤细胞融合的Western blot检测结果Fig.2 Western blot test results of hybridoma cell fusion
根据一亚ELISA检测结果,共挑选8 系16 株细胞上清(编号分别为2B11C11、2B11G11、3E5A4、3E5H5、4F2B8、4F2A6、7A7B2、7A7F6、8A8C7、8A8A12、9A2G1、9A2A3、10F2E11、10F2D12、10H10H3、10H10A6)进行WB检测,结果如图3所示,有5 系共5 株细胞与阳性血清特征一致,编号分别为2B11C11、3E5H5、4F2A6、7A7B2、8A8A12,WB检测结果表明,在250 ku位置附近存在目标条带。

T.曝光时间;1~16. 杂交瘤细胞亚克隆编号:2B11C11、2B11G11、3E5A4、3E5H5、4F2B8、4F2A6、7A7B2、7A7F6、8A8C7、8A8A12、9A2G1、9A2A3、10F2E11、10F2D12、10H10H3、10H10A6。A. 一亚上清的Western blot检测结果;B. 阳性和阴性抗体对照Western blot图T. The exposure time; 1-16. Number of hybridoma cell subclones: 2B11C11, 2B11G11, 3E5A4, 3E5H5, 4F2B8, 4F2A6, 7A7B2, 7A7F6, 8A8C7, 8A8A12, 9A2G1, 9A2A3, 10F2E11, 10F2D12, 10H10H3, 10H10A6. A. Western blot test result of a sub-supernatant; B. Western blot diagram of positive and negative antibody control图3 杂交瘤细胞亚克隆的Western blot检测结果Fig.3 Western blot test results of hybridoma cell subclones
对一亚克隆进行二亚筛选,根据ELISA检测结果,挑选3 系10 株细胞(单克隆编号分别为3E5H5E1、3E5H5D2、3E5H5A3、3E5H5A4、4F2B8B2、4F2B8A3、4F2B8G4、4F2B8B9、8A8A12A4、8A8A12C6)进行建株,结果如图4所示,最终筛选出建株细胞2 系8 株单克隆细胞,编号为3E5H5E1、3E5H5D2、3E5H5A3、3E5H5A4、4F2B8B2、4F2B8A3、4F2B8G4、4F2B8B9。其中,3E5H5E1、3E5H5D2、3E5H5A3、4F2B8B2、4F2B8A3、4F2B8G4、4F2B8B9在250 ku位置附近鉴定到明显条带,3E5H5A4有微弱条带,但其相对于阴性血清来说,能够判定为阳性。最终,8株单克隆细胞将用于后续试验。
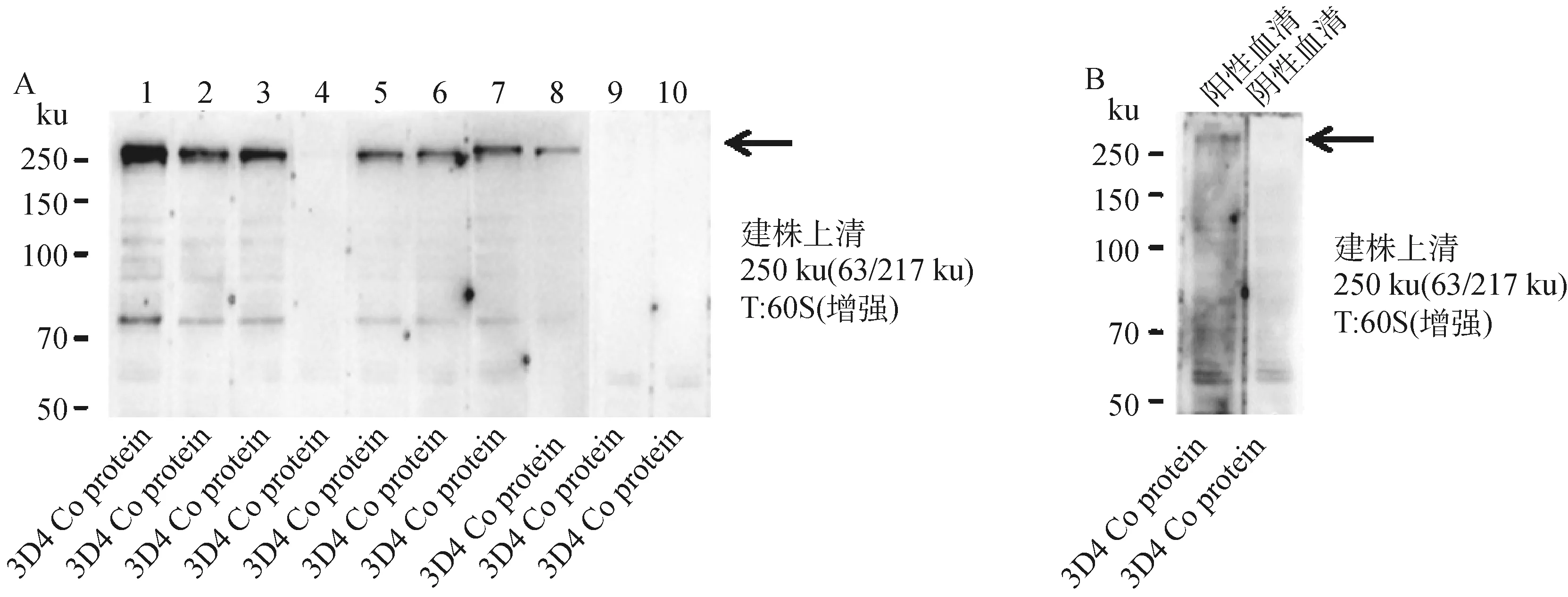
T. 曝光时间;1~10. 杂交瘤细胞建株编号:3E5H5E1、3E5H5D2、3E5H5A3、3E5H5A4、4F2B8B2、4F2B8A3、4F2B8G4、4F2B8B9、8A8A12A4、8A8A12C6。A. 建株上清的Western blot检测结果;B. 阳性和阴性抗体对照Western blot图T. The exposure time; 1-10. Number of established hybridoma cell lines:3E5H5E1, 3E5H5D2, 3E5H5A3, 3E5H5A4, 4F2B8B2, 4F2B8A3, 4F2B8G4, 4F2B8B9, 8A8A12A4, 8A8A12C6. A. Western blot test results of the supernatant of the established strain; B. Western blot diagram of positive and negative antibody control图4 杂交瘤细胞建株的Western blot检测结果Fig.4 Western blot test results of established hybridoma cell lines
在杂交瘤细胞建株之后,对筛选的杂交瘤细胞进行培养,结果如图5所示,细胞活力较强,形态为圆形,达到试验的要求,可进一步冻存备用。

杂交瘤细胞呈高折射率圆形,说明细胞活力强。放大倍数为100×,视窗放大倍数为400×,标尺是100 μmHybridoma cells are round with high refractive index, indicating strong cell viability. The magnification is 100×, the window magnification is 400×, and the scale is 100 μm图5 杂交瘤细胞的低密度图Fig.5 Microscopic image of hybridoma cells
2.3 单克隆抗体腹水制备及效价检测
制备分泌RNAPII单克隆抗体的杂交瘤细胞株3E5H5A3的小鼠腹水,通过Bradford测定法对抗体浓度进行检测,结果为2.74 mg·mL-1。利用间接 ELISA 方法对提纯后的单克隆抗体以及流穿模式下粗提抗体的效价进行检测,即抗体和流穿。通过计算阳性血清与阴性血清的比值(Positive/Negative,P/N),当P/N≥2.1时出现相近比值的最大稀释倍数为抗体效价。结果如图6所示,提纯后的单克隆抗体及流穿模式下抗体的效价均能达到1∶128 000, 达到了抗体效价的要求。

图6 猪RNAPⅡ单克隆抗体效价检测结果Fig.6 Porcine RNAPⅡ monoclonal antibody titer test results
2.4 单克隆抗体亚类、特异性鉴定
利用小鼠单克隆抗体 Ig 类/亚类/亚型鉴定 ELISA 试剂盒对建株细胞的单克隆抗体进行亚类鉴定,抗体重链为IgG 2A型,轻链为Kappa型。
2.5 单克隆抗体在染色质免疫共沉淀(ChIP-seq)中的初步应用
2.5.1 制备的单克隆抗体与商业化抗体的相关性比较 本研究制备的猪RNAPⅡ单克隆抗体(JCLab)与某商业化单抗(Xcompany)在ChIP-seq试验中具有高度相关性(r=0.89),表明二者具有良好的一致性,结果如图7所示。
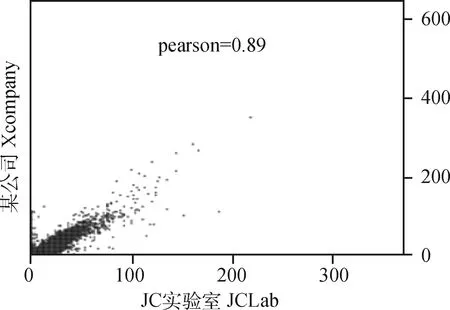
图7 本研究制备的单抗与商业化单抗的Pearson相关性Fig.7 Pearson correlation between the monoclonal antibody prepared in this study and the commercial monoclonal antibody
2.5.2 制备的单克隆抗体与商业化鼠源单抗比较 猪RNAPⅡ单克隆抗体ChIP-seq效果对比(chr2:6 400 000~6 900 000)。将本研究制造的猪源鼠单抗与某公司商业化鼠源单抗进行ChIP-seq试验,由图8可知,本抗体的ChIP-seq峰(JCLab)与对照组(Xcompany)之间二者具有高度一致性,说明本单克隆抗体具有良好的ChIP效果。

图8 本研究制备的猪源鼠单克隆抗体与商业抗体的ChIP-seq富集IGV视图Fig.8 Use the IGV view to show the ChIP-seq enrichment of monoclonal antibodies prepared in this study and commercial antibody
猪RNAPⅡ单克隆抗体ChIP富集效果(fingerprint)强于某商业化单抗。由图9可知,试验对照为基因组Input,结果显示,两种抗体对RNAP Ⅱ都有显著富集。与某商业化单抗(Xcompany)相比,本研究制造的猪源鼠单抗(JCLab)在ChIP-seq试验中,富集曲线更加陡峭且集中,表明其RNAPII富集效果强于前者。
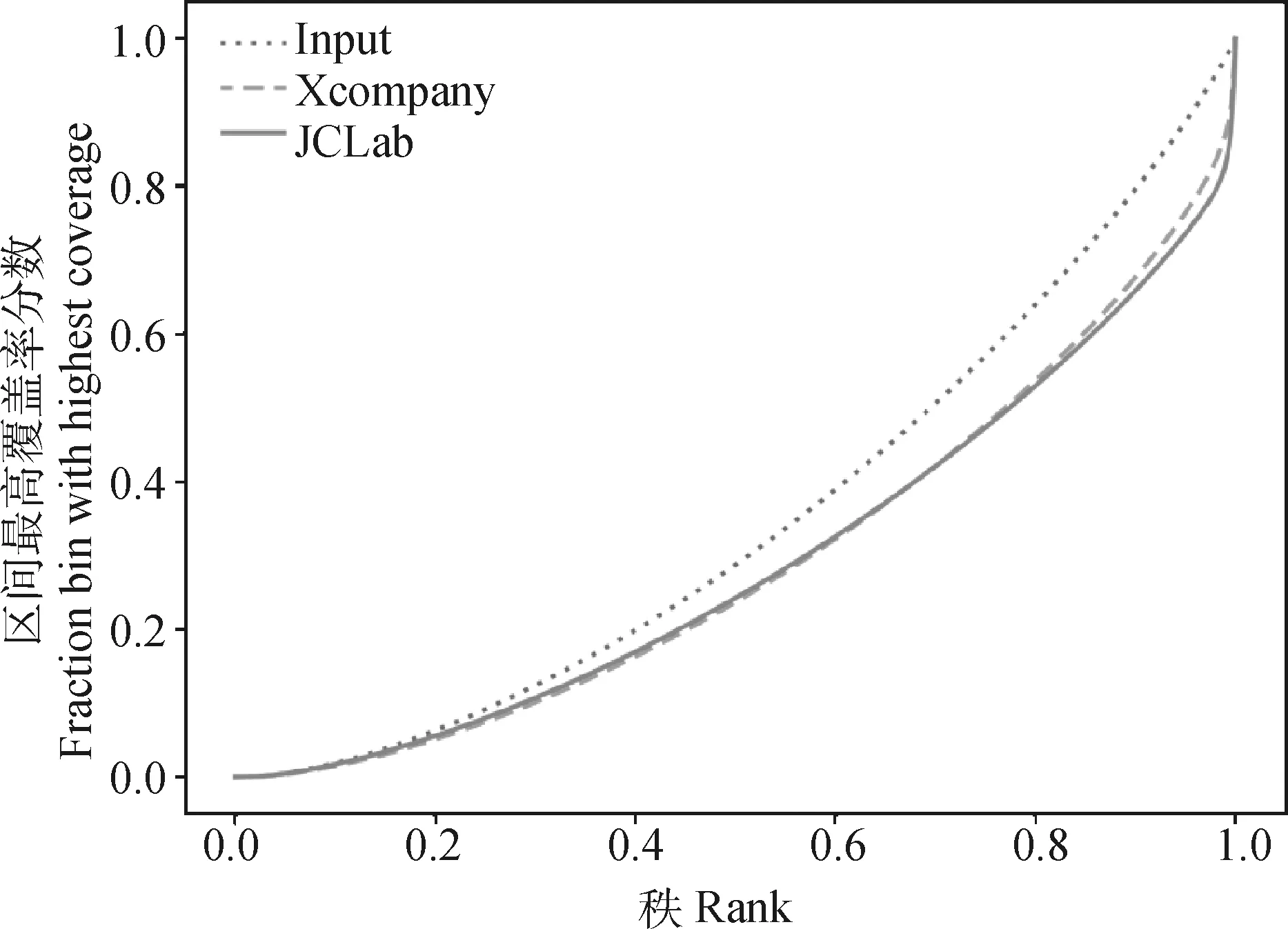
图9 本研究制备的猪源RNAPⅡ单克隆抗体与某商业化抗体的ChIP-seq富集效率图Fig.9 ChIP-seq enrichment map of pig-derived mouse monoclonal antibody prepared in this study and commercial antibody
3 讨 论
在多细胞生物中,基因的转录调控是生物体或细胞行使特定功能的重要途径[8]。RNA聚合酶Ⅱ作为基因转录过程中的核心因子,以一种高度调控的方式合成RNA,在转录调控过程中发挥重要作用,RNA聚合酶Ⅱ复合物在所有的哺乳动物中是高度保守的,负责大多数基因产物的表达调控[9-11]。其中一种就是RNA聚合酶沿着DNA移动时存在停留现象,这种功能失调会导致基因表达水平过高或过低,进而产生疾病[12-13]。真核生物蛋白编码基因的转录起始于启动子DNA上的起始前复合物(pre-initiation-complex,PIC)的形成,包含RNAPⅡ和转录因子[14]。增强子通过RNA聚合酶Ⅱ介导的染色质成环与所调控基因的启动子区域靠近,通过相互作用实现对基因的调控。为了探索启动子与增强子相关的染色质相互作用,使用RNA聚合酶Ⅱ染色质相互作用与配对末端标签(ChIA-PET,全称)方法进行研究,捕捉到RNA聚合酶Ⅱ参与的相互作用[15]。目前的研究表明,真核生物RNA聚合酶Ⅱ在转录起始后的暂停中发挥着重要的作用,并作为一种广泛的基因调控机制被研究[16]。RNA聚合酶Ⅱ暂停是转录过程中一般的调节步骤[17-19]。Zatreanu等[20]利用TFIIs的突变体对人类细胞的RNA Pol Ⅱ进行特异性诱导,进而使其暂停。结果表明,TFIIs突变表达导致延伸速率变慢,基因末端的聚合酶相对消耗增加、RNA Pol Ⅱ暂停水平提高,同时影响到mRNA的剪接和终止[20-21]。研究表明,RNA Pol Ⅱ稳定性调控对于DNA损伤修复至关重要,RNA Pol Ⅱ自身在赖氨酸上的泛素化修复是DNA损伤反应中的重点,当DNA受到损伤时,转录的延伸将会受到限制[22-23]。Quintero-Cadena等[24]构建的数据驱动模型同时证明了RNA聚合酶Ⅱ长度的变化会导致转录、相分离发生紊乱,Abraham等[25]研究表明,核仁中的RNA聚合酶Ⅱ作为一种新的核糖体生物发生的主调节因子,对健康和疾病具有重要的影响。Kulaeva 等[26]研究表明,RNA聚合酶Ⅱ与转录因子、组蛋白修饰以及染色质构象的相互作用和真核生物的基因表达调控息息相关,以上研究表明了RNA聚合酶Ⅱ在真核生物的基因转录、生长发育以及疾病发生中承担着重要的任务,是当代分子生物学研究的重要课题之一。而RNA聚合酶Ⅱ抗体作为试验的基本材料在市场上一直存在批次间差异较大和富集性不强等问题,导致试验结果差异较大,因此,亟待需要特异性强、效价高的RNA聚合酶Ⅱ单克隆抗体为研究提供基本的试验材料,本研究完善了以往研究中RNA聚合酶Ⅱ抗体的缺点,得到重链217 ku,为IgG 2A型,轻链63 ku,为Kappa型的RNA聚合酶II单克隆抗体,将得到的单克隆抗体进行初步应用,并与商业化RNA聚合酶Ⅱ抗体的染色质免疫共沉淀试验结果进行比较,富集性更强、特异性更好且无批次间的差异,可为染色质三维构象的解析提供试验材料。
4 结 论
本研究获得鼠源单克隆细胞株,并成功构建了猪RNA聚合酶Ⅱ单克隆抗体。将其初步应用染色质免疫共沉淀ChIP-seq试验,将本研究抗体数据与某公司商业化抗体数据结果进行比较,获得较为相似结果,但其效率获得明显提高。本研究所获得的RNA聚合酶Ⅱ单克隆抗体容易标准化,在不同批次中存在的差异较小,特异性较强。本研究构建的单抗为研究转录过程中的延伸、暂停机制提供了重要的生物学材料。
