相关巨噬细胞对肝癌SMCC-7721 细胞迁移侵袭的影响及其机制研究
2021-11-04李琳李建东高志康徐浩崔艳峰
李琳 李建东 高志康 徐浩 崔艳峰
原发性肝细胞癌(HCC)是人类最具侵袭性的高度恶性肿瘤,因为它的侵袭、转移能力,被列为癌症相关死亡的最常见原因之一[1,2]。伴随免疫学、分子生物学的发展,肝癌在免疫治疗方面已经取得了很大的进展,但高复发率仍然是延长生存期的一个主要障碍。HCC 是一种与慢性炎症相关的肿瘤。在肝细胞癌的炎症微环境中,入侵的炎症细胞主要是肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)[3]。研究表明,巨噬细胞的去除可以抑制肿瘤的进展和转移[4-6]。在肿瘤微环境下,研究巨噬细胞在肿瘤细胞侵袭转移中的分子机制[7],将为治疗HCC 提供新的策略。为此,本研究通过分化巨噬细胞作用肝癌SMCC-7721 细胞,探究相关巨噬细胞与SMCC-7721 细胞增殖、迁移、侵袭的生物学关系,为揭示HCC 的发病机制提供实验依据。
1 材料与方法
1.1 实验材料 人单核巨噬细胞(THP-1)获自中国科学院细胞库。人肝癌细胞SMCC-7721 细胞为本室保存。
1.2 实验方法
1.2.1 培养单核巨噬细胞 THP-1 在RPMI-1640 培养基(Sangon Biotech)中培养,该培养基含10%胎牛血清(FBS,Sangon Biotech)和1%青霉素/链霉素。细胞在37℃和5% CO2环境中培养。
1.2.2 巨噬细胞的极化 取处于对数生长期、生长状态良好的THP-1,按2×104/孔接种于24 孔板共培小室上室中。50 mg/ml 的MCSF 作用24 h 后诱导THP-1分化为M0 巨噬细胞;100 ng/ml 脂多糖(LPS)和γ-干扰素(IFN-γ)处理24 h,诱导THP-1 向M1 型巨噬细胞分化。THP-1 与IL-4(20 mg/ml)共孵育24 h 分化为M2 型巨噬细胞。THP-1 在含50% HepG2 细胞上清液和10%胎牛血清的RPMI-1640 培养基中培养7 d,诱导分化为TAMs。
1.2.3 细胞培养 SMCC-7721 细胞接种于含10%胎牛血清和1%青霉素/链霉素的RPMI-1640 培养基,37℃和5% CO2的环境中培养。
1.2.4 免疫印迹 使用组总蛋白提取试剂盒(Sangon Biotech)从细胞中提取总蛋白。通过蛋白质电泳分离不同样品中的等效蛋白,然后转化到硝酸纤维素膜(NC)上。用一抗于4℃孵育过夜,浸泡于封闭缓冲液中。用TBST 洗膜数次后,用标记有辣根过氧化物酶的二抗与膜共孵育。用ImageJ 软件检测蛋白条带的灰度值。
1.2.5 MTT 分析 SMCC-7721 细胞与1.2.2 极化的巨噬细胞的上清孵育。随后,将SMCC-7721 细胞重悬于含10%胎牛血清的RPMI-1640 培养基中,调整细胞密度至10 ml。将细胞悬浮液接种于96 孔板中,每孔悬浮液100 μl,培养24 h。每孔加入10 μl MTT(5 mg/ml),37℃培养箱中培养4 h。然后,去除细胞上清,加入DMSO(100 μl)混匀于每孔中。采用酶标仪在490 nm 波长下检测样品的吸光度。
1.2.6 Transwell 分析 SMCC-7721 细胞与1.2.2 极化的巨噬细胞上清孵育24 h。随后,使用孔径为8 μm 的聚碳酸酯膜(Corning)24 孔Boyden 室进行实验。用无血清培养基将基质稀释至1 mg/ml,盖于Boyden chambers上腔室。然后将SMCC-7721 细胞悬液(5×104)接种到上室;下腔中加入含10%胎牛血清的600 μl 新鲜培养基。37℃培养24 h 后,取出小室,4%多聚甲醛固定30 min,0.5%结晶紫染色20 min。用干净的棉球将上室一侧的未迁移的细胞擦干净,晾干,在荧光显微镜下观察并计数细胞。细胞迁移实验除Transwell 小室不包被基质胶外,其余操作同侵袭实验。
1.3 统计学方法 采用SPSS18.0 统计学软件处理数据。计量资料以均数±标准差()表示,采用t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 四种巨噬细胞对SMCC-7721 细胞增殖能力的影响 四种巨噬细胞上清液与SMCC-7721 细胞共培养12 h、24 h 进行MTT 实验结果如图1 所示,相较于M0组,M1 组的SMCC-7721 细胞减少,M2 和TAMs 组的SMCC-7721 细胞增殖能力明显增强,差异具有统计学意义(P<0.05)。结果表明,M1 巨噬细胞抑制SMCC-7721 细胞增殖,M2 巨噬细胞和TAMs 促进SMCC-7721 细胞增殖。

图1 四种巨噬细胞对SMCC-7721 细胞增殖能力的影响
2.2 四种巨噬细胞上清液对SMCC-7721 细胞迁移能力的影响 四种巨噬细胞上清液与SMCC-7721 细胞共培养后进行Transwell 实验。结果如图2(A)所示,相较于M0 组,M1 组的SMCC-7721 细胞迁移能力减弱,M2 和TAMs 组的SMCC-7721 细胞迁移能力明显增强,差异具有统计学意义(P<0.05)。结果表明,M1 巨噬细胞可抑制SMCC-7721 细胞迁移能力,M2 巨噬细胞和TAMs 促进SMCC-7721 细胞迁移能力。
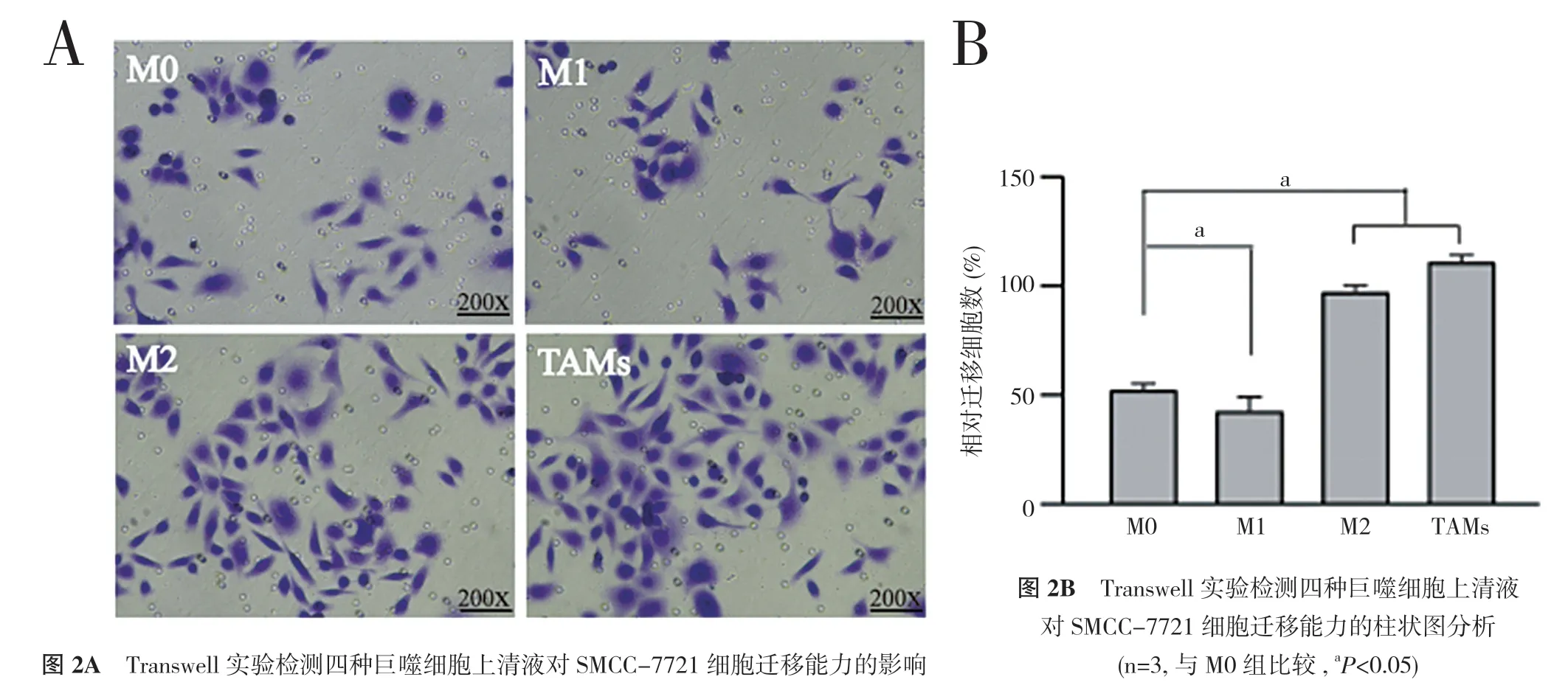
图2 四种巨噬细胞对SMCC-7721 细胞迁移能力的影响
2.3 四种巨噬细胞上清液对SMCC-7721 细胞侵袭能力的影响 Transwell 实验结果如图3(A)所示,相较于M0 组,M1 组的SMCC-7721 细胞侵袭能力减弱,M2 和TAMs 组的SMCC-7721 细胞侵袭能力明显增强,差异具有统计学意义(P<0.05)。由此表明,M1 巨噬细胞可抑制SMCC-7721 细胞侵袭能力,M2 巨噬细胞和TAMs促进SMCC-7721 细胞侵袭能力。

图3 四种巨噬细胞对SMCC-7721 细胞侵袭能力的影响
2.4 Western blot 检测四种巨噬细胞上清液对上皮间质转化EMT 标记蛋白表达的影响 Western blot 检测结果显示,与M0 组相比,M1 组的E-cadherin 表达升高,N-cadherin 和Vimentin 表达下降;M2 和TAMs 组的E-cadherin 表达下降,N-cadherin 和Vimentin 表达升高。这说明M1 巨噬细胞抑制SMCC-7721 细胞发生EMT,M2 巨噬细胞和TAMs 能够诱导SMCC-7721 细胞发生EMT。见图4。

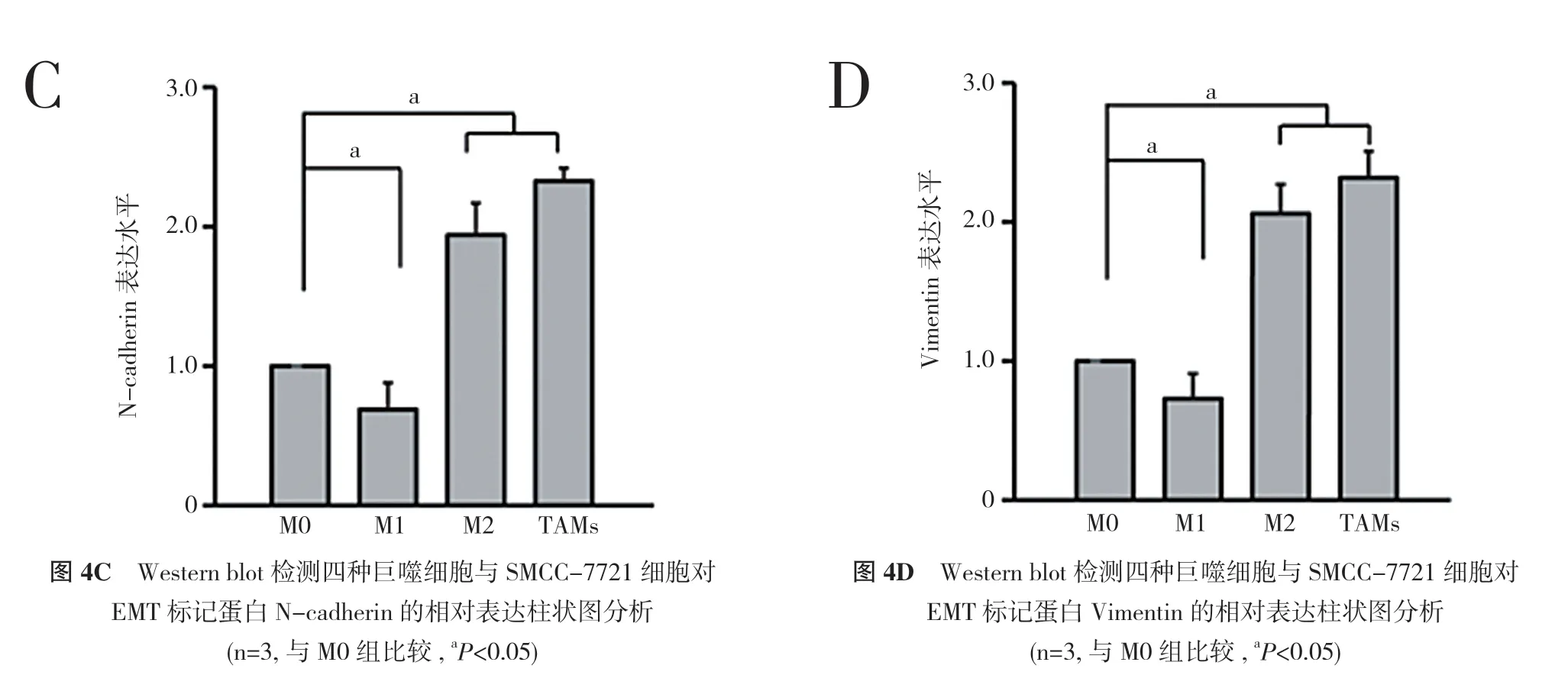
图4 Western blot 检测四种巨噬细胞与SMCC-7721 细胞对EMT 标记蛋白E-cadherin、N-cadherin 和Vimentin 的表达
4 讨论
肝癌是全球第五大常见癌症,是死亡率仅次于胃癌、食道癌的第三大恶性肿瘤[8]。尽管近年来肝癌的诊断和治疗均取得极大进展,但肝癌患者的预后仍然很差。肝内复发和转移是肝癌治疗的主要挑战,也是导致肝癌患者的预后不良主要原因[9,10]。因此,寻找新的治疗肝癌复发和转移方案是至关重要的。
HCC 是一种与慢性炎症相关的肿瘤。在肝细胞癌的炎症微环境中,入侵的炎症细胞主要是TAMs。免疫学研究表明,巨噬细胞有两种表型:M1 和M2。在肿瘤微环境中,巨噬菌体可以通过各种细胞因子(如IL-4 和IL-10)的刺激极化成M2 巨噬细胞。M1 巨噬细胞具有病原体清除和抗肿瘤活性的特点。相比之下,M2 巨噬细胞的主要功能是免疫抑制和促进肿瘤进展、新生血管和组织基质重构[11]。此外,TAMs 通过释放生长因子、细胞因子、趋化因子和蛋白酶在HCC 的各个阶段发挥着重要作用[12]。动物实验表明,巨噬细胞的去除可以抑制肿瘤的进展和转移。在我们的前期研究发现,肿瘤坏死因子-α(TNF-α)和白介素M1 巨噬细胞中高度表达,白介素-10(IL-10)的表达和白介素-13(IL-13)在M2 巨噬细胞明显上调。M0 巨噬细胞为非极化巨噬细胞,各种细胞因子的表达不会像极化巨噬细胞那样有明显的偏置。M1 型巨噬细胞产生大量的细胞因子,如白介素-12(IL-12)和TNF-α。M1 巨噬细胞IL-10 表达降低,表现出明显的促炎活性[13]。然而,M2 巨噬细胞高表达IL-10,而IL-12 下调,赋予了强大的抗炎特性[14]。因此,与M0 巨噬细胞相比,M2巨噬细胞和TAMs 中IL-12 和TNF-α 的表达降低[15],TAMs 表现出M2 样表型。
本研究发现,M1 巨噬细胞对SMCC-7721 细胞的增殖、迁移和侵袭有明显的抑制作用,而M2 巨噬细胞和TAMs 对SMCC-7721 细胞的增殖、迁移和侵袭有明显的促进作用。M2 巨噬细胞和TAMs 能够诱导SMCC-7721 细胞发生上皮间质转化相关蛋白标志物改变,E-cadherin 表达下降,N-cadherin 和Vimentin 表达升高。这些结果提示我们,巨噬细胞通过极化为M1 巨噬细胞抑制肝癌细胞增殖、迁徙和侵袭;M2 巨噬细胞和TAMs 促进肝癌细胞发生EMT 样改变,从而促进肝癌细胞的增殖、迁移和侵袭等生物学行为的改变。有研究发现,随着肝癌进展,肿瘤相关巨噬细胞参与肿瘤微环境的建立并促进肿瘤的浸润和转移[16],导致宿主细胞免疫紊乱及免疫沉默,刺激肿瘤生长因子生成,诱导炎性反应[17]。由此我们推测,在肝癌疾病的发展过程中,M2 巨噬细胞和TAMs 的促肿瘤效应超出M1 巨噬细胞抗肿瘤效应,造成机体免疫系统的紊乱,促进肿瘤的发展进程。
肝癌是发病进程多步骤、分阶段的疾病,EMT 是反映细胞侵袭、迁移能力的重要指标,抑制EMT 可减弱肝癌的转移,从而提高肝癌的临床治疗效果,降低肝癌复发率[18]。在肝癌细胞SMCC-7721 中,肿瘤巨噬细胞可以通过EMT 过程影响细胞侵袭,但在其他肝癌细胞系中是否有相同的意义,仍需我们进一步探究。
