芪参还五胶囊中虫类药材的仿生酶解工艺优化及抗凝血、溶栓活性评价
2021-11-04王世信杨美娜崔友祥闫国强丁洪青
王世信,杨美娜,崔友祥,闫国强,丁洪青
(1. 河北省沧州中西医结合医院 中药药学部,河北 沧州 061001;2. 河北省沧州中西医结合医院 脑病三科,河北 沧州 061001)
虫类药材应用历史悠久,但由于其自身特点和现代研究技术手段的局限性,对于虫类药材的化学组成、有效成分提取、药效物质基础等方面的研究始终面临诸多困难,且难以建立相应的质量控制标准,用药仍以原虫、原粉或超细粉入药,服用剂量较大。由于虫类药材的组成结构、成分含量与植物药有很大区别,所以传统植物药的提取方式并不适用于大多数虫类药研究。虫类药材中的蛋白质、氨基酸、黏多糖等大分子物质,在胃肠道多种有机酸、消化酶等作用下,被分解成小分子肽、低聚糖和其他小分子物质,进一步吸收入血并发挥药效[1-2]。基于此,近年众多学者研究模拟虫类药材在生物体内的消化过程,采用仿生酶解法提取有效成分,在保证药效的同时,以减少服药剂量和药物毒性[3]。
芪参还五胶囊是由经方“补阳还五汤”合用“桃红四物汤”加减化裁而来,做为我院协定处方应用多年,后开发成为医院制剂。全方由黄芪、太子参、桃仁、红花等十九味中药组成,具有补气活血、清热养阴、息风化痰、祛瘀通络等功效,方中含有地龙、全蝎、水蛭三味虫类药材,配合其他诸药合用,使息风止痉、破血逐淤、通络止痛效果更甚。现代药理研究证实,以上三味药具有抗凝血、抗血栓、促纤溶等多重药理活性,临床用于治疗脑中风、脑血栓、中风后遗症等,疗效显著[4-5]。为进一步提升药品质量,减少给药剂量,本文研究芪参还五胶囊中地龙、全蝎、水蛭三味虫类药材的提取工艺,采用仿生酶解法与水煎煮、醇提、匀浆等传统提取工艺进行比较,筛选和优化三味虫类药材的最佳提取工艺,并对其抗凝血、溶栓活性进行初步评价,现具体报道如下。
1 仪器与试药
1.1 仪器
ME104T/02电子分析天平(Mettler Toledo公司);JJ-2高速组织匀浆机(无锡杰瑞安仪器设备有限公司);DZF-6050型真空干燥箱(上海博讯实业有限公司);Alpha1860S紫外可见分光光度计(上海谱元仪器有限公司)。
1.2 试药
地龙、全蝎、水蛭药材购自于安徽友信药业有限公司,并经沧州市药检所鉴定分别为巨蚓科动物参环毛蚓Pheretima aspergillum (E. Perrier)、钳蝎科动物东亚钳蝎Buthus martensii Karsch 和水蛭科动物蚂蟥Whitmania pigra Whitman的干燥体。人工胃液:取盐酸9 ml加水稀释至1000 ml,即得。人工肠液:取0.2 mol/L磷酸二氢钾溶液250 ml,加0.2 mol/L 氢氧化钠溶液118 ml,加水稀释至1000 ml,即得。胃蛋白酶(≥ 250 u/mg)、胰蛋白酶(≥250 u/mg)、牛血清白蛋白 BSA(纯度≥96 %)均购自于Solarbio公司。活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)和血浆凝血酶时间(TT)试剂盒均购自于上海江莱生物科技有限公司。水为双蒸水,其余试剂均为分析纯。
1.3 动物
选用健康SD大鼠(雌雄各半),SPF级,8周龄,体质量260±20 g,由维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-0006,置于温度25±2 ℃,湿度45 %~70 %环境下适应性饲养1周,光照 12 h/12 h,每8 h通风换气,自由进食饮水。
2 方法与结果
2.1 提取方法的选择
2.1.1 水煎煮提取法 参照原芪参还五胶囊制剂质量标准(JZBZ20090553)中的煎煮工艺,取处方比例的三味虫药(地龙20 g、全蝎12 g、水蛭20 g),混合后粉碎成细粉(过80目),加8倍量水煎煮1 h,煎煮2次,离心去沉淀后,合并两次水煎液,分成2等分,一份减压浓缩后真空干燥,即得水煎煮提取物。
2.1.2 水提醇沉法 参考文献中方法[6-7],取“2.1.1”项下另一份水煎液,加入95 %乙醇调节含醇量达70 %,冷藏过夜,滤过,弃去沉淀,滤液减压回收乙醇后浓缩干燥,即得醇沉提取物。
2.1.3 生理盐水浸提法 参考文献中方法[8],取处方比例的三味虫药细粉,加10倍量生理盐水,超声10 min,冷浸20 min,3500 r/min离心20 min,上清减压浓缩后真空干燥,即得生理盐水浸提物。
2.1.4 匀浆法 参考文献中方法[9-10],取处方比例的三味虫药细粉,加入组织匀浆机内,加入10 倍量水,高速匀浆(10 000 r/min)3次,5 min/次,离心,合并3次上清,减压浓缩后真空干燥,即得匀浆提取物。
2.1.5 胃蛋白酶酶解法 参考文献中方法[7,11-12],取处方比例的三味虫药细粉,加入人工胃液调节pH 2.0,密闭,37 ℃水浴保温30 min,放冷至室温,加入生药量2 %胃蛋白酶,酶解2 h,3500 r/min离心20 min,取上清,减压浓缩后真空干燥,即得胃蛋白酶酶解提取物。
2.1.6 胰蛋白酶酶解法 参考文献中方法[7,11,12],取处方比例的三味虫药细粉,加入人工肠液调节pH 7.5,密闭,37 ℃水浴保温30 min,放冷至室温,加入生药量2 %胰蛋白酶,酶解2 h,3500 r/min离心20 min,取上清,减压浓缩后真空干燥,即得胰蛋白酶酶解提取物。
2.1.7 仿生酶解法 参考文献中方法[7,11-12],取处方比例的三味虫药细粉,加入人工胃液调节pH 2.0,密闭,37 ℃水浴保温30 min,加入生药量2 %胃蛋白酶,酶解2 h,然后加入人工肠液调节pH 7.5,密闭,37 ℃水浴再保温30 min,加入生药量2 %胰蛋白酶,继续酶解2 h,3500 r/min离心20 min,取上清,减压浓缩后真空干燥,即得仿生酶解提取物。
2.2 不同提取方法的比较
2.2.1 总蛋白含量比较 参照2020年版《中国药典》[13]四部附录0731蛋白质含量测定法项下Bradford法测定。
(1)考马斯亮蓝G-250 溶液制备:精密称取考马斯亮蓝G-250 0.1 g,溶于50 ml乙醇中,再加磷酸100 ml,用水稀释至1000 ml,混匀,滤过,即得。
(2)标准蛋白溶液制备:以牛血清白蛋白(BSA)加水溶解,制成每l ml含2 mg的标准蛋白溶液,即得。
(3)供试品溶液制备:精密称取上述不同提取物粉末0.1 g,用水稀释定容至10 ml,摇匀,滤过,即得。
(4)标准曲线绘制和总蛋白含量测定:精密量取上述标准蛋白溶液各0.02,0.04,0.06,0.08,0.10 ml,分别加水稀释至0.1 ml,配置成浓度分别为0.4,0.8,1.0,1.6, 2.0 mg/ml的标准蛋白溶液,再各加入5.0 ml 考马斯亮蓝G-250 溶液,摇匀后倒入比色皿,在紫外-可见分光光度计595 nm 处测定吸光度,以稀释后的标准蛋白溶液浓度(X)和相应吸光度值(Y)进行线性回归,计算得回归方程为:Y=7.5042X+0.0961(R=0.9997),表明,总蛋白浓度在0.4~2.0 mg/ml范围内线性关系良好。
(5)方法学考察:① 精密度试验:取同一标准蛋白溶液,同法连续测定6次吸光度,计算得吸光度的RSD值为0.78 %,表明,本法精密度良好。② 重复性试验:取同一提取物粉末6份,同法制备供试品溶液并测定吸光度,计算得6份提取物样品吸光度的RSD值为1.13 %,表明,本法重复性良好。③ 稳定性试验:取同一份供试品溶液,室温下放置,每15 min测定一次吸光度,共测定6次,计算得吸光度的RSD值为1.49 %,表明,本法稳定性良好。④ 加样回收率实验:取同一已知含量提取物粉末6份,各精密称取约10 mg,精密加入BSA 1.0 mg,同法制备供试品溶液并测定吸光度,以回归方程计算蛋白浓度,得6份提取物样品的平均加样回收率为97.54 %,RSD值为1.35 %。
(6)总蛋白含量测定:精密量取不同提取物供试品溶液各0.1 ml,加入5.0 ml 考马斯亮蓝G-250溶液,同法测定吸光度,以回归方程计算蛋白浓度并换算成百分含量,结果见表1。
2.2.2 抗凝血活性比较 取SD大鼠90只(雌雄各半),按表1所示随机分为 9组,每组10只,提取物各组给予不同提取物灌胃给药[50 mg/(kg·d)-1,溶于10 ml蒸馏水,分早晚2次灌胃],空白对照组给予等量生理盐水灌胃,阳性对照组给予阿司匹林灌胃(10 mg/(kg·d)-1,溶于5 ml蒸馏水,顿服),均连续给药7 d。术前12 h禁食不禁水,于末次给药2 h后,2 %戊巴比妥钠麻醉后,无菌条件下腹主动脉取血,加入3.8 %枸橼酸钠抗凝血(抗凝液与全血比例为1:9),混匀后,3500 r/min离心15 min,分离取血浆。以生理盐水为空白对照,阿司匹林为阳性对照,采用试剂盒法测定活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)和血浆凝血酶时间(TT),检测方法参照试剂盒说明书,结果见表1。
表1 不同提取方法对总蛋白含量和抗凝血活性的影响(±s,n=10)
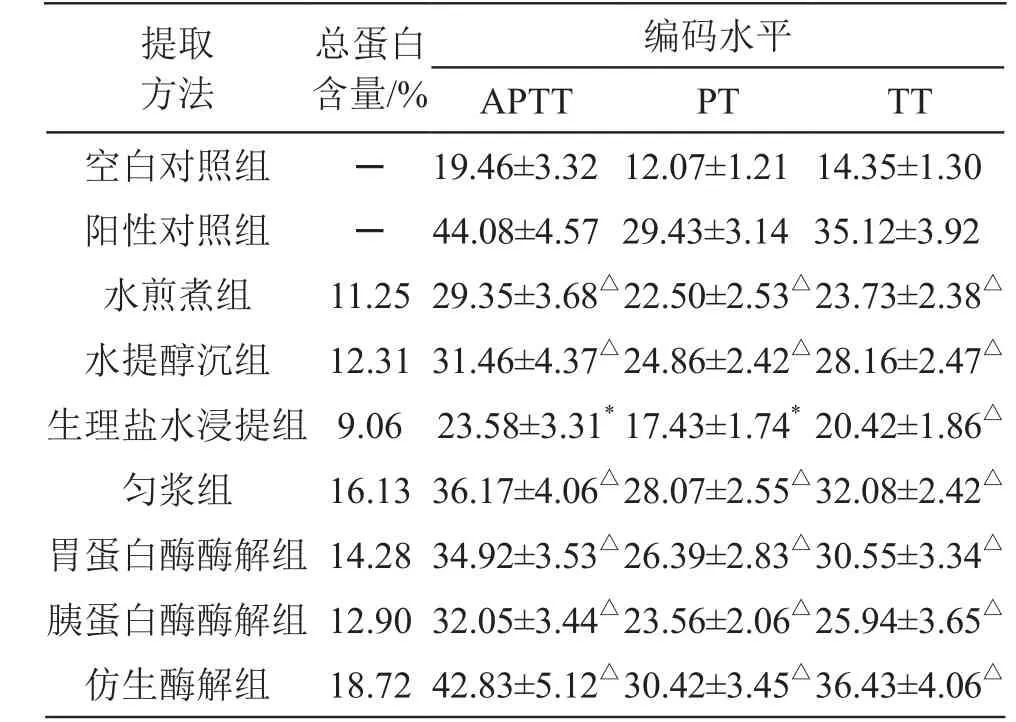
表1 不同提取方法对总蛋白含量和抗凝血活性的影响(±s,n=10)
注:*P<0.05,△P<0.01 vs 空白对照组
编码水平APTT PT TT空白对照组 ─ 19.46±3.32 12.07±1.21 14.35±1.30阳性对照组 ─ 44.08±4.57 29.43±3.14 35.12±3.92水煎煮组 11.25 29.35±3.68△22.50±2.53△23.73±2.38△水提醇沉组 12.31 31.46±4.37△24.86±2.42△28.16±2.47△生理盐水浸提组 9.06 23.58±3.31* 17.43±1.74*20.42±1.86△匀浆组 16.13 36.17±4.06△28.07±2.55△32.08±2.42△胃蛋白酶酶解组 14.28 34.92±3.53△26.39±2.83△30.55±3.34△胰蛋白酶酶解组 12.90 32.05±3.44△23.56±2.06△25.94±3.65△仿生酶解组 18.72 42.83±5.12△30.42±3.45△36.43±4.06△提取方法总蛋白含量/%
由表1可见,仿生酶解提取物中的总蛋白含量最高,其次是匀浆提取物和胃蛋白酶酶解提取物。大鼠体外抗凝血活性实验结果表明,与空白对照组比较,各组的APTT、PT和TT均显著升高(P<0.05或 P<0.01),其中,以仿生酶解提取物的APTT、PT和TT最优,与阿司匹林阳性对照的抗凝血活性相当,其次为匀浆提取物和胃蛋白酶酶解提取物。
2.2.3 溶栓活性比较[14-15]取 SD大鼠90只(雌雄各半),按表2所示随机分为 9组,每组10只,给药方式同“2.2.2”项。术前12 h禁食不禁水,于末次给药 2 h后,各组大鼠给予10 %乌拉坦麻醉,将大鼠仰面固定于手术架上,取腹部正中切口开腹,分离下腔静脉,于左肾静脉下方2 mm处以丝线结扎下腔静脉,确认大鼠呼吸平稳,逐层关闭腹腔。术后6 h再次打开腹腔,于结扎下方1 cm 处夹闭血管,剖开取出血栓,记录血栓湿重,60 ℃烘干,称量干重,并计算血栓抑制率。血栓抑制率% =(空白组血栓干重-各给药组血栓干重)/ 空白组血栓干重×100 %,结果见表2。
表2 不同提取方法对溶栓活性的影响(±s,n=10)
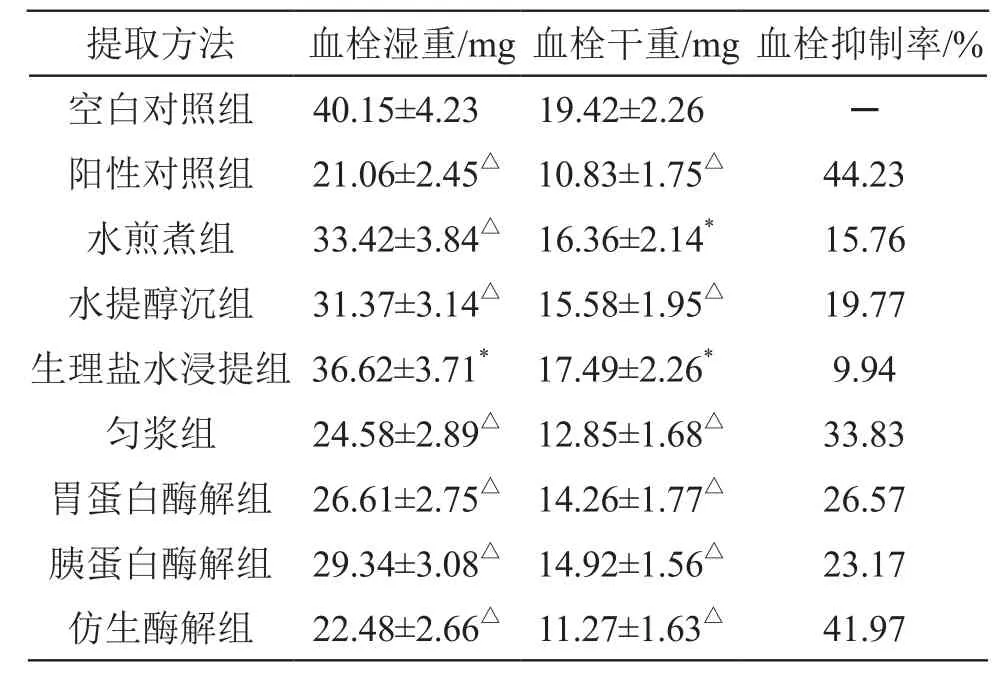
表2 不同提取方法对溶栓活性的影响(±s,n=10)
注:*P<0.05,△P<0.01 vs 空白对照组
提取方法 血栓湿重/mg 血栓干重/mg 血栓抑制率/%空白对照组 40.15±4.23 19.42±2.26 ─阳性对照组 21.06±2.45△ 10.83±1.75△ 44.23水煎煮组 33.42±3.84△ 16.36±2.14* 15.76水提醇沉组 31.37±3.14△ 15.58±1.95△ 19.77生理盐水浸提组 36.62±3.71* 17.49±2.26* 9.94匀浆组 24.58±2.89△ 12.85±1.68△ 33.83胃蛋白酶解组 26.61±2.75△ 14.26±1.77△ 26.57胰蛋白酶解组 29.34±3.08△ 14.92±1.56△ 23.17仿生酶解组 22.48±2.66△ 11.27±1.63△ 41.97
由表2可见,与空白对照组比较,各组的血栓湿重和血栓干重均显著降低(P<0.05 或P<0.01),其中,以仿生酶解提取物的溶栓活性最佳,与阿司匹林阳性对照的溶栓活性相当,其次为匀浆提取物和胃蛋白酶酶解提取物。综合以上结果得出,仿生酶解提取法可作为芪参还五胶囊中三味虫类药材的最佳提取方法。
2.3 仿生酶解法的工艺条件优化
2.3.1 正交实验设计 仿生酶解法参考人体消化道环境,将酶解温度恒定为37 ℃,胃蛋白酶酶解pH值设定为2.0,胰蛋白酶酶解pH值设定为7.5,以保持酶的最佳活性。根据文献和预实验结果[3,16],采用正交实验设计考察影响提取效果的3个因素,即药材粉碎粒度、加酶量和酶解时间,并以总蛋白含量(%)、抗凝血活性(s)和血栓抑制率(%)为评价指标,优化工艺条件。正交实验因素水平见表3。

表3 正交实验因素水平表
取处方比例的三味虫药细粉9份,按照L9(34)正交表设计安排实验,同“2.1.7”项下方法进行仿生酶解提取,测定所得提取物的总蛋白含量、抗凝血活性和血栓抑制率。正交实验结果见表4,方差分析结果见表5。
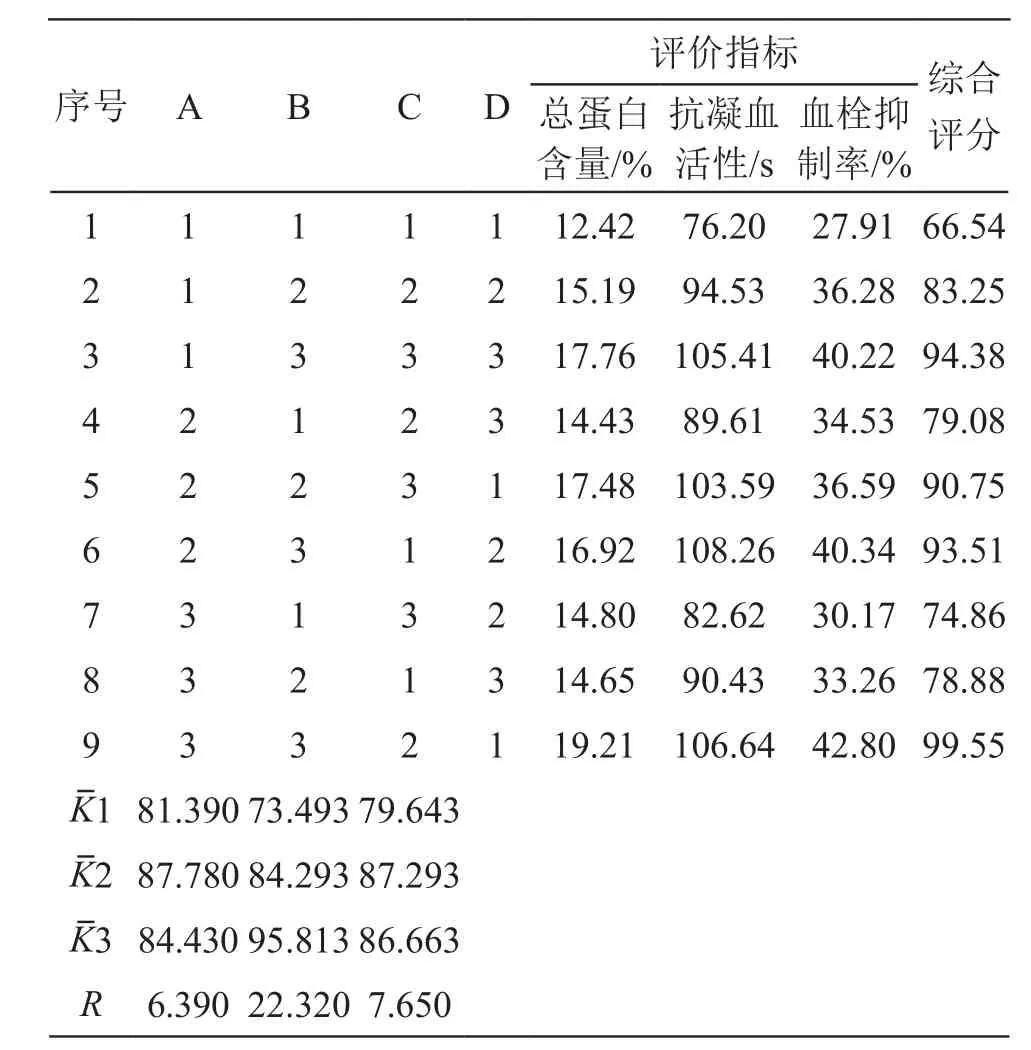
表4 正交实验结果表
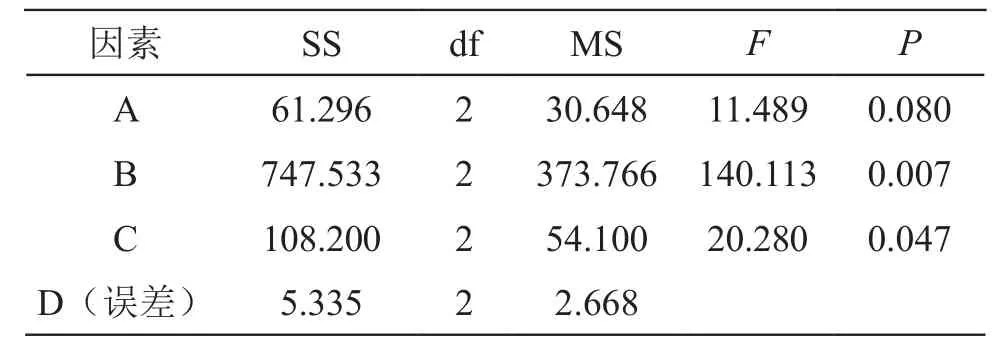
表5 方差分析结果表
由以上结果可见,各因素对仿生酶解法提取效果的影响顺序为:B>C>A,其中,加酶量和酶解时间对提取效果有显著性影响(P<0.05),药材粉碎粒度对提取效果无显著性影响(P>0.05)。正交实验结果提示A2B3C2为最佳提取工艺,综合评分结果以A2B3C2得分最高(99.55分),考虑到A因素对提取效果无显著性影响,为降低生产成本,提高生产效率,综合得出最佳仿生酶解工艺条件为A2B3C2,即药材粉碎粒度为80目,加酶量为2 %生药量,胃蛋白酶和胰蛋白酶各自酶解时间为2 h。
2.3.2 验证实验 按照所得最佳仿生酶解工艺条件进行3次平行工艺验证,结果见表6。可见,3次平行实验的总蛋白含量、抗凝血活性和血栓抑制率结果均较为稳定,RSD值均小于1 %,提示本实验优选的最佳仿生酶解工艺条件稳定可行。
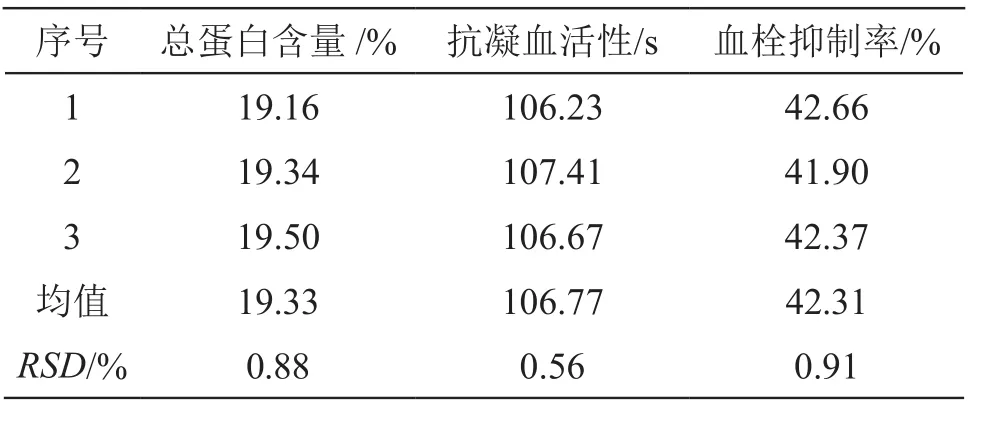
表6 验证实验结果
讨论
中药中虫类药材的传统提取方法通常为原虫提、醇提或原粉直接入药等,因虫类药材自身含较多的大分子蛋白等活性物质,使得传统提取方对虫类药材的利用率较低,活性物质未得到充分用。研究发现,酶解法能将动物药中的蛋白成分解成小分子肽类物质,更利于人体吸收,同时,解后的小分子肽类成分作用位点增多,药物的药更强。如水蛭中的蛋白质经酶解后可得到小分子的水蛭肽成分,有较好的抗凝血作用[17]。地龙中的主要成分蛋白,经酶解成小分子多肽才能被人体吸收并发挥药效[18-19]。全蝎中的大分子蛋白质能经酶解分离纯化出多种具有药理活性的多肽类成分,如镇痛多肽、抗血栓多肽、抗肿瘤多肽等,更易被人体吸收[20-21]。本研究采用仿生酶解法,模拟药物在胃、肠液中的消化过程,对芪参还五胶囊中地龙、全蝎、水蛭三味虫类药材的提取工艺进行优化,将药物中的有效成分水解成易于吸收的小分子物质,在保证药效的同时,进一步提升药品质量,缩小给药剂量。
本研究将仿生酶解法与水煎煮、醇提、匀浆等传统提取工艺进行了比较,通过体外抗凝血实验、溶栓活性指标和总蛋白含量测定,筛选得出仿生酶解法可作为处方中三味虫类药材较理想的提取方法,并通过正交实验考察了药材粉碎粒度、加酶量和酶解时间3个因素不同水平对提取效果的影响,优选出本法的最佳酶解工艺条件,该方法能够最大限度地利用药材中的活性物质,所获得的酶解提取物具有较强的抗凝血、溶栓活性。研究选择了体外抗凝血实验,测定大鼠血浆体外活化部分凝血活酶时间、凝血酶原时间和血浆凝血酶时间[22];同时,测定体内溶栓活性,考察了血栓抑制率[14],两个试验从体外、体内两个维度分别对不同提取产物进行了药效学考察。由结果可见,基本能有效地反映不同提取产物的药效学效果。
4 结论
本研究筛选出的仿生酶解法工艺条件稳定可行,所得酶解提取物抗凝血、溶栓效用较佳,本法可作为芪参还五胶囊中三味虫类药材的提取方法,也为虫类药材的制备工艺优化和药效物质基础研究提供了新的研究思路。
