甘肃产罂粟不同部位中5种生物碱的含量测定
2021-11-04张晓萍张虹艳石晓峰张彩霞李志俊
张晓萍,张虹艳,石晓峰, ,张彩霞,李志俊,王 蕙
(1. 兰州市食品药品检验检测研究院,甘肃 兰州 730050;2. 甘肃省医学科学研究院,甘肃 兰州 730050)
罂粟(Papaver somniferum L.)是一年生栽培草本植物,严禁非法种植,在我国某些特许单位栽培以供药用[1]。其药用部位主要为种子、罂粟壳及罂粟壳中割取的生鸦片和经再加工的生鸦片[2]。其中罂粟壳作为传统中药饮片,既是麻醉药品,又是毒性药品,还具有成瘾性,是国家麻醉药品目录中唯一中药饮片。罂粟所含生物碱种类达100多种,已经分离出的生物碱有20余种,其中吗啡(morphine)、可待因(codeine)、蒂巴因(thebaine)、那可丁(narcotine)和罂粟碱(papaverine)是重要的植物源生物碱,为医药工业上镇痛药、镇咳药和解痉药的重要成分[3-4]。自2008年12 月卫生部《关于开展全国打击违法添加非食用物质和滥用食品添加剂专项整治的紧急通知》将罂粟壳列入首批非食用物质名单,有关食品中吗啡、可待因、罂粟碱、那可丁、蒂巴因5种成分的含量测定方法报道较多[4-10],亦有野罂粟(Papaver nudicule L.)植株不同部位吗啡含量测试的报道[11],但尚未见罂粟不同部位中吗啡、可待因、蒂巴因、罂粟碱、那可丁5种生物碱的的研究报道,为此本试验针对甘肃农垦种植罂粟,采用HPLC法建立了同时测定吗啡、可待因、罂粟碱、那可丁、蒂巴因5种生物碱的含量测定方法,对罂粟不同部位(根、茎、叶、壳)中5种生物碱的含量进行分析,以期为其合理开发利用和科学监管提供参考。
1 仪器与试药
1.1 仪器
LC-20A高效液相色谱仪,配置DAD检测器,LabSolution 工作站(日本Shimadzu公司),MS105DU十万分之一电子天平(Mettler Toledo公司),ME102/24万分之一电子天平(Mettler Toledo公司),IQ7000超纯水机(德国默克公司),CQ-500B 型数控超声波清洗机(上海跃进医用光学器械厂)。
1.2 试药
吗啡对照品(批号:171201-201324,纯度:99.1%)、磷酸可待因对照品(批号:171203-201306,纯度:97.5 %)、蒂巴因对照品(批号:171216-201304)、盐酸罂粟碱对照品(批号:171214-201205,纯度:99.9 %)、那可丁对照品(批号:171224-201304,纯度:99.9 %)均购自中国食品药品检定研究院;甲醇、庚烷磺酸钠、磷酸为色谱纯,水为超纯水。
样品为科研用特殊药品,采集、购买经过甘肃省药品监督管理局批准。罂粟不同部位(根、茎、叶、壳)于2020年6月采集于甘肃农垦集团有限责任公司所辖5个不同农场(用FA~FE表示),原植物经兰州市食品药品检验研究院张彩霞副主任药师鉴定为罂粟科植物罂粟 Papaver somnifer L.。
2 方法与结果
2.1 溶液制备
2.1.1 混合对照品溶液 精密称取吗啡对照品10.21 mg,磷酸可待因对照品10.43 mg,蒂巴因对照品15.35 mg,盐酸罂粟碱对照品11.82 mg,那可丁对照品11.58 mg分别置入10 ml量瓶,加甲醇-5 %醋酸溶液(20:80)溶解并定容,即得5种生物碱各自单一对照品贮备液。分别精密吸取各单一对照品贮备液适量,加5 %醋酸的20 %甲醇溶液配置成每1 ml含吗啡40.47 µg,磷酸可待因20.34 µg,蒂巴因7.675 µg,盐酸罂粟碱11.81 µg,那可丁23.14 µg的混合对照品溶液。
2.1.2 供试品溶液 取罂粟壳粉末(50~60目)约0.5 g,罂粟根、茎、叶粉末(24~50目)约1.0 g,精密称定,分别置于具塞锥形瓶中,加入甲醇-5 %醋酸溶液(20:80)溶液25 ml,超声提取30 min,放冷至室温,过滤,药渣加溶剂25 ml再同法提取1次,过滤,合并滤液,蒸干,用甲醇-5 %醋酸溶液(20:80)溶液复溶并定容于25 ml量瓶,用0.45 µm微孔滤膜过滤,即得。
2.2 色谱条件
色谱柱:Agilent XDB-C18柱(250 mm×4.6 mm,5 µm);流动相:甲醇(A)-庚烷磺酸钠溶液(B)(称取庚烷磺酸钠1.01 g,加水适量使溶解,混匀,用水稀释至1000 ml,用磷酸调节pH值至2.6),梯度洗脱(0~2 min,15 % A;2~35 min,15 %~40 %A;35~80 min,40 % A);流速:1.0 ml/min;检测波长:238 nm(罂粟碱),216 nm(其余4个生物碱);柱温:20 ℃;进样量:10 µl。
2.3 系统适用性试验
精密吸取混合对照品溶液和供试品溶液各10 µl,分别注入高效液相色谱仪,依“2.2”项下色谱条件测定。结果样品中吗啡、可待因、罂粟碱、那可丁、蒂巴因的色谱峰和保留时间与对各对照品相一致,将保留时间一致的色谱峰进行UV光谱比对,峰纯度均大于0.99,分离度均大于1.5,理论板数以吗啡计不小于10 000,方法专属性良好,色谱图见图1。
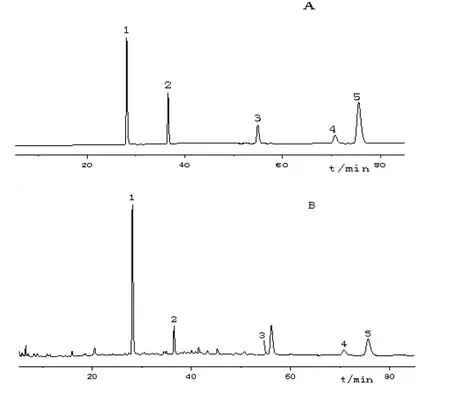
图1 对照品(A)和样品(B)的HPLC图
2.4 方法学验证
2.4.1 线性关系考察 分别精密吸取吗啡对照品贮备液50,100,200,250,500 µl,磷酸可待因对照品贮备液50,100,200,250,500 µl,蒂巴因对照品贮备液5,10,25,50,100 µl,盐酸罂粟碱对照品贮备液10,20,50,100,200 µl,那可丁对照品贮备液10,20,50,100,250 µl置于5 ml量瓶,用甲醇-5 %醋酸溶液(20:80)溶液稀释至刻度,配制成系列浓度的混合对照品溶液,按上述色谱条件分别进样10 µl,测定峰面积。以对照品浓度(X,µg/ml)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,得到吗啡、可待因、罂粟碱、那可丁、蒂巴因的回归方程、相关系数和线性范围见表2。结果表明,5种生物碱在各自浓度范围内与其峰面积积分值呈良好线性关系。

表2 线性关系
2.4.2 精密度试验 精密吸取混合对照品溶液10 µl,按“2.2”项下色谱条件连续进样6次,测得5种生物碱吗啡、可待因、罂粟碱、那可丁、蒂巴因的峰面积和相对保留时间的RSD分别为0.09 %,0.10 %,0.14 %,0.11 %,1.8 %和0.12 %,0.24 %,0.83 %,0.74 %,0.35 %,表明仪器精密度良好。
2.4.3 稳定性试验 精密吸取供试品溶液10 µl,依“2.2”项下色谱条件,分别于0,2,4,8,12,24 h进样测定峰面积,测得5种生物碱吗啡、可待因、蒂巴因、罂粟碱、那可丁的峰面积的RSD分别为0.10 %,0.15 %,1.58 %,0.98 %,0.87 %,表明供试品溶液在24 h内稳定性良好。
2.4.4 重复性试验 精密称取FA农场的罂粟壳粉末(50~60目) 6份,按“2.1.2”项下方法操作制备供试品溶液,依“2.2”项下色谱条件,每次进样10 µl测定含量。测得吗啡、可待因、蒂巴因、罂粟碱、那可丁的平均含量分别为3.5825 ,0.874 75,0.099 465,0. 553 75,0. 5595 mg/g,RSD分别为0.68 %,0.92 %,1.25 %,0.98 %,1.02 %(n=6),表明试验方法重复性良好。
2.4.5 检测限与定量限 取“2.2.1”项下制备好的混合对照品适量,用甲醇-5 %醋酸溶液(20:80)溶液逐级稀释后进样分析,测定吗啡、可待因、蒂巴因、罂粟碱、那可丁的检测限(S/N=3)分别为0.0012,0.0013,0.0014,0.0012,0.0014 μg和定量限(S/N=10)分别为0.0040,0.0043,0.0058,0.0042,0.0052 μg。
2.4.6 回收率试验 取已知含量(吗啡3.582 mg/g,可待因0.8747 mg/g,罂粟碱0.5537 mg/g,那可丁0.5595 mg/g,蒂巴因0.09946 mg/g)的FA农场罂粟壳粉末(50~60目)6份,每份约0.4 g,精密称定,分别置具塞锥形瓶中,再分别精密加入对照品溶液适量,按“2.1.2”项下方法操作制备供试品溶液,依“2.2”项下色谱条件,每次进样10 µl测定含量,计算回收率,结果吗啡、可待因、罂粟碱、那可丁、蒂巴因的平均加样回收率为91.04 %~99.44 %,RSD为1.07 %~1.59 %(n=6),表明该方法准确度良好,结果见表3。
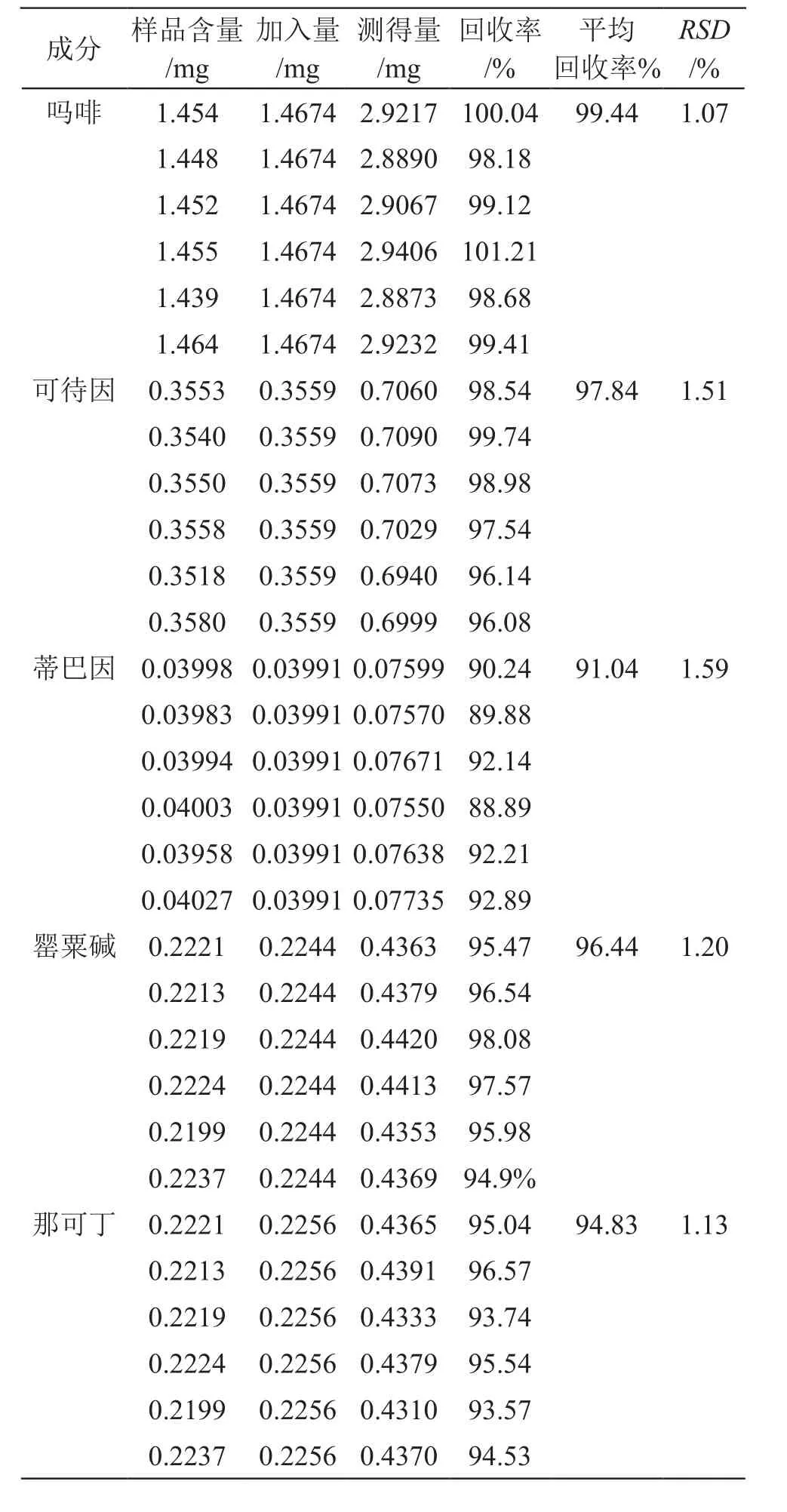
表3 回收率试验结果(n=6)
2.5 样品含量测定
取罂粟壳粉末(50~60目)3份,每份约0.5 g,根、茎、叶粉末(24~50目)各3份,每份约1.0 g,按“2.1.2”项下方法操作制备供试品溶液,按拟定的含量测定方法测定样品中吗啡、可待因、罂粟碱、那可丁、蒂巴因的含量。结果表明,罂粟壳中吗啡、可待因、蒂巴因、罂粟碱、那可丁的含量为2.617~3.582 ,0.4859~0.8747,0.0665~0.0994,0.3221~0.5537,0.4095~0.5806 mg/g;罂粟根、茎、叶中吗啡含量为0.924~1.351,0.314~0.458,0.984~1.421 mg/g,可待因含量为0.5414~0. 8305,0.2147~0.3214,0.4765~0.6247 mg/g,蒂巴因、罂粟碱、那可丁未检出。结果见表4。

表4 罂粟不同部位中5种生物碱的含量测定结果/mg·g-1(n=3)
3 讨论
3.1 检测波长的选择
文献报道的吗啡、可待因、蒂巴因、罂粟碱、那可丁含量测定的检测波长为250 nm[12],216 nm[13]。本文在相同色谱条件下,将对照品溶液、同一供试品溶液用DAD检测器检测,结果吗啡、可待因、蒂巴因、那可丁的最大吸收为216 nm,罂粟碱的最大吸收为238 nm;故选择238 nm作为罂粟碱的检测波长,216 nm作为其余4个生物碱的检测波长。
3.2 色谱条件的选择
曾采用C18柱分别考察了甲醇-0.01 mol/L的磷酸二氢钾[11,14]、甲醇-0.1 %磷酸[15]、甲醇-0.5 %乙酸铵和乙腈-0.5 %乙酸铵[16]的色谱分离效果,也采用HILIC柱考察了含有0.1 %甲酸和10 mmol/L甲酸胺的水溶液-乙腈[17-19],均未取得良好的分离效果。最后采用甲醇-水流动相系统[20-21],添加离子对试剂并用磷酸调节pH改善峰形,发现吗啡、可待因、蒂巴因、罂粟碱、那可丁峰形对称、基线平稳均获得良好分离,相邻色谱峰分离度均大于1.5。通过考察不同柱温(20,25,30 ℃)对5种生物碱色谱分离的影响,发现柱温为30 ℃时蒂巴因未获得有效分离,25 ℃时未达到基线分离,最后设定柱温20 ℃。使用不同型号的C18色谱柱重复实验,结果均能重现。
3.3 供试品溶液制备方法的选择
罂粟生物碱多为异喹啉生物碱,根据其理化性质,参考文献方法[20-22]采用不同比例的甲醇、醋酸、水的混合提取溶剂以及单用甲醇为提取溶剂,分别加入25 ml超声(功率250 W,频率40 kHz)提取30 min,发现以甲醇为提取溶剂罂粟碱的提取率较高,以甲醇-5 %醋酸溶液(20:80)溶液为提取溶剂吗啡、可待因、蒂巴因、那可丁的提取率较高,究其原因可能是罂粟碱溶于有机试剂、不溶于水,部分成盐后溶于水。通过对溶剂的加入量、提取次数的考察,综合考虑选择甲醇-5 %醋酸溶液(20:80)溶液为提取溶剂,溶剂加入量为25 ml,提取次数为2次。
3.4 含量测定结果分析
甘肃产区不同农场罂粟植株不同部位中5种生物碱的含量差异不大,可能是所采集的罂粟种植区域土壤、海拔、气候等条件接近。罂粟壳中5种生物碱的含量高低依次为吗啡、可待因、那可丁、罂粟碱、蒂巴因,蒂巴因平均含量仅为0.0812 mg/g。由样品含量结果可见,除了罂粟壳的药用价值外,罂粟的根、茎、叶可作为镇痛药、镇咳药和解痉药的提取原料,同时也要防范它们的非法添加。
综上,以甘肃境内不同产地罂粟为研究对象,建立HPLC测定吗啡、可待因、蒂巴因、罂粟碱、那可丁5种生物碱的含量测定方法,简便可行、灵敏准确,可为罂粟壳的质量评价提供参考。通过分析植株不同部位(根、茎、叶、壳)中5种生物碱的含量,为其合理开发利用和科学监管提供依据。
