HMGB1对鼻咽癌细胞增殖和转移影响的相关研究
2021-11-03蔡友铮孙丽清卢燕黄玉钿郑友珍翁雅彬
蔡友铮,孙丽清,卢燕,黄玉钿,郑友珍,翁雅彬
福建医科大学附属福州市第一医院耳鼻咽喉科,福建福州 350005
鼻咽癌(nasopharyngeal carcinoma)的发病率位居头颈恶性肿瘤之首,早期临床症状不典型,同时具有高转移、高复发和低分化的特征,因此临床上极难较早发现[1-4]。HMGB1(high mobility group box-1 protein)异常表达与口腔癌、胃癌、乳腺癌、宫颈癌、肺癌、大肠癌、胰腺癌等多种肿瘤的发生发展和转移密切相关[5-7]。但目前对于HMGB1与鼻咽癌的关系还缺乏了解[8-11]。该研究方便选取2019年10月—2020年9月福州市第一医院耳鼻咽喉科诊断治疗的鼻咽炎和鼻咽癌患者临床标本各25例,探索HMGB1高表达与鼻咽癌发生的相关性,并初步验证HMGB1对体外培养的鼻咽癌细胞生长、侵袭和迁移的影响,为能否通过检测HMGB1对鼻咽癌进行诊断、治疗以及预后评估提供新的策略。现报道如下。
1 资料与方法
1.1 一般资料
方便选取在福州市第一医院耳鼻咽喉科诊断治疗的鼻咽炎和鼻咽癌患者共50例,根据病理报告分为两组,鼻咽炎25例,其中男15例,女10例;年龄最小25岁,最大60岁,平均年龄(45±8)岁。鼻咽癌25例,其中男13例,女12例;年龄最小22岁,最大63岁,平均年龄(42±9)岁。所选患者均符合临床诊断标准,已签署知情同意书,且经医院医学伦理委员会批准。两组患者的一般资料经对比,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 试剂 人鼻咽癌细胞株CNE2购自逸漠生物公司。HMGB1shRNA(#1~3)及空载体对照的慢病毒购自载基生物有限公司,HMGB1抗体购自proteintech公司。CCK8增强型溶液、草胺酸结晶紫染色液(0.1%)购自meilune公司。Matrigel胶,Transwell小室及24孔迁移板购自美国corning公司。
1.2.2 免疫组织化学染色 鼻咽癌及鼻咽炎患者样本石蜡包埋后切片(4~5μm),使用兔/鼠IgG-两步法免疫组化试剂盒及DAB显色试剂盒(博士德生物公司)染色,具体步骤参照试剂盒说明书。正置显微镜下观察拍照,统计染色呈阳性细胞百分比。
1.2.3 细胞培养 CNE2细胞用DMEM(高糖)基础培养基加10%胎牛血清及抗生素培养,间隔1~2 d更换培养液,细胞生长至80%左右消化传代。
1.2.4 慢病毒转染 状态良好的细胞接种于6孔板培养7~12 h。对照(含有空载体)和含有HMGB1shRNA病毒在冰上缓慢融化后,根据病毒滴度等量稀释到1 mL加入6孔板,6 h后重复转染1次,12 h后换成普通培养基并加入嘌呤霉素筛选,得到稳转株。稳转株RT-qPCR验证干扰效率。
1.2.5 细胞增殖检测 96孔板按每孔8×104个接种细胞,24 h后每孔加入10μl的CCK-8溶液,培养1.5 h后测其OD450。
1.2.6 细胞划痕实验 细胞接种于6孔板中培养,待细胞长至80%~90%左右,用移液器枪头直线划痕,PBS轻柔清洗两遍以去除漂浮细胞,在不同时间点观察,并分别测量各孔的划痕宽度。
1.2.7 Transwell细胞迁移实验 细胞胰酶消化后,在无血清培养基中将细胞浓度调整为2.5×105/mL,Transwell小室每个加入200μl的细胞悬液,小室下的孔中加入含10%血清的培养基,培养1 d,倒出培养基,用4%多聚甲醛固定已迁移到滤膜外侧的细胞并用结晶紫染色,再擦去滤膜内侧的细胞,显微镜下观察并计数,每孔计数5个视野,取平均值。
1.2.8 Transwell细胞侵袭实验 按1:9的比例稀释Matrigel胶,铺于Transwell底部滤膜上,用来模拟细胞外基质,重复1.2.6实验步骤。
1.2.9 RT-qPCR使用RNAiso Plus试剂盒(TaKaRa)提取细胞总RNA,并用NovoScriptPlus All-in-one 1st Strand cDNA Synthesis试剂盒(Novoprotein)反转录成cDNA,具体步骤参照试剂盒说明书。分别用HMGB1和GAPDH引物对反转录得到的cDNA进行qPCR扩增,以GAPDH为内参计算细胞中HMGB1 mRNA水平。
1.3 观察指标
比较鼻咽炎与鼻咽癌患者组织的HMGB1阳性细胞百分比。比较HMGB1shRNA病毒转染的稳转细胞株中HMGB1的mRNA表达水平,CCK-8活性,及其在细胞划痕实验中的划痕宽度变化,以及在Transwell实验中同等面积下发生迁移或侵袭的细胞个数。
1.4 统计方法
采用GraphPad Prism 5.0统计学软件处理数据,计量资料以((±s)表示,组间差异比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 HMGB1在鼻咽癌中高表达
免疫组织化学染色检测鼻咽癌及鼻咽炎患者样本各25例。结果显示,鼻咽癌患者组织的HMGB1阳性细胞百分比为(17.79±12.71)%,显著高于鼻咽炎患者组织的HMGB1阳性细胞百分比(7.80±5.57)%,差异有统计学意义(t=3.597,P<0.05),表明HMGB1在鼻咽癌中高表达。见图1。

图1 HMGB1在鼻咽癌组织中高表达
2.2 敲低HMGB1后抑制鼻咽癌细胞株CNE2的增殖
对 照 和 含 有HMGB1shRNA#1、HMGB1shRNA#2、HMGB1shRNA#3的病毒转染鼻咽癌细胞株CNE2细胞后经嘌呤霉素筛选,得到稳转细胞株。RT-qPCR结果显示,与对照组相比,HMGB1shRNA#1、HMGB1shRNA#2、HMGB1shRNA#3病毒转染的稳转细胞株中HMGB1的表达水平均有下调(P<0.05),其中HMGB1shRNA#1病毒转染的稳转细胞株中HMGB1的表达水平下降最明显,见图2A。故此后的细胞实验均选择使用HMGB1sh RNA#1病毒转染的稳转细胞株(以下简称HMGB1sh RNA#1细胞)。CCK-8实验检测细胞增殖结果显示,与对照细胞相比,HMGB1shRNA#1细胞的增殖能力显著减弱(P<0.05),见图2B。表明HMGB1能够促进鼻咽癌细胞株CNE2的增殖。

图2 敲低HMGB1后抑制鼻咽癌细胞株CNE2的增殖
2.3 敲低HMGB1后抑制鼻咽癌细胞株CNE2的迁移
划痕实验结果显示,对照细胞和HMGB1shRNA#1细胞在0 h时的划痕宽度差异无统计学意义(P>0.05),而24 h时HMGB1shRNA#1细胞的划痕宽度显著大于对 照 组, 差 异 有 统 计 学 意 义 (P<0.05), 说 明HMGB1shRNA#1细胞迁移能力显著下降。而Transwell细胞迁移实验也显示,与对照细胞相比,发生迁移的HMGB1shRNA#1细胞显著减少(P<0.05),进一步验证了HMGB1shRNA#1细胞迁移能力下降。这些都表明HMGB1能够促进鼻咽癌细胞株CNE2的迁移。见图3、图4。
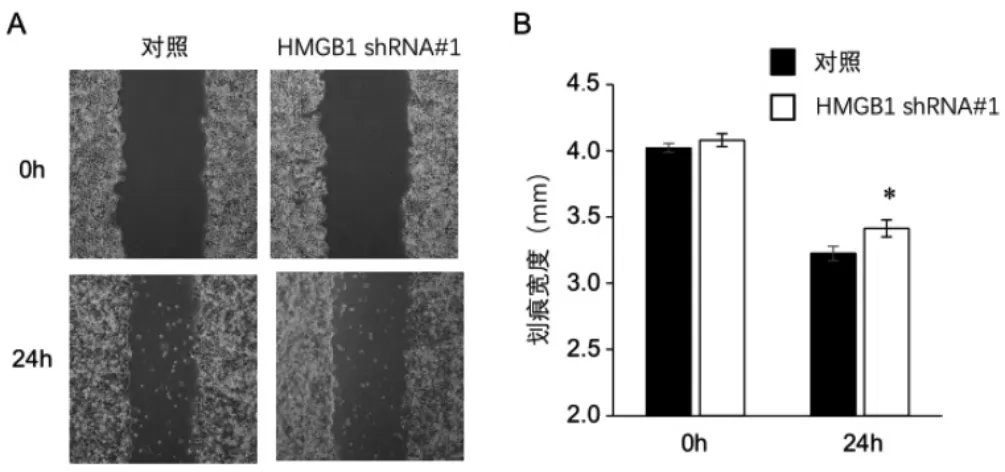
图3 敲低HMGB1后抑制鼻咽癌细胞株CNE2在划痕实验中的迁移能力

图4 敲低HMGB1后抑制鼻咽癌细胞株CNE2在Transwell实验中的迁移能力
2.4 敲低HMGB1后抑制鼻咽癌细胞株CNE2的侵袭
Transwell细胞侵袭实验结果显示,与对照细胞相比,HMGB1shRNA#1细胞发生侵袭的显著减少,差异有统计学意义(P<0.01),说明HMGB1shRNA#1细胞侵袭能力下降。表明HMGB1能够促进鼻咽癌细胞株CNE2的侵袭。见图5。

图5 敲低HMGB1后抑制鼻咽癌细胞株CNE2的侵袭能力
3 讨论
HMGB1隶属于高迁移率族蛋白,主要表达于细胞核内,是一种不属于组蛋白的染色体结合蛋白,与体内如细胞的增殖、分化和迁移等多种生命活动有关[5,10-11]。研究发现,HMGB1与其受体的异常表达与口腔癌、胃癌、乳腺癌、宫颈癌、肺癌、大肠癌、胰腺癌等多种肿瘤的发生发展和转移密切相关,在肿瘤发生发展过程中有着重要作用[5-11]。近期的研究显示,在大肠癌、肝癌、乳腺癌等肿瘤里,HMGB1还能被肿瘤细胞分泌到细胞外,通过自分泌与旁分泌促进自身和其他肿瘤细胞的增殖与转移,提高肿瘤细胞的放疗耐受性[12-15]。相较于其他肿瘤,目前对于HMGB1在鼻咽癌发生发展过程中作用机制的研究还十分有限。
该研究的结果表明,HMGB1在鼻咽癌发生发展过程中也有着重要作用。鼻咽癌患者组织的HMGB1阳性细胞百分比 (17.79±12.71)%显著高于鼻咽炎患者(7.80±5.57)%(t=3.597,P<0.05);而此前的报道显示,HMGB1在口腔鳞癌组织中的高表达率(67.46%)高于口腔黏膜正常组织(0.00%)(χ2=13.242,P<0.001)[16],在直肠癌组织中高表达率(52.2%)显著高于在癌旁组织(21.7%)(χ2=9.144,P=0.002)[17];表明鼻咽癌和口腔鳞癌及直肠癌都存在HMGB1高表达。而对体外培养的人鼻咽癌细胞株CNE2的增殖和转移实验显示,敲低HMGB1的表达水平后,细胞增殖明显减慢(P<0.05),细胞迁移能力下降(P<0.05),细胞侵袭能力下降 (P<0.01);而此前的研究显示,人鼻咽癌细胞株C666-1中干扰HMGB1的表达后,细胞增殖明显减慢(P<0.001),迁移能力明显下降(P<0.001),侵袭能力明显减弱(P<0.001)[18-19];虽然由于两株人鼻咽癌细胞株本身遗传背景不同,HMGB1表达水平不同,实验中HMGB1敲低或干扰的效率也有很大差别,导致两组实验根本不存在任何可比性,但两者都得到了相同的结论,说明HMGB1能促进细胞增殖,增强迁移能力和侵袭能力。这些结果都表明HMGB1可能对鼻咽癌发生发展有重要的促进作用,但对于HMGB1促进鼻咽癌细胞的增殖和转移的具体信号通路还有待今后的进一步研究。
鼻咽癌是一种源自于鼻咽部上皮细胞且具有特殊人种和地域分布的实质性恶性肿瘤,其发病率位居头颈恶性肿瘤之首[1-4]。由于鼻咽癌的解剖位置隐匿、早期临床症状不典型,同时具有高转移、高复发和低分化的特征,因此临床上极难较早发现,早期诊断率不到20%。而鼻咽癌目前临床上治疗主要以放疗及辅助化疗为主[1-4,20-21]。尽管近年来随着治疗手段的不断进步,患者的生存率得到显著提高,但鼻咽癌早期即易发生颈部淋巴结转移并有远处转移的可能,而一旦发生转移则预后很差[22-23]。因此,寻找新的鼻咽癌特异性标志物和预后评估因子,对治疗鼻咽癌有着重要作用。该研究发现HMGB1不仅在鼻咽癌样本中高表达且能直接促进鼻咽癌细胞的增殖和转移,不仅有助于更好地了解鼻咽癌发生发展的分子机制,更可以为鼻咽癌的早期诊断和治疗提供新的方向和目标。
