丹参酮ⅡA对CVB3感染的小鼠原代心肌细胞氧化损伤及凋亡的影响及其机制研究
2021-11-03肖文涛张静郭素萍胡振杰李江高传玉
肖文涛 张静 郭素萍 胡振杰 李江 高传玉
病毒性心肌炎(Viral myocarditis,VMC)是一种继发于病毒感染的心肌炎性疾病,在年轻人中多发,可引发心力衰竭、猝死等致命性伤害[1]。据报道,肠道病毒,特别是柯萨奇病毒B3(CVB3)是导致病毒性心肌炎的最常见病毒[2]。鉴于最常见的心肌炎诱因是病毒感染,开发有效的抗病毒药物对治疗病毒性心肌炎具有重要意义。丹参酮ⅡA(TanshinoneⅡA,TanⅡA)是丹参酮的主要活性成分,具有抗氧化、抗病毒、调节免疫等多种药理学功能[3]。丹参酮ⅡA 已广泛用于心血管疾病的治疗[4-7]。然而丹参酮ⅡA 在病毒性心肌炎中的影响及作用机制的研究相对匮乏,因此本实验以CVB3感染小鼠原代心肌细胞在体外模拟病毒性心肌炎,探究丹参酮ⅡA 对病毒性心肌炎细胞损伤和凋亡的影响及可能的机制,以期为病毒性心肌炎临床治疗提供一定的实验依据。
1 材料与方法
1.1 实验动物及主要试剂
6 周龄SPF 级BALB/C 雄性小鼠(中国科学院实验动物中心);丹参酮ⅡA(南京景竹医药科技有限公司);DMEM 培养基(美国Thermo Fisher Scientific 公司);胎牛血清(美国Life Technologies 公司);CVB3 病毒(美国菌种保藏中心);CCK-8 试剂(日本同仁化学研究所);BCA 蛋白浓度检测试剂盒(美国Sigma 公司);SOD 活力检测试剂盒、MDA含量检测试剂盒、GSH-Px 活力测定试剂盒(南京建成生物工程研究所);IL-1β、IL-6 和TNF-α ELISA 检测试剂盒(赛默飞世尔科技有限公司);AnnexinⅤ-FITC/PI 细胞凋亡检测试剂盒(日本TaKaRa 公司);ECL 化学发光试剂(上海碧云天生物技术研究所);PVDF 膜(美国密理博公司);Cleaved Caspase-3 单抗、TLR4 单抗、NF-κB 单抗、p-NF-κB 单抗及二抗(美国Santa Cruz 公司)。
1.2 心肌细胞分离及处理分组
参照文献[8]分离小鼠心肌细胞,即取小鼠心脏组织,剪碎,以胰酶消化,差速贴壁法获取小鼠原代心肌细胞。实验已通过本院实验动物伦理委员会审查。分离的心肌细胞培养在含10%胎牛血清的DMEM 培养基中,放置在37℃、5% CO2、饱和湿度培养箱进行培养。在6 孔板中接种1.0×105个/孔细胞,待单层贴壁生长,向细胞中加入10 倍MOI的CVB3(根据预实验结果),轻轻混匀,37℃孵育1 h,记为模型(CVB3)组,丹参酮ⅡA 治疗(CVB3+TanⅡA)组以CVB3 感染后使用浓度为10 μmol/L的丹参酮ⅡA 处理,正常对照组接种同剂量的PBS,丹参酮ⅡA(TanⅡA)组使用浓度为10 μmol/L的丹参酮ⅡA 处理,利巴韦林治疗(CVB3+Rib)组以CVB3 感染后使用浓度为200 μg/mL 的丹参酮ⅡA 处理。
1.3 CCK-8 法检测心肌细胞活性
心肌细胞以3×103个/孔加入到96 孔板中,按照1.2 方法处理和分组,每组设置3 个复孔,分别在24 和48 h 向各孔细胞内加入CCK-8 溶液10 μL,孵育2 h,酶标仪测定450 nm 处的光密度值(OD 值),参比波长为600 nm,分别计算各组心肌细胞活性,细胞活性(%)=实验组OD 值/对照组OD 值×100%。
1.4 试剂盒测定SOD 和GSH-Px 活性和MDA含量
各组心肌细胞处理48 h后,收集细胞及上清培养液,分别参照SOD、MDA 和GSH-Px 检测试剂盒说明书对SOD 和GSH-Px活性及MDA 含量进行检测。
1.5 ELISA检测炎性因子IL-1β、IL-6和TNF-α水平
各组心肌细胞处理48 h 后,收集上清培养液,使用ELISA 检测试剂盒对IL-1β、IL-6 和TNF-α 水平进行检测,具体操作步骤参考制造商说明书。
1.6 流式细胞术检测心肌细胞凋亡率
心肌细胞分组处理48 h 后,收集3×105个细胞,采用AnnexinⅤ-FITC/PI 试剂盒说明书处理,使用流式细胞仪检测细胞凋亡情况。
1.7 Western blot 检测心肌细胞中Cleaved Caspase-3、TLR4、NF-κB 和p-NF-κB 蛋白表达水平
抽提处理48 h 各组心肌细胞总蛋白,BCA 法测定上清中蛋白浓度。蛋白加热变性。等量蛋白行10% SDS-PAGE 凝胶电泳,随后电转至PVDF膜,于5%脱脂奶粉中封闭2 h,参照一抗说明书按1∶1 000 稀释Cleaved Caspase-3、TLR4、NF-κB 和p-NF-κB,加入相应一抗,4℃过夜孵育,再加入1∶3 000 稀释的二抗,室温封闭2 h,以ECL 进行显影,使用成像系统采集图像,以GAPDH 为内参,分别计算目的蛋白相对表达水平。
1.8 统计学分析
采用SPSS 21.0 统计学软件对数据进行分析,计量资料以()表示,均符合正态分布,两组间用t检验,多组间比较采用单因素方差分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1 丹参酮ⅡA 对CVB3 诱导的心肌细胞活性的影响
与对照组相比,CVB3 组心肌细胞活性显著降低(P<0.05);与CVB3 组相比,CVB3+TanⅡA 组心肌细胞活性明显增强(P<0.05)。见表1。
表1 各组心肌细胞活性比较(±s)Table 1 Comparison of cardiomyocyte activity in each group(±s)

表1 各组心肌细胞活性比较(±s)Table 1 Comparison of cardiomyocyte activity in each group(±s)
注:与Control 组比,*P<0.05;与CVB3 组比,&P<0.05。
组别对照组TanⅡA CVB3 CVB3+TanⅡA CVB3+Rib F 值P 值细胞活性(%)0 h 100.00±5.12 99.02±5.04 98.46±4.89 98.22±5.02 99.11±5.17 0.056 0.993 24 h 99.64±5.11 96.48±5.26 76.28±4.61a 88.32±4.06b 90.14±4.37b 11.047 0.001 48 h 97.85±5.14 96.33±5.39 52.16±3.65a 80.92±4.33b 84.57±4.27b 48.006 0.000
2.2 丹参酮ⅡA 对CVB3 诱导的心肌细胞氧化应激的影响
与对照组相比,CVB3 组SOD 和GSH-Px 活性明显降低(P<0.05),MDA 含量明显增多(P<0.05);与CVB3 组相比,CVB3+TanⅡA 组SOD 和GSHPx 活性上升(P<0.05),MDA 含量下降(P<0.05)。见表2。
表2 各组心肌细胞SOD 和GSH-Px 活性及MDA 含量比较(±s)Table 2 Comparison of SOD and GSH-Px activities andMDA content of cardiomyocytes in each group(±s)
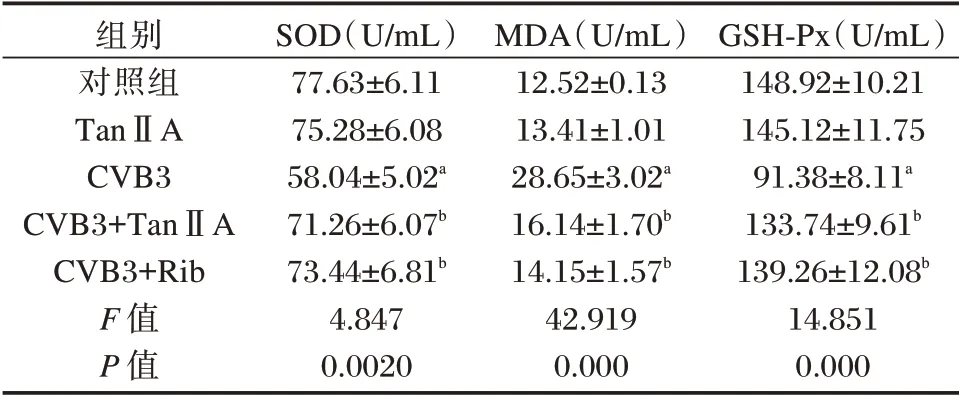
表2 各组心肌细胞SOD 和GSH-Px 活性及MDA 含量比较(±s)Table 2 Comparison of SOD and GSH-Px activities andMDA content of cardiomyocytes in each group(±s)
注:与对照组组比,aP<0.05;与CVB3 组比,bP<0.05。
组别对照组TanⅡA CVB3 CVB3+TanⅡA CVB3+Rib F 值P 值SOD(U/mL)77.63±6.11 75.28±6.08 58.04±5.02a 71.26±6.07b 73.44±6.81b 4.847 0.0020 MDA(U/mL)12.52±0.13 13.41±1.01 28.65±3.02a 16.14±1.70b 14.15±1.57b 42.919 0.000 GSH-Px(U/mL)148.92±10.21 145.12±11.75 91.38±8.11a 133.74±9.61b 139.26±12.08b 14.851 0.000
2.3 丹参酮ⅡA 对CVB3 诱导的心肌细胞炎症反应的影响
与对照组相比,CVB3 组IL-1β、IL-6 和TNF-α水平升高(P<0.05);与CVB3 组相比,CVB3+TanⅡA 组IL-1β、IL-6 和TNF-α 水平明显下降(P<0.05)。见表3。
表3 各组心肌细胞IL-1β、IL-6 和TNF-α 水平比较(±s)Table 3 Comparison of levels of IL-1β,IL-6 and TNF-α in cardiomyocytes of each group(±s)
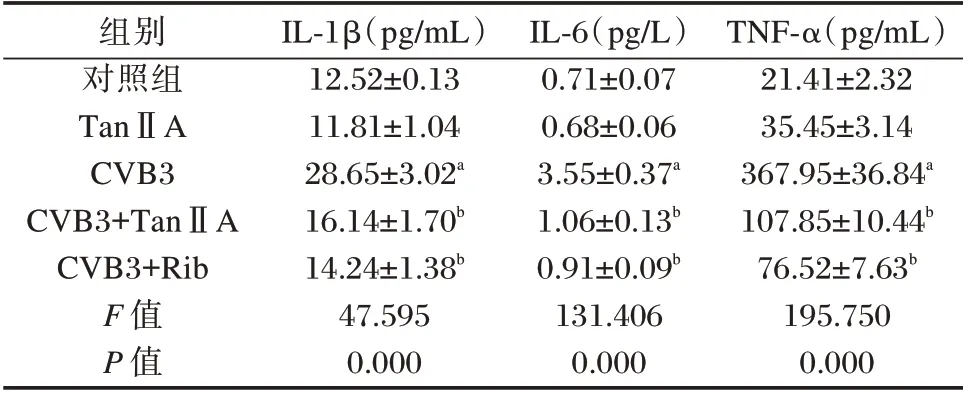
表3 各组心肌细胞IL-1β、IL-6 和TNF-α 水平比较(±s)Table 3 Comparison of levels of IL-1β,IL-6 and TNF-α in cardiomyocytes of each group(±s)
注:与对照组组比,aP<0.05;与CVB3 组比,bP<0.05。
TNF-α(pg/mL)21.41±2.32 35.45±3.14 367.95±36.84a 107.85±10.44b 76.52±7.63b 195.750 0.000组别对照组TanⅡA CVB3 CVB3+TanⅡA CVB3+Rib F 值P 值IL-1β(pg/mL)12.52±0.13 11.81±1.04 28.65±3.02a 16.14±1.70b 14.24±1.38b 47.595 0.000 IL-6(pg/L)0.71±0.07 0.68±0.06 3.55±0.37a 1.06±0.13b 0.91±0.09b 131.406 0.000
2.4 丹参酮ⅡA对CVB3诱导的心肌细胞凋亡的影响
与对照组相比,CVB3 组心肌细胞凋亡率和Cleaved Caspase-3 的表达升高(P<0.05);与CVB3组相比,CVB3+TanⅡA 组细胞凋亡率和Cleaved Caspase-3的表达明显降低(P<0.05)。见图1和表4。
表4 各组心肌细胞凋亡率比较(±s)Table 4 Comparison of apoptosis rate of cardiomyocytes in each group(±s)

表4 各组心肌细胞凋亡率比较(±s)Table 4 Comparison of apoptosis rate of cardiomyocytes in each group(±s)
注:与对照组组比,aP<0.05。
组别对照组TanⅡA CVB3凋亡率(%)2.52±0.59 2.88±0.62 25.79±3.24a Cleaved Caspase-3 0.11±0.01 0.12±0.01 0.52±0.05a
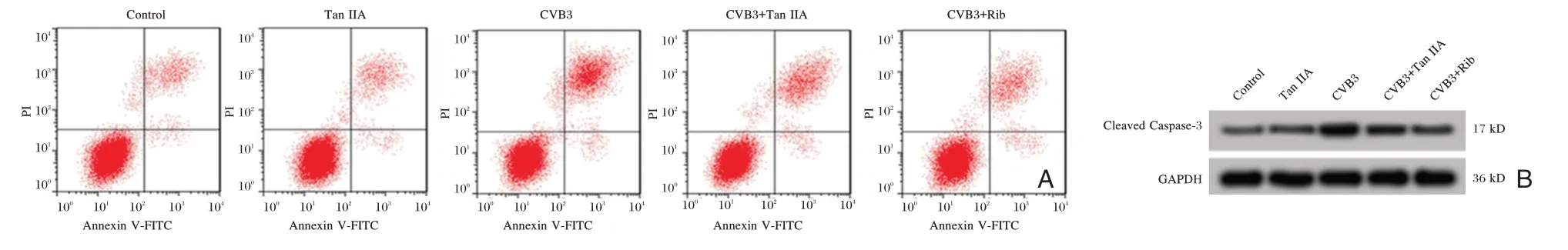
图1 丹参酮ⅡA 对CVB3 诱导的心肌细胞凋亡和Cleaved Caspase-3 表达的影响Figure 1 The effect of Tanshinone ⅡA on CVB3-induced cardiomyocyte apoptosis and Cleaved Caspase-3 expression
2.5 丹参酮ⅡA 对CVB3 诱导的心肌细胞中TLR4/NF-κB 信号通路激活的影响
与对照组相比,CVB3 组心肌细胞中TLR4 和p-NF-κB 的表达上调(P<0.05);与CVB3 组相比,CVB3+TanⅡA 组细胞中TLR4 和p-NF-κB 的表达明显下调(P<0.05)。见图2和表5。
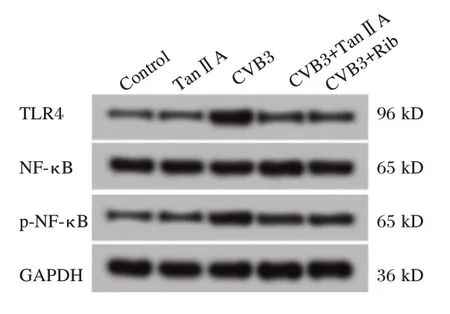
图2 Western blot 检测各组心肌细胞中TLR4、NF-κB 和p-NF-κB 蛋白表达Figure 2 Western blot detection of TLR4,NF-κB and p-NF-κB protein expression in cardiomyocytes of each group
表5 各组心肌细胞中TLR4、NF-κB 和p-NF-κB 蛋白表达水平比较(±s)Table 5 Comparison of TLR4,NF-κB and p-NF-κB protein expression levels in cardiomyocytes of each group(±s)
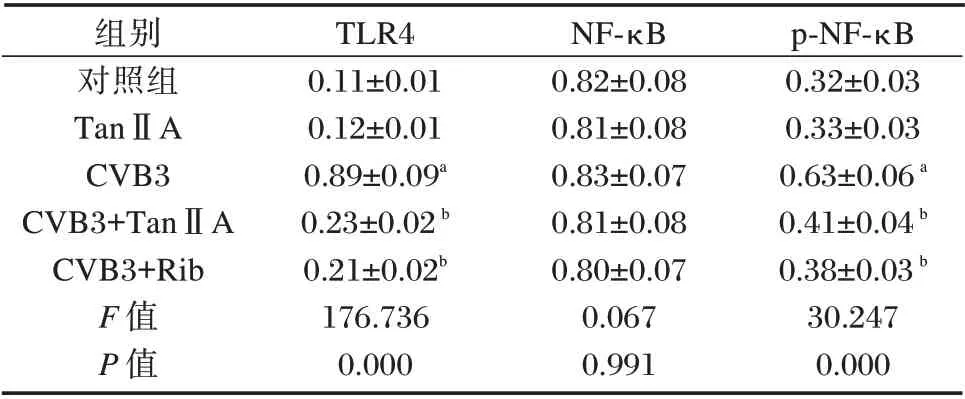
表5 各组心肌细胞中TLR4、NF-κB 和p-NF-κB 蛋白表达水平比较(±s)Table 5 Comparison of TLR4,NF-κB and p-NF-κB protein expression levels in cardiomyocytes of each group(±s)
注:与对照组比,aP<0.05;与CVB3 组比,bP<0.05。
p-NF-κB 0.32±0.03 0.33±0.03 0.63±0.06a 0.41±0.04b 0.38±0.03b 30.247 0.000组别对照组TanⅡA CVB3 CVB3+TanⅡA CVB3+Rib F 值P 值TLR4 0.11±0.01 0.12±0.01 0.89±0.09a 0.23±0.02b 0.21±0.02b 176.736 0.000 NF-κB 0.82±0.08 0.81±0.08 0.83±0.07 0.81±0.08 0.80±0.07 0.067 0.991
3 讨论
心肌炎定义为心肌损伤后心肌的炎症,也是引发小儿心力衰竭患者的主要原因之一[9]。肠道病毒感染被认为是该疾病的一个主要原因,尤其是年轻患者中CVB3 的感染。CVB3 是一种重要的人类病原体,可诱导儿童和年轻人的急性和慢性病毒性心肌炎[10]。大约50%的心肌炎及其末期扩张型心肌病可归因于CVB3 感染[11]。目前关于病毒性心肌炎的发病机制尚不完全清楚,且缺乏病毒性心肌炎治疗的特效药。因此探究病毒性心肌炎的发病机制及开发有效的药物对病毒性心肌炎的临床治疗显得尤为重要。
丹参酮ⅡA 来源于唇形科植物丹参的根及根茎,主要用于治疗冠心病、心律过速、心绞痛等心血管疾病[12]。近期研究显示,丹参酮ⅡA 磺酸钠注射液广泛治疗病毒性心肌炎的小鼠模型及临床应用[13]。本实验结果提示丹参酮ⅡA 对CVB3 诱导的心肌细胞具有一定的保护作用。以往研究发现丹参酮ⅡA 可能通过调控氧化应激反应和炎症反应发挥其对器官损伤的保护作用[14]。本实验中丹参酮ⅡA 能够提高CVB3 诱导的心肌细胞抗氧化酶SOD 和GSH-Px 活性,降低MDA 的含量,减轻心肌细胞的氧化应激损伤。此外,丹参酮ⅡA 可降低CVB3 诱导的心肌细胞分泌的炎性因子IL-1β、IL-6 和TNF-α 水平,降低炎症反应,本实验结果与以上研究相符。一项研究显示,丹参酮ⅡA 可通过降低TLR4-MyD88-NF-κB 信号通路,对脂多糖诱导的RAW264.7 细胞发挥抗炎作用[15]。另一项研究发现,丹参酮IIA 通过TLR-4 介导的NF-κB信号通路降低炎性细胞因子和氧化应激水平的产生,改善缺氧缺血性脑病[16]。本实验结果发现,丹参酮IIA 可下调CVB3 诱导的心肌细胞中TLR4 和NF-κB 蛋白表达。表明丹参酮IIA 能够抑制TLR4/NF-κB 信号通路的激活。
总之,丹参酮ⅡA 能够改善CVB3 诱导心肌细胞氧化应激损伤及炎症反应,减少细胞凋亡,其潜在的机制可能与抑制TLR4/NF-κB 信号通路的活化有关。后续实验将对丹参酮ⅡA 在病毒性心肌炎小鼠心脏的影响进一步探究,以期为病毒性心肌炎的临床治疗提供实验基础。
