马泰勒虫顶膜抗原1基因的原核表达与鉴定
2021-11-02范士龙刘丹丹韦丽婷李思媛王金明呼尔查李永畅巴音查汗新疆农业大学动物医学学院新疆乌鲁木齐830052
范士龙,刘丹丹,韦丽婷,芦 星,李思媛,王金明,呼尔查,李永畅,巴音查汗,张 伟 (新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052)
马泰勒虫(Theileriaequi)是一种由硬蜱传播,寄生于马属动物的红细胞及网状内皮系统细胞内的顶复门血液原虫,与马驽巴贝斯虫(Babesiasiscaballi)同属于马梨形虫范畴[1-2]。马泰勒虫病的临床症状主要为稽留热、贫血、黄疸等[3],其主要临床特点为急性溶血性贫血[4]。孕马感染此病易引起早产或流产,严重时会导致死亡[3],对畜牧业的生产和发展造成严重影响。目前世界动物卫生组织(OIE)已将该病列入动物疫病名录,属法定报告疫病,在我国该病被列为二类动物疫病[5]。目前对于该病尚无十分有效的药物和疫苗,因此如何有效预防和控制马泰勒虫病、减少其危害是相关领域研究的热点。
顶复门原虫的顶膜抗原1(apical membrane antigen 1,AMA1)是一种由微线体分泌的高度保守蛋白的Ⅰ型跨膜蛋白,包括N端氨基端富半胱氨酸胞外区、单一跨膜结构域以及C端羧基末端细胞质尾巴三部分[6]。对于顶复门原虫AMA1蛋白的研究,戚南山等[7]主要关注该蛋白与RONs(棒状体颈部蛋白)家族蛋白相互结合形成复合连接体后,参与到虫体入侵宿主细胞的过程;以及KOCKEN等[8]将该蛋白作为候选抗原制备疫苗预防顶复门原虫的感染。目前AMA1蛋白在弓形虫(Toxoplasma)、疟原虫(Plasmodium)、巴贝斯虫(Babesia)、球虫(Eimeria)等顶复门原虫中均有发现,并且在柔嫩艾美耳球虫(Eimeriatenella)、刚地弓形虫(Txoplasmagondii)和间日疟原虫(Plasmodiumvivax)中均被证实参与到虫体对宿主的入侵过程中[7]。在梨形虫中,目前仅有研究证明田鼠巴贝斯虫(Babesiamicroti)和分歧巴贝斯虫(Babesiadivergens)的AMA1蛋白参与了宿主入侵过程[9-10]。然而,AMA1蛋白在泰勒虫中是否存在并参与宿主细胞入侵尚未见报道。
为了探究AMA1蛋白在马泰勒虫中是否参与了宿主细胞入侵过程,本研究首先以扩增马泰勒虫AMA1基因并获得稳定表达蛋白为目标。以马泰勒虫新疆株为研究对象,在扩增出马泰勒虫新疆株AMA1基因序列后,对AMA1重组蛋白进行表达和鉴定。研究结果为进一步探究马泰勒虫AMA1蛋白与RONs蛋白的互作关系,进而解析马泰勒虫入侵宿主机制奠定了基础。
1 材料与方法
1.1 样品与试剂马泰勒虫阳性抗凝马全血采自新疆塔城地区。pMD19-T载体、pGEX-4T-1载体、T4DNA连接酶,E.coliDH5α、E.coliBL21、Xho Ⅰ、EcoR Ⅰ、Taq DNA聚合酶、dNTP、Agarose Gel DNA Extraction Kit、DNA Marker、蛋白质Marker等均购自宝生物工程(大连)有限公司;DNA片段纯化回收试剂、质粒小量提取试剂盒购自OMEGA生物试剂公司;血液/组织 DNA 提取试剂盒、Prime STAR Max Premix(2×)、ELC显色试剂盒购自康为世纪生物科技有限公司;辣根过氧化物酶(HRP)标记的兔抗马IgG购自北京博奥森生物技术有限公司。
1.2 引物设计与合成用GenBank公布的Theileriaequistrain WA(XM_004833042.1) AMA1基因序列为模板BLAST NC_025260.1Theileriaorientalis;NW_001091929.1Theileriaannulata;NC_007344.1Theileriaparva基因组数据,以获得的泰勒虫属AMA1保守基因序列为模板,用 Primer Premier 5.0 软件设计特异性引物(表1),送生工生物工程(上海)股份有限公司合成。
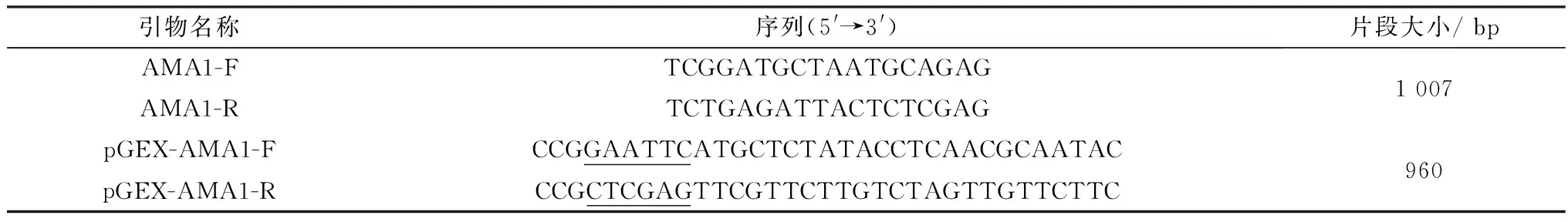
表1 AMA1基因引物信息
1.3 AMA1基因扩增与克隆按照DNA提取试剂盒说明书,提取马泰勒虫基因组DNA。以基因组DNA为模板进行PCR扩增,PCR扩增产物经纯化后与克隆载体pMD19-T连接,转化到E.coliDH5α感受态细胞,37℃过夜培养,将PCR鉴定为阳性的转化子送至生工生物工程(上海)股份有限公司进行测序。
1.4 AMA1基因序列遗传进化分析利用MEGA 7.0软件分析马泰勒虫新疆株与其他顶复门原虫AMA1基因的核苷酸序列,构建Maximum parsimany(MP)系统发生树,分析以AMA1基因为标记的顶复门原虫分类进化关系。
1.5 pGEX-4T-AMA1重组质粒构建分别提取阳性克隆和表达载体pGEX-4T-1质粒DNA,分别用EcoR Ⅰ和Xho Ⅰ进行双酶切,酶切后产物进行连接,产物转化到E.coliBL21感受态细胞内,提取质粒DNA,进行PCR和酶切鉴定。将鉴定为阳性的菌液送至生工生物工程(上海)股份有限公司测序。
1.6 重组蛋白的诱导表达及可溶性分析将测序正确的重组菌液100 μL接种到20 mL 含有氨苄抗性LB培养基内,37℃培养,待菌液培养至D值达到0.6时,加入终浓度为1 mmol/L的IPTG进行诱导表达,分别于0,1,2,3,4,5,6 h取1 mL菌液留样;加入终浓度分别为0.0,0.2,0.4,0.6,0.8,1.0 mmol/L的诱导剂,诱导一定时间取样。12 000 r/min离心1 min收集菌体,制样进行SDS-PAGE分析。
根据优化的最佳表达时间和诱导剂浓度进行扩大培养。诱导表达菌液离心弃上清液后,用PBS重悬,8 000 r/min离心5 min,清洗3遍,冰浴超声破碎菌体(工作5 s,间歇6 s),破碎10 min。破碎后的菌液经8 000 r/min离心30 min,分别收集上清液和沉淀制样,经SDS-PAGE分析,判断表达产物存在形式。
1.7 重组蛋白Western blot鉴定向蛋白胶孔内每孔加入8 μL重组蛋白样品进行SDS-PAGE电泳后,湿转于PVDF上,用封闭液(5%脱脂乳,含0.5% Tween的PBS稀释)4℃过夜封闭,使用马泰勒虫阳性血清作为一抗(1∶100),以HRP标记的兔抗马IgG用5%脱脂乳1∶5 000稀释作为二抗,使用ELC超敏显色液避光孵育1 min,进行Western blot 分析。
2 结果
2.1 马泰勒虫AMA1基因的克隆与鉴定以马泰勒虫pMD19-T-AMA1菌液为模板,经PCR扩增后获得大小约为1 007 bp目的片段(图1),将阳性菌液进行测序,序列比对结果显示,与GenBank收录的马泰勒虫美国WA株AMA1基因(XM_004833042.1)核苷酸和氨基酸同源性分别为76.34%和78.64%,序列已上传至GenBank(NCBI登录号:MW346657)。

M.DL15000 DNA Marker;1,2.AMA1菌液PCR产物图1 pMD-19T-AMA1菌液鉴定结果
2.2 AMA1基因的系统发生树构建利用MEGA 7.0软件,以顶复门原虫AMA1基因为分子标记,以核苷酸序列构建MP系统发生树(图2)。结果显示,以AMA1基因为标记的进化树聚类关系符合物种分类,其中马泰勒虫新疆株被聚类到泰勒虫属,与马泰勒虫美国WA株位于同一支,两者进化关系最为接近,表明AMA1基因可以作为顶复门原虫种属鉴定的一个依据。

图2 以AMA1基因为分子标记构建的11种顶复门原虫系统发生树
2.3 pGEX-4T-AMA1重组质粒构建将测序正确的重组pGEX-4T-AMA1质粒进行双酶切鉴定。用EcoR Ⅰ和Xho Ⅰ对重组质粒进行酶切后,获得约为4 900,927 bp的2条目的片段(图3),表明目的基因片段成功插入到原核表达载体中。
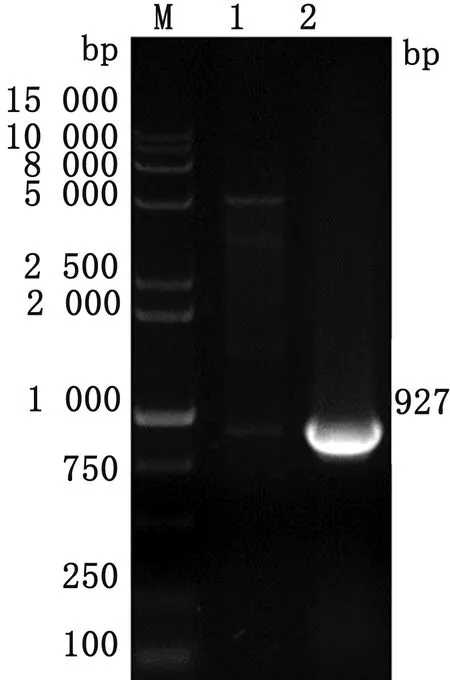
M.DL15000 DNA Marker;1.质粒双酶切产物;2.阳性对照图3 pGEX-4T-AMA1质粒双酶切鉴定结果
2.4 重组蛋白的诱导表达SDS-PAGE 分析结果显示,以终浓度为0.8 mmol/L IPTG 37℃诱导 3 h时,蛋白表达量最高(图4A、B)。诱导后的表达产物大小约为60 kDa,与其理论值基本一致。经过超声破碎、离心分别收集上清和沉淀,进行SDS-PAGE检测,结果显示重组蛋白在沉淀中表达量较高,为包涵体蛋白且条带较为单一(图4C)。

M.蛋白 Marker;A.重组蛋白诱导时间优化(1.未诱导;2~7.分别诱导1,2,3,4,5,6 h,诱导剂IPTG终浓度1 mmol/L);B.重组蛋白IPTG浓度优化(1.未诱导;2~6. 诱导剂IPTG终浓度分别为0.2,0.4,0.6,0.8,1.0 mmol/L);C.重组蛋白可溶性分析(1.诱导3 h上清;2.诱导3 h包涵体37℃ IPTG终浓度为0.8 mmol/L)图4 重组蛋白诱导条件优化和可溶性分析
2.5 Western blot分析取包涵体沉淀制样,经SDS-PAGE 电泳后湿转至PVDF膜上。结果显示,马泰勒虫阳性血清与重组蛋白产生特异性反应,在60 kDa处有特异性条带出现(图5),表明该重组蛋白具有特异性和反应原性。

M.蛋白 Marker;1.阳性图5 重组蛋白Western blot分析结果
3 讨论
随着对顶复门原虫AMA1蛋白研究的不断深入,有研究表明,在虫体侵入宿主细胞的过程中,AMA1所表现出特有的阶段性表达和分泌现象,说明AMA1蛋白在入侵过程中存在着特异性表达[11-12]。MITAL等[13]尝试敲除 AMA1,发现弓形虫入侵减少。同时,恶性疟原虫AMA1在子孢子表达并参与入侵肝细胞后消失[14]。由此推断,AMA1可能在顶复门原虫入侵宿主细胞的过程中起到重要的作用[15],截至目前,关于马泰勒虫AMA1蛋白及其功能的研究尚未见报道。
为了便于进一步研究马泰勒虫AMA1蛋白的相关功能,本研究首先获得马泰勒虫新疆株AMA1基因(GenBank登录号:MW346657),以AMA1基因为分子标记构建进化树,结果表明,马泰勒虫新疆分离株在进化分支属于泰勒虫属,与GenBank收录的马泰勒虫美国WA株AMA1基因(XM_004833042.1)BLAST结果显示,核苷酸和氨基酸同源性分别为76.34%和78.64%,进化关系最为接近。AMA1蛋白作为顶复门原虫中高度保守的表面蛋白,存在于多种顶复门原虫中,马泰勒虫也与其他顶复门原虫一样具有该基因,但马泰勒虫中的AMA1蛋白是否与其他入侵相关蛋白之间产生相互作用,参与到虫体对宿主细胞的入侵过程中,还有待进一步研究。原核表达所获得的融合蛋白AMA1相对分子质量为60 kDa,以包涵体蛋白形式存在;Western blot分析结果表明,该重组蛋白能够被马泰勒虫天然阳性血清识别,表明重组马泰勒虫AMA1蛋白具有较高的抗原性,同时也说明马匹感染马泰勒虫后能产生对该蛋白较强的抗体。
AMA1在虫体入侵宿主细胞的关键作用可为疫苗研发提供新思路。在顶复门原虫中,将AMA1蛋白作为候选抗原来制备疫苗在弓形虫、疟原虫和艾美尔球虫的研究较深入。弓形虫AMA1病毒样颗粒诱导的免疫应答对弓形虫感染具有部分保护作用,为潜在的弓形虫疫苗提供了新的设计策略[16];同时,AMA1重组抗原还可作为交叉抗原,对弓形虫和新孢子虫具有免疫作用[17]。在疟原虫中,AMA1作为疟原虫红细胞内期最早的候选疫苗[18],最近报道发现AMA1蛋白结构域Ⅱ抗体可以有效抑制恶性疟原虫裂殖子入侵红细胞[19]。在鸡球虫中,AMA1的表达质粒对鸡柔嫩艾美耳球虫感染具有一定的免疫保护力[20]。以上研究充分证明了AMA1蛋白特异性抗体对虫体侵袭具有一定的免疫保护效果,在顶复门原虫入侵宿主中具有重要作用。目前关于马泰勒虫AMA1蛋白的研究国内外鲜有报道,还未证实马泰勒虫AMA1蛋白的特异性抗体是否与其他顶复门原虫一样,可以对宿主起到保护作用。
本研究成功获得了马泰勒虫新疆株AMA1基因序列,并成功表达出相对分子质量为60 kDa的重组蛋白,并且可以和天然阳性血清发生反应。有望成为马泰勒虫的免疫诊断抗原和疫苗候选抗原,相关蛋白互作及细胞定位试验有待于研究。本研究为探究马泰勒虫入侵宿主细胞的分子机制及疫苗的研制提供了理论依据,为进一步深入了解AMA1蛋白的生物学功能奠定了基础。
