水疱性口炎病毒核蛋白的纳米抗体和多聚抗核蛋白纳米抗体的原核表达及功能验证
2021-11-02郭玉堃马英先常雯茹明胜利杨国宇郭豫杰河南农业大学农业农村部动物生物化学与营养重点开放实验室河南郑州450046
郭玉堃,马英先,常雯茹,明胜利,杨国宇,郭豫杰 (河南农业大学 农业农村部动物生物化学与营养重点开放实验室,河南 郑州 450046)
水疱性口炎(vesicular stomatitis,VS)是由水疱性口炎病毒(vesicular stomatitis virus,VSV) 引起多种哺乳动物人畜共患的一种急性、高度接触性传染病,马、牛、猪等动物较易感。以舌、唇、口腔黏膜、乳头和蹄冠等处上皮发生水疱为主要特征[1]。VSV 为弹状病毒科、水疱病毒属的成员,VSV 基因组为不分节段的线性单股负链RNA[2],长约11 kb。从 3′端→5′端依次排列着 N、NS(P)、M、G、L 等 5 个不重叠的基因,分别编码核蛋白、磷酸蛋白、基质蛋白、糖蛋白、及 RNA 聚合酶蛋白[3]。
核蛋白在病毒免疫和诊断上具有重要的意义。核蛋白在不同种群中的保守性很强,且核蛋白抗原性高,进入体内的核蛋白作为优势抗原被 VSV 特异性细胞毒性 T 淋巴细胞识别,发挥杀伤细胞作用,参与免疫反应。刺激机体后会产生非中和抗体[4],在临床实践中,通过检测核蛋白的抗体就可区分是 VSV 感染还是疫苗免疫,这在 VSV 的临床诊断及防治中具有重要的意义。N 基因编码的病毒核蛋白由 422 个氨基酸残基组成,相对分子质量为 47 kDa。每个病毒粒子含有 1 258 个拷贝[5]。
在 VSV转录和复制的过程中,核蛋白优先和前导 RNA 结合,形成核蛋白 RNA 复合体[6],该复合体与病毒基因组 RNA 结合,形成了能够保护病毒 RNA 免受核酸酶消化的复合物[7],作为 RNA 合成的模板。N、P 和 L 是 VSV 转录和复制所必需的3种蛋白[8],以N-RNA 作为模板,同时以 L 蛋白、P 蛋白作为聚合物进行转录,能够合成结构完整的 RNA 链。因此,N、P 和 L 为干预病毒生命周期提供了可能靶点[9]。
HAMERS等[10]在单峰驼以及双峰的亚洲驼和南美骆驼的血清中发现一种天然缺失轻链的重链抗体(HCAb),克隆重链抗体的可变区得到仅由一个重链可变区组成的单域抗体,称为VHH 抗体(variable domain of heavy chain of heavy-chain antibody),又称为纳米抗体(nanobody),其晶体结构呈椭圆形,直径 2.5 nm,长 4 nm,是最小的功能性抗原结合片段[11]。
与传统抗体相比,VHH 具有相对分子质量小、易表达、高特异性、高亲和力、高溶解性、稳定性、免疫原性低、可识别独特构象的抗原表位、组织渗透性强、可穿透或转移进入血脑屏障等优点[12-15],使其作为一种小型化的基因工程抗体在基础研究、药物开发等领域具有广阔的前景[16-18]。近期有研究表明,在胞浆中表达的 VHHs 可以通过阻断参与蛋白质-蛋白质相互作用的界面,或通过在酶的活性中心结合,或通过识别或稳定其目标的不同构象而起到分子扰动作用[19]。HANKE等[20]研究表明,抗VSV 核蛋白的纳米抗体通过阻断mRNA 转录来阻止病毒基因的表达:抗 VSV 核蛋白的纳米抗体可与聚合酶辅因子 P 竞争结合,这将阻止 P 介导的聚合酶 L 进入RNA 模板,通过阻止 P 与核衣壳结合来抑制病毒转录。VHH 可能为潜在的靶向 RNA 转录的抗病毒药物提供线索[21]。然而,由于纳米抗体小,其血清半衰期短、与抗原的结合力通常比通过免疫动物获得的完整抗体的亲和力低很多[22]。
铁蛋白(ferritin)纳米颗粒通常是由 24 个亚基自组装形成的球形笼状结构,铁蛋白外壳的四级结构由 8 个亲水通道和 6 个疏水通道组成,主要负责蛋白笼内外的物质交换[23]。从羊驼中中分离出来的铁蛋白[24](GenBank 登录号:WP_014835352.1),进行截短后留下包含 97 个氨基酸的铁蛋白的结构域,称为赤鲜素蛋白(rubrerythrin)[25],赤鲜素蛋白在化学结构及相对分子质量等方面比普通铁蛋白简单且小的多,更利于高效表达与纯化。本试验将羊驼的抗VSV核蛋白纳米抗体序列(GenBank 登录号:ANJ89064.1),命名为 VSVNb,串联在截短型铁蛋白赤鲜素蛋白的 C 端[26],并按照大肠杆菌密码子偏好性进行密码子优化,命名为 FnL-VSV。
将纳米抗体和铁蛋白融合表达,形成 24 聚体,可有效降低小分子纳米抗体蛋白的降解,提高蛋白的有效浓度[27-29],使融合蛋白具有更高的抗原识别能力,同时作为靶向 RNA 转录的抗病毒药物的潜在可能也可增加其药物浓度增强抗病毒效果;因融合蛋白相对分子质量的增加, 在动物体内的半衰期也会延长,所以融合蛋白是一种既能增强亲和力又能延长纳米抗体半衰期的研究策略[30-31],期望其能够有效地用于疾病诊断和体内治疗中[32-33]。
1 材料与方法
1.1 主要试剂和材料E.coliBL21(DE3)感受态细胞为本实验室保存;IPTG 购自生工生物工程(上海)股份有限公司;Prestained Protein Marker Ⅰ 购自赛默飞世尔科技(中国)有限公司;硫酸铵购自天津市致远化学试剂有限公司;Ni2+购自 QIAGEN 公司;BCA 蛋白定量测定试剂盒购自北京鼎国昌盛有限公司;辣根过氧化物酶(HRP) 标记试剂盒(SureLINKTM HRP Conjugation Manual)购自北京西美杰科技有限公司;VSV 毒株为本实验室保存;JET BIOFIL 96 孔酶标板购自广州洁特生物过滤股份有限公司;TMB 显色液、终止液购自北京索莱宝科技有限公司。
1.2 基因的设计与合成将羊驼的抗VSV核蛋白纳米抗体序列(GenBank 登录号:ANJ89064.1)命名为 VSVNb,为便于纯化,在 VHH 基因 3′端加6×HE,委托南京金斯瑞公司进行合成(图 1A)并构建到载体 pET21b 上,重组载体命名为 pET21b-VSVNb。
将赤鲜素蛋白基因(GenBank 登录号:WP_014835352.1)根据铁蛋白的结构域截短后进行大肠杆菌密码子优化,和从羊驼中获得的抗VSV核蛋白纳米抗体序列(GenBank 登录号:ANJ89064.1)进行合成,为方便后期亲和标签 HE 的切除,在截短型铁蛋白基因 5′端加上 TEV 酶切位点;为便于纯化,在 TEV 基因 5′端加上 6×HE,委托南京金斯瑞公司进行合成(图 1B)并构建到载体 pET21b 上,重组载体命名为 pET21b-FnL-VSV。
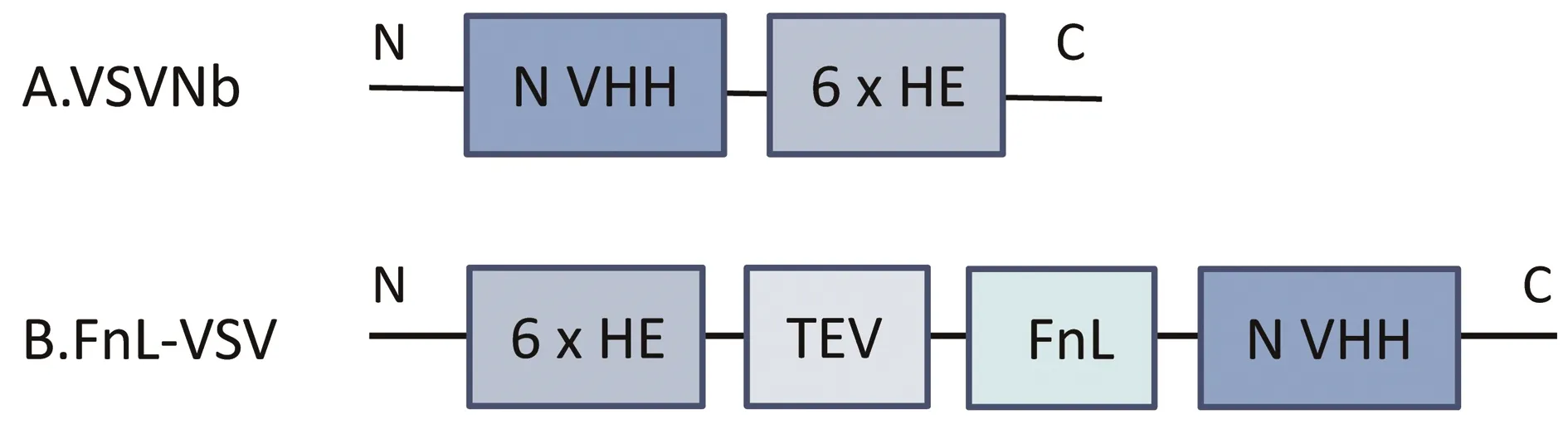
A.VSVNb蛋白序列N端至C端有抗VSV核蛋白纳米抗体、6×HE 亲和标签;B.FnL-VSV蛋白序列 N 端至 C 端有 6×HE 亲和标签、TEV 酶切位点、截短的铁蛋白赤鲜素蛋白、抗VSV核蛋白纳米抗体图1 融合蛋白 VSVNb 和 FnL-VSV 基因设计图
1.3 重组蛋白质的诱导表达与纯化将质粒 pET21b-VSVNb 和 pET21b-FnL-VSV 转化到E.coliBL21(DE3)感受态细胞,在含Amp 100 mg/L 的LB 平板上挑取含重组质粒的单个菌落,接种于含 100 mg/L Amp 的 2 mL LB 液体培养基中,37℃培养过夜。将得到的菌液按体积比 1∶100 接种于含 100 mg/L Amp 的 100 mL LB 液体培养基中,37℃、220 r/min 振荡培养至D600 nm值为 0.6~0.8,进行 IPTG 诱导表达。诱导结束后,菌液离心收集沉淀,10 mL PBS 重悬菌体,加溶菌酶(1 g/L)冰浴30 min 后,低温超声波破碎菌体(超声时间 5 s,间歇 10 s,120 次)。将破碎液高速离心后分别收集上清和沉淀。含 VSVNb 的上清通过金属鳌合亲和层析技术纯化得到目的蛋白,含FnL-VSV 的上清通过 30%硫酸铵进行盐析纯化获得目的蛋白。纯化后蛋白脱盐、浓缩、定量至 1 g/L。每一步操作均留样,进行 SDS-PAGE 分析,检测重组蛋白的诱导表达及纯化效果。
1.4 融合蛋白 FnL-VSV 电镜观察纯化的融合蛋白 FnL-VSV,在 pH 7.4 的 PBS 溶液中通过透射电镜观察铁蛋白纳米笼形成情况:取 10 μL 浓缩后的纯化蛋白滴到铜网上,静置 10 min,用滤纸从铜网的一边吸取液体;然后再滴加 10 μL 1%磷钨酸染色液,静置 2 min,再用滤纸从铜网的一边吸取染色液;将铜网置于玻璃平皿中,自然晾干;将制备好的铜网固定在样品握持杆的样品台上,插入到样品室内,抽真空后,进行观察和分析纯化的融合蛋白是否形成纳米颗粒。
1.5 融合蛋白 VSVNb 和 FnL-VSV 进行 HRP 标记将脱盐、定量为 1 g/L 的 VSVNb 和 FnL-VSV 蛋白通过 HRP 抗体标记试剂盒分别进行标记,操作方法按照说明书进行,标记好的抗体记作 VSVNb-HRP 和 FnL-VSV-HRP。
1.6 直接 ELISA
1.6.1不同浓度的纳米抗体 VSVNb 和 FnL-VSV 与病毒识别 VSV 经蔗糖超速密度梯度离心纯化,稀释至 5 mg/L,每个聚苯乙烯板的反应孔中加 100 μL,4℃过夜。次日取出,平衡至室温,弃去孔内溶液,每孔加入 150 μL 封闭液,37℃温育2 h后,取出平衡至室温,弃去孔内溶液,室温倒扣至干燥完成。
取出包被板及相关试剂,平衡至室温;每孔加入 100 μL 不同稀释度的 VSVNb-HRP 和FnL-VSV-HRP 抗体,进行 1∶10,1∶20,1∶40,1∶80,1∶160,1∶320,1∶640,1∶1 280,1∶2 560,1∶5 120,1∶10 240倍比稀释;覆膜,37℃孵育 1 h;取出,弃掉孔内液体,每孔加入 350 μL 洗液洗板,重复 5 次后,在吸水纸上拍干;每孔加入TMB 底物 A 和底物 B 各 50 μL,覆膜,37℃避光孵育 15 min;每孔加入 50 μL 终止液,颜色由蓝色迅速变为黄色;使用酶标仪检测D450 nm值,15 min内完成。
1.6.2纳米抗体VSVNb 和 FnL-VSV与不同质量浓度的病毒识别 VSV 经蔗糖超速密度梯度离心纯化,稀释至不同质量浓度,即0.312 5,0.625,1.25,2.5,5,10,20,40,80,160,320,640,1 280 mg/L,每个聚苯乙烯板的反应孔中加 100 μL,4℃过夜。次日取出,平衡至室温,弃去孔内溶液,每孔加入 150 μL 封闭液,37℃温育 2 h后,取出平衡至室温,弃去孔内溶液,室温倒扣至干燥完成。
取出包被板及相关试剂,平衡至室温;每孔加入 100 μL 稀释度为 1∶2 000 的 VSVNb-HRP 和 FnL-VSV-HRP 抗体;覆膜,37℃孵育1 h;取出,弃掉孔内液体,每孔加入 350 μL 洗液洗板,重复 5 次后,在吸水纸上拍干;每孔加入 TMB 底物 A 和底物 B 各 50 μL,覆膜,37℃避光孵育 15 min;每孔加入 50 μL 终止液,颜色由蓝色迅速变为黄色;使用酶标仪检测D450 nm值,15 min内完成。
2 结果
2.1 融合蛋白 VSVNb 和 FnL-VSV 的表达与纯化重组质粒 pET21b-VSVNb 转化至E.coliBL21(DE3),经 0.5 mmol/L IPTG 18℃、12 h诱导表达。超声破碎分别收集上清和沉淀,SDS-PAGE 检测结果显示,诱导后的全菌和破碎后上清样品在 15.95 kDa 处有与预期大小一致的蛋白条带(图2A)。结果表明,重组蛋白为可溶性表达,纯化效率较高。
重组质粒 pET21b-FnL-VSV 转化至E.coliBL21(DE3),经 0.5 mmol/L IPTG 18℃、12 h 诱导表达。超声破碎分别收集上清和沉淀,SDS-PAGE 检测结果显示诱导后的全菌和上清、沉淀、盐析及脱盐样品在 29.04 kDa 处有与预期大小一致的蛋白条带(图2B)。结果表明,重组蛋白部分可溶性表达,纯化效率很高。

A.融合蛋白 VSVNb(M.蛋白Marker;1.诱导前全菌;2.诱导后全菌;3.破碎后上清;4.破碎后沉淀;5.滤液;6~11.分别为10,10,20,50,50,100 mmol/L 咪唑洗杂蛋白);B.融合蛋白FnL-VSV(M.蛋白Marker;1.诱导前全菌;2.诱导后全菌;3.破碎后上清;4.破碎后沉淀;5.30%盐析后上清;6.30%盐析后沉淀;7.脱盐蛋白;8.定量蛋白 1 g/L)图2 融合蛋白 VSVNb和 FnL-VSV的表达与纯化
2.2 融合蛋白 FnL-VSV电镜结果透射电镜观察结果表明,本研究制备的重组蛋白 FnL-VSV 在生理条件下能够正确折叠,自发组装并形成粒径约为20 nm的纳米颗粒,大小、形状、结构与预期相符(图 3)。
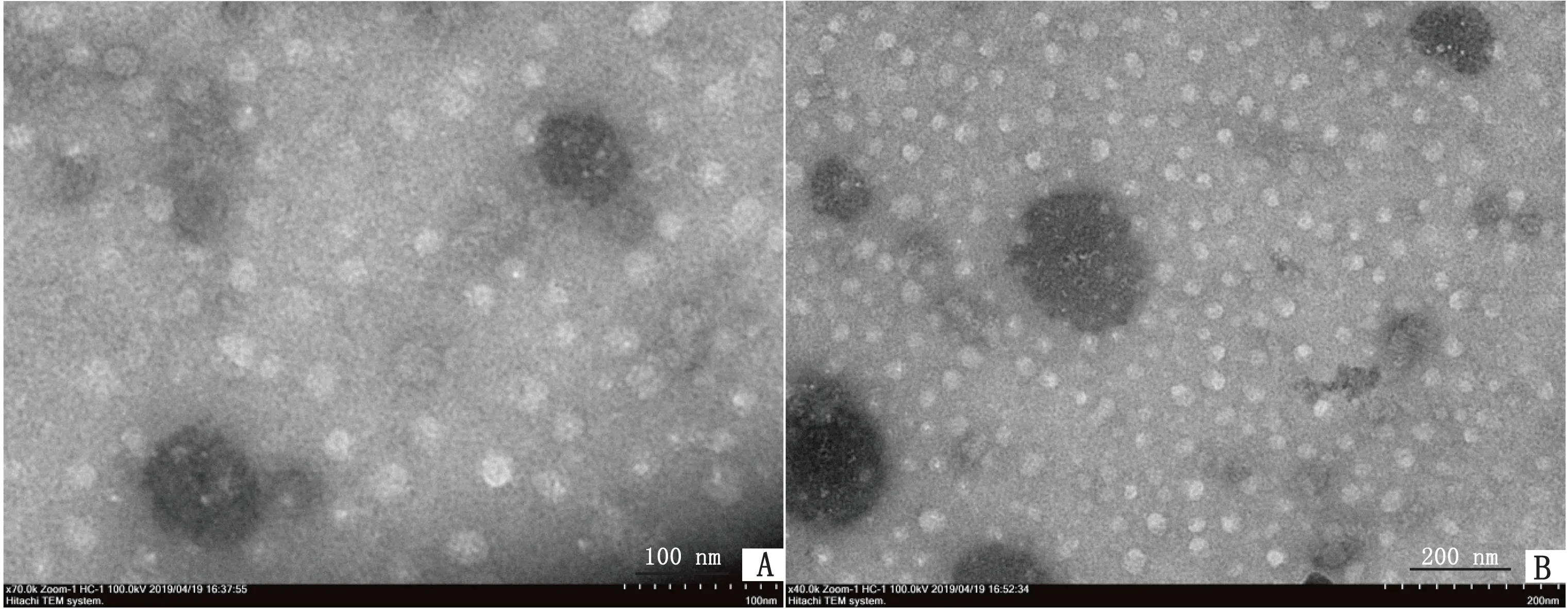
图3 融合蛋白FnL-VSV 透射电镜图
2.3 直接 ELISA 结果
2.3.1不同浓度的纳米抗体 VSVNb 和 FnL-VSV 与病毒识别 用 VSV 毒株、VSVNb-HRP 抗体和 FnL-VSV-HRP抗体进行直接 ELISA 检测,结果表明,在抗原浓度一定的情况下,融合蛋白 VSVNb-HRP及 FnL-VSV-HRP 均能与特异抗原在较低浓度条件下相结合,说明具有较高活性。制备的抗体经过 HRP 标记后,可以用于 VSV 毒株的识别,并且 HRP 标记的VSVNb 纳米抗体从1 000 mg/L倍比稀释 1∶10~1∶10 240 间均可以识别毒株,如图 4A 所示,HRP 标记的 FnL-VSV 铁纳米抗体从1 000 mg/L倍比稀释1∶10~1∶10 240 间均可以识别毒株,如图 4B 所示,FnL-VSV-HRP较VSVNb-HRP直接 ELISAD450 nm值大很多,说明 FnL-VSV-HRP 敏感性及活性更好。

图4 融合蛋白 VSVNb(A)和FnL-VSV(B)直接 ELISA 结果
2.3.2纳米抗体VSVNb和FnL-VSV与不同质量浓度的病毒识别 用VSV毒株、VSVNb-HRP 抗体和 FnL-VSV-HRP 抗体进行直接 ELISA 检测,结果表明,在抗体质量浓度一定的情况下,识别特异抗原的质量浓度由低到高(2.5~1 280 mg/L),说明其识别抗原的敏感性较高,识别范围较广(图5A、B)。直接ELISA结果表明,融合蛋白VSVNb和FnL-VSV在VSV的检测和研究中具有一定的应用价值。

图5 融合蛋白 VSVNb(A)和 FnL-VSV(B)直接 ELISA 结果
3 讨论
VSV是一种典型的无节段 RNA 病毒,因此在抗 VSV 病毒药物的研究中可选择的靶点有限。HANKE等[20]发现 N 蛋白的 VHH 序列中的特异性位点可与聚合酶辅因子P竞争结合,从而抑制病毒复制,并进行了利用 VHH 作为细胞内表达的抗病毒药物的研究。VHH相对分子质量小,其半衰期较短,铁蛋白将插入其 C 端的 VHH 序列包封到其空腔内[34]对或可增加蛋白浓度、延长纳米抗体的半衰期;对直接 ELISA 检测来说提高了与抗原结合的亲和力及敏感度[35],可用于病毒疾病的快速诊断[36]。
外源重组蛋白在大肠杆菌表达系统[37]中进行高效表达时,由于表达过程中缺乏某些蛋白质折叠的辅助因子,或环境不适,无法形成正确的次级键,从而影响重组蛋白的正确折叠,造成表达的蛋白在细胞内凝集,形成无活性的固体颗粒,即包涵体。以包涵体形式表达的抗体不具有活性,为了实现VHH抗体的可溶性表达,获得有活性的抗体,本研究通过降低诱导剂浓度、降低诱导温度等对表达条件进行优化,实现VHH的可溶性表达。
IPTG[38]作为一种强诱导剂,在菌体中不能被代谢,可以持续地发挥作用,所以少量的IPTG 就可以起到很好的诱导效果。采用较低浓度的IPTG可以适当的降低转录速率,有利于蛋白的可溶性表达。所以选择终浓度为0.5 mmol/L的IPTG作为最佳的诱导剂浓度。
诱导温度[39]不仅影响菌体的生长,同样影响着重组蛋白的诱导表达及蛋白的可溶性。有较多的蛋白在温度较高条件下诱导表达时容易出现错误性折叠,形成包涵体沉淀,不利于纯化且蛋白活性不高。而低温诱导可以有助于蛋白的可溶性表达及形成正确的结构,故选取18℃为纳米抗体的诱导表达温度。
直接ELISA方法是将抗原直接固定在固相载体上,加入酶标记的一级抗体,即可测定抗原总量,此一级抗体的特异性非常重要。其优势为操作简短,因无须使用二抗可避免交互反应。缺点是试验所用一抗都需要用酶标记,但不是每种抗体都适合做标记,费用相对提高。所以市场上很少运用直接 ELISA试剂盒进行检测[40]。
本试验制备的融合蛋白 VSVNb 和 FnL-VSV 是特异性针对于VSV核蛋白的纳米抗体和与截短型铁蛋白串联的纳米抗体,将其进行 HRP 标记后的 VSVNb-HRP 和FnL-VSV-HRP,作为直接 ELISA 中的一级抗体,与病毒抗原识别并作用。
