广西猪A群轮状病毒G9 P[7]型的分离与初步鉴定
2021-11-02陈荣琳张胜斌刘雪婷秦秋英王奕斐边金妮程振孔罗允燕罗期方韦祖樟黄伟坚欧阳康广西大学动物科学技术学院广西南宁530005广西农垦永新畜牧集团西江有限公司广西贵港53704
米 雪,陈荣琳,张胜斌,刘雪婷,秦秋英,王奕斐,边金妮,程振孔,罗允燕,罗期方,张 宁,陈 樱,韦祖樟,黄伟坚,欧阳康* (.广西大学 动物科学技术学院,广西 南宁 530005;.广西农垦永新畜牧集团西江有限公司,广西 贵港 53704)
轮状病毒(rotavirus)属于呼肠孤病毒科轮状病毒属的成员,其可感染多种新生动物和幼龄动物,也是引起哺乳和断奶仔猪腹泻的常见病因[1]。猪轮状病毒(porcine rotavirus,PoRV)可分为A、B、C、E 4个血清群,其中以A群最常见,占所有轮状病毒腹泻病例的90%[2]。轮状病毒基因组由11股双链RNA片段组成,大小为0.6 ~3.3 kb,编码12种蛋白质[3]。VP4、VP6和VP7由于其独特的生物学功能而成为最近研究的焦点。VP4是一种具有受体结合活性的非糖基化胰蛋白酶敏感蛋白,胰蛋白酶可以使VP4蛋白暴露出了具有感染性的VP5(60 kDa)和VP8(28 kDa)两个位点,从而使病毒具有感染性[4]。
轮状病毒的显著特征是其基因片段在自然界或试验条件下容易发生基因重组。有研究表明PoRV和人轮状病毒毒株之间可发生基因重排,可引起人的腹泻[5]。
为确定广西贵港某猪场导致仔猪腹泻的病原,本研究采用PCR方法检测了引起仔猪腹泻的3种常见病原,即猪流行性腹泻病毒(porcine epidemic virus,PEDV)、猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)和PoRV。检测结果为仅PoRV阳性后,进行病毒的分离,获得了1株能产生稳定病变的广西地区PoRV。通过PCR鉴定、病毒分离以及电镜观察等生物信息学分析,确定该毒株为广西新发的G9 P[7]型PoRV,是广西地区首次分离到G9 P[7]型PoRV。G9型PoRV被认为是一个新兴的基因型在世界各地传播[6],本试验为后续G9 P[7]型PoRV的相关研究奠定了基础。
1 材料与方法
1.1 临床样品采集广西贵港某猪场出现腹泻症状仔猪的肠内容物10份,用含有20%甘油和1 000 U/mL青链霉素的已灭菌PBS对肠内容物进行5倍稀释,振荡混匀后,4℃、3 000 r/min离心5 min,取上清液用0.22 μm滤器过滤用于病毒分毒。
1.2 主要材料Marc-145细胞(非洲绿猴胚胎肾细胞)由广西大学动物科学技术学院动物传染病与分子免疫学实验室保存。MEM培养基和0.25% 胰酶均购自Sigma公司;胎牛血清购自Gibco公司;pMD18-T购自TaKaRa公司;AxyPrep体液病毒核酸提取试剂盒购自Axygen公司;胶回收试剂盒和质粒小量提取试剂盒均购自OMEGA公司;DH5α感受态细胞购自广西南宁康维生物科技有限公司;PEG-8000购自Solarbio公司。
1.3 病毒接种将处理过的小肠内容物经0.22 μm滤器过滤后与质量浓度为20 mg/L的胰酶1∶1混匀,在37℃条件下作用1 h。将其按培养液的10%接种,37℃、5% CO2培养箱孵育1 h后,加入无血清的MEM培养基(含0.5 mg/L胰酶)于37℃、5% CO2培养箱静止培养。每天观察病变(CPE),在细胞产生80%以上的病变时,收取病毒液。按照上述方法将病毒连续盲传20代。
1.4 基因的扩增与序列的测定根据GenBank登录的猪A群轮状病毒VP4、VP6、VP7的基因序列及已发表的相关报道[7],以及参照LARRALDE等[8]报道的VP4基因编码氨基酸84~180区域用于VP4血清分型和亚型分型,设计3对引物,分别用于病毒的VP4部分片段以及VP6和VP7基因全长的扩增,引物均由上海杰李生物技术有限公司合成,引物序列见表1。
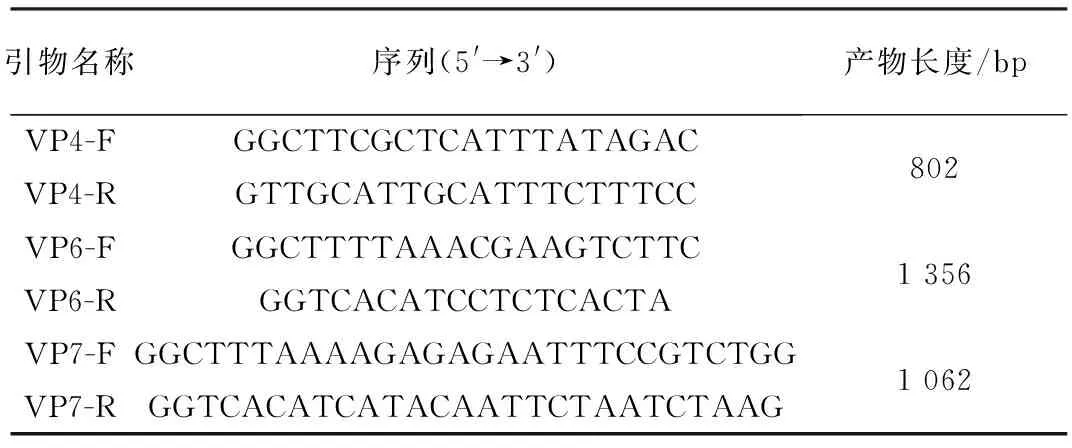
表1 引物信息
采用RNA提取试剂盒提取1.3中分离病毒的核酸,反转录为cDNA,再将cDNA为模板利用上述引物进行VP4、VP6、VP7基因扩增,反应程序:95℃ 3 min,94℃ 45 s,55℃ 40 s,72℃ 1.5 min,35个循环,72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测,切胶回收目的片段。将VP4、VP6、VP7基因连接pMD18-T载体进行基因克隆,构建pMD18-T-VP4、pMD18-T-VP6、pMD18-T-VP7重组质粒,由上海杰李生物技术有限公司对阳性质粒进行序列的测定。将分离株VP4、VP6和VP7基因的测序结果在NCBI上进行BLAST比对。使用MEGA 5.02软件制作VP4和VP7基因遗传进化树,分析毒株遗传进化关系。
1.5 病毒浓缩与透射电镜观察收集30 mL病毒液,反复冻融3次后,4℃、10 000 r/min 离心1 h,收集上清用0.22 μm滤器过滤。取7.5 mL 50% PEG-8000加入滤过后的上清,4℃温和搅拌过夜沉淀病毒;将上述病毒上清-PEG 8000混合液于4℃、12 000 r/min 离心2 h沉淀病毒。用1 mL PBS重悬病毒沉淀,4℃搅拌混匀30 min,取100 μL病毒重悬液用于透射电镜观察。
2 结果
2.1 病毒的分离鉴定结果提取采集的10份临床样品的RNA,采用PCR检测PEDV、TGEV、PoRV病原,结果显示,PEDV和TGEV阴性,PoRV阳性,将处理后滤过的样品上清液接种Marc-145细胞,在盲传至第4代时,接毒24 h后细胞出现明显病变。正常Marc-145细胞轮廓清晰,状态良好(图1A),发生病变的Marc-145细胞,细胞皱缩,颗粒增多,最后脱落(图1B),结果表明初步分离到1株病毒,将其命名为18GXGG毒株。

A.正常Marc-145细胞;B.分离毒株感染Marc-145细胞24 h后细胞病变图1 细胞病变结果(200×)
将能产生稳定病变的18GXGG株盲传20代。将收取的第5,10,15代的病毒上清进行RNA提取,PCR鉴定为PoRV阳性。取第10代的病毒RNA反转录后进行VP4(802 bp)、VP7(1 062 bp)和VP6(1 356 bp)基因的扩增(图2),连接至pMD18-T载体上由上海杰李生物技术有限公司进行测序,进一步鉴定本研究分离到1株PoRV。

M.DL2000 DNA Marker;1~3.分别为VP4、VP7、VP6基因扩增产物图2 PCR扩增结果
2.2 基因型鉴定和遗传进化分析将18GXGG株的VP6基因序列与GenBank登录的PoRV VP6基因进行核苷酸序列分析。结果显示,18GXGG株VP6基因序列与国内2株PoRV的VP6基因(FJ617209.1、MT874988.1)的同源性分别为99.85%,99.78%,确定分离毒株为猪A群轮状病毒(porcine group A rotavirus,PoRVA)。
将18GXGG株的VP4基因序列与GenBank登录的轮状病毒VP4基因进行核苷酸序列分析。结果显示,18GXGG株的VP4基因序列和P[7]型韩国株(MF940546.1)的VP4基因序列同源性达到99.88%,和P[7]型中国株(AY523636.1)的VP4基因序列同源性达到99.63%。将分离病毒18GXGG株与GenBank登录的42株不同基因型的轮状病毒VP4基因参考序列采用MEGA5.02软件绘制VP4基因的遗传进化树(图3),结果显示,18GXGG株与P[7]型的韩国株(MF940546.1)和中国株(AY523636.1)亲缘关系较近,且与P[7]型的轮状病毒参考毒株形成一个分支。

·本研究分离毒株图3 18GXGG分离株VP4基因进化树
将18GXGG株的VP7基因序列与GenBank登录的轮状病毒VP7基因进行核苷酸序列分析。结果显示,18GXGG株的VP7基因序列和属于G9型的美国株(MN862194.1)VP7基因序列同源性高达99.80%,和G9型中国株(JF781163.1)的VP7基因序列同源性达到95.57%。将分离病毒18GXGG株与GenBank登录的42株不同基因型的轮状病毒VP7基因参考序列采用MEGA5.02软件绘制VP7基因的遗传进化树(图4),结果显示,18GXGG株与G9型的参考毒株在同一分支,并且和日本株(AB091753)亲缘关系最近。
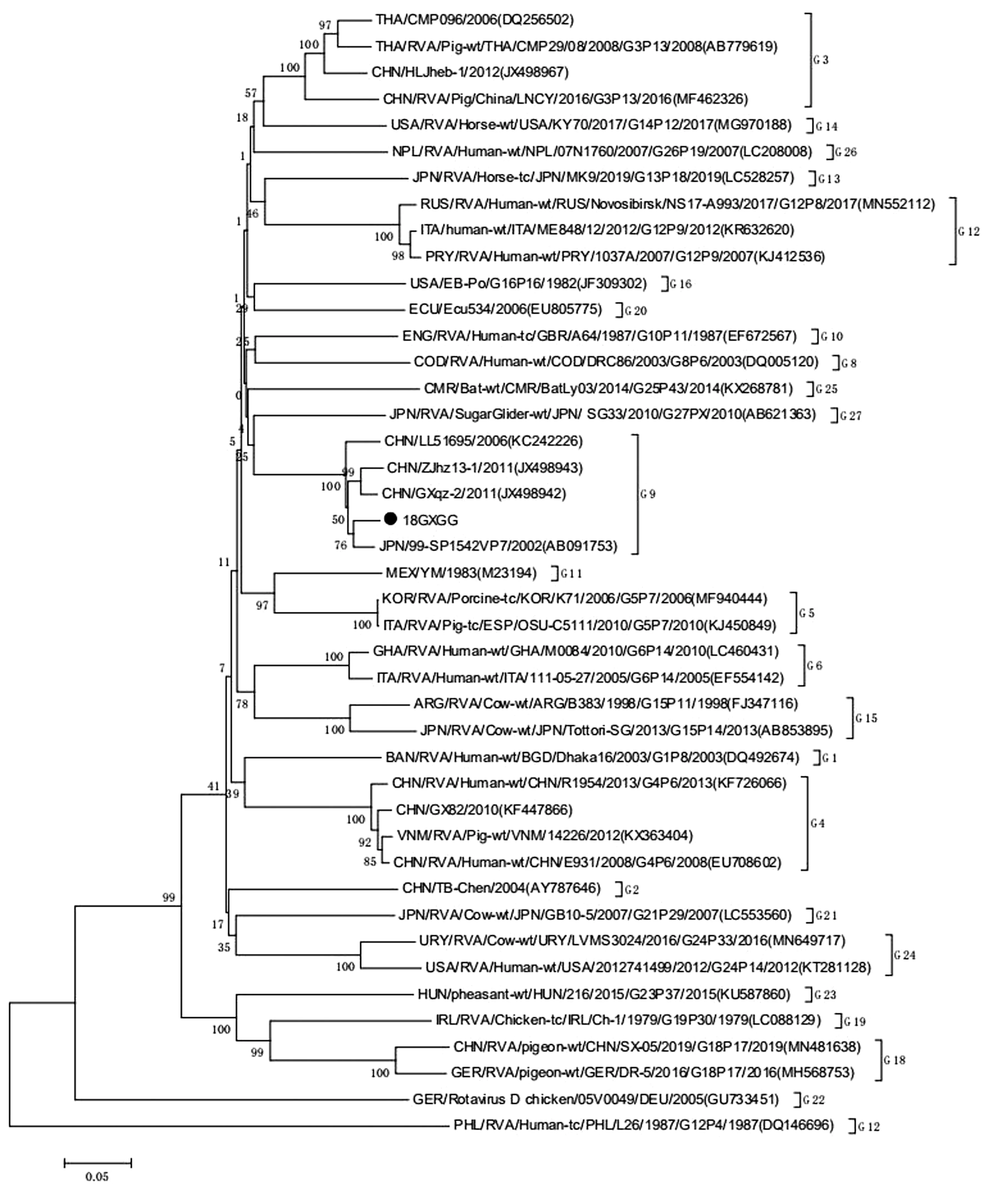
·本研究分离毒株图4 18GXGG分离株VP7基因进化树
通过基因型鉴定结果以及遗传进化分析,结果表明,本研究首次分离到广西地区PoRVA G9 P[7]型毒株。
2.3 VP4、VP7基因的变异分析应用MegAlign软件对本研究18GXGG分离毒株与P[7]型的PoRV参考株的VP4基因氨基酸序列进行比对分析,结果显示,广西地区18GXGG株的VP4基因存在氨基酸的变异,第11位氨基酸(N→S)出现了变异(图5);将18GXGG分离毒株与G9型PoRV参考株的VP7基因氨基酸序列进行比对分析,发现广西地区18GXGG株VP7基因氨基酸序列在208~225出现了较为集中的突变,其主要变异位置为:208位(T→I);212位(A/T→K);225位(V→A);271位(I→V)(图6)。

图5 VP4氨基酸变异位点分析

图6 VP7氨基酸变异位点分析
2.4 病毒粒子形态观察PoRV粒子略呈圆形、具有双层衣壳,形似车轮状,病毒粒子大小约为70 nm[9]。将盲传至第10代的18GXGG分离毒株的病毒上清液超速离心处理后,在透射电镜下能够观察到略呈圆形、大小为70~75 nm呈车轮状的单个病毒粒子,具有PoRV的形态特征(图7,黑色箭头处)。结果表明,本研究分离到1株PoRV。
3 讨论
轮状病毒为人畜共患病,常引起幼龄儿童和幼畜发生严重腹泻,使其免疫力下降,进而感染其他病原[10]。PoRV感染在猪群中非常常见。其通常与其他腹泻病毒呈混合感染,如PEDV,TGEV等,在养猪业中造成重大损失。目前没有较好的治疗方法,临床上主要用接种疫苗的方法进行疾病的预防。
BISHOP等[11]首次在腹泻的婴幼儿粪便中发现了轮状病毒,但在接下来的研究中发现用细胞培养分离轮状病毒比较困难。有报道在接种病毒前使用胰蛋白酶处理病毒,然后再接种于恒河猴胎肾细胞(MA-104),成功分离了轮状病毒,之后发现经过胰酶处理后的轮状病毒在ST、Marc-145和Vero等细胞上也能生长繁殖[12-13]。
事实证明,轮状病毒的分离由于临床样品的复杂性而具有一定难度,本研究将样品与质量浓度为20 mg/L的胰酶混合处理,再将病毒液接种至Marc-145细胞上,在盲传至第4代时出现典型CPE,毒株能稳定的在细胞上生长繁殖。通过PCR初步鉴定出分离株为PoRVA G9 P[7]型,并将其命名为18GXGG,而后通过透射电镜观察到形似车轮状的病毒粒子。分析18GXGG株的VP4、VP7基因氨基酸序列,发现其发生了某些氨基酸位点的变异。PoRV 18GXGG株的后续研究还需进一步探索。
轮状病毒呈现多样化流行趋势,动物轮状病毒基因重组可能导致人轮状病毒出现动物才有的血清型,原霖[14]研究表明,人类新发的轮状病毒如G9和G12型可能来自猪源病毒基因重组,因为轮状病毒的G9型和G12型在猪群中检出率较高。由于轮状病毒不同基因型全球流行的趋势分化以及PoRV和人轮状病毒基因重排发生率增加,加强对PoRV的预防及检测对公共卫生的影响显得尤为重要。
G9型轮状病毒被认为是全球范围内猪和人类的新兴基因型,并且G9型毒株通常与P[7]、P[13]、P[19]和P[23] 组合[15]。本研究采用Marc-145细胞,分离出新型基因型G9型,并且与P[7]型组合形成G9 P[7]型毒株。但近年来,在世界不同范围检测到了不常见的A群轮状病毒G和P基因型,并且有新的轮状病毒基因群在不同地区检测到[16-17]。PoRV的流行性和遗传多样性不断增加,猪场接种疫苗的效果也不尽人意,因此新型轮状病毒的分离为今后疫苗的研发具有重要意义,以增强我国PoRV的有效预防。
