铁死亡与肿瘤免疫的研究进展*
2021-11-01陈麒安刘超群陈怡赵亮
陈麒安,刘超群,陈怡,赵亮△
南方医科大学 1第二临床医学院,2基础医学院病理学系,3第一临床医学院(广东广州 510515)
铁死亡由Stockwell等学者于2012年提出。这是一种铁依赖性的、由脂质活性氧(reactive oxygen species,ROS)驱动的程序性死亡形式,它在细胞形态、生化、遗传特征方面显著不同于凋亡、坏死和自噬等死亡形式。铁死亡的发生机制为:膜磷脂在非酶或脂氧合酶(lipoxygenase,LOX)等途径及铁的催化下形成脂质ROS,脂质ROS持续累积最终导致细胞死亡。细胞对铁死亡的敏感性主要由谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)调节。GPX4是一种硒代半胱氨酸酶,它能在还原型谷胱甘肽(glutathione,GSH)存在的条件下将毒性脂质ROS还原为无毒的脂质醇,从而阻止铁死亡的发生。GSH的合成原料由胱氨酸-谷氨酸逆向转运体(System Xc-)供应。System Xc-可在将谷氨酸输出至细胞外的同时,将细胞外的胱氨酸转运入细胞内,从而促进GSH的合成,维持GPX4的活性。小分子erastin可以通过抑制System Xc-对胱氨酸的转运,导致GSH耗竭和GPX4失活,从而诱导铁死亡,而RSL3则通过抑制GPX4的活性直接诱导细胞发生铁死亡。研究发现,GSH-GPX4对于维持细胞活性尤为重要,在免疫细胞中亦然。此外,GSH耗竭和(或)GPX4失活的肿瘤细胞发生铁死亡,释放细胞内源性分子调节免疫反应,同时,免疫系统释放的细胞因子也可通过调节肿瘤细胞内GSH-GPX4水平,影响细胞对铁死亡的敏感性(图1)。
1 GSH-GPX4轴对免疫细胞活性的调节作用
GPX4作为脂质ROS清除的关键酶,对维持细胞活性至关重要。事实上,氧化应激在细胞活性的调节中起着双重作用,它一方面帮助细胞在细胞外环境或细胞内刺激下生存或分化,另一方面却会引起膜破裂、蛋白质降解、脂质过氧化、DNA损伤、细胞死亡等。在T细胞活化过程中,线粒体ROS对于活化T细胞核因子(nuclear factor of activated T cells,NFAT)、核因子-κB(neclear factor-κB,NF-κB)和激活蛋白-1(activator protein-1,AP-1)等相关转录因子的激活至关重要[1]。研究表明,GSH可以通过调节T细胞中ROS依赖的信号通路参与代谢重编程,协调T细胞亚群的分化和能量代谢需求[2],进而影响肿瘤微环境中的免疫调节。此外,铁死亡诱导剂erastin诱导的脂质过氧化可通过抑制骨形态发生蛋白家族的表达,促进人外周血单核细胞(peripheral blood mononuclear cell,PBMC)向B细胞和自然杀伤细胞的增殖和分化[3]。然而,有研究表明,髓系细胞中GPX4的消耗增加了败血症的致死性[4]。GPX4敲除的髓系细胞无法有效清除活性氧,这将增加肠上皮的遗传不稳定性,进而刺激肠肿瘤的发生及侵袭性生长[5]。另外,GPX4缺失的小鼠T细胞将迅速聚集脂质过氧化物并发生铁死亡,导致免疫系统无法保护机体免受感染的侵害[6],这提示GPX4在介导T细胞免疫反应中也发挥重要作用。
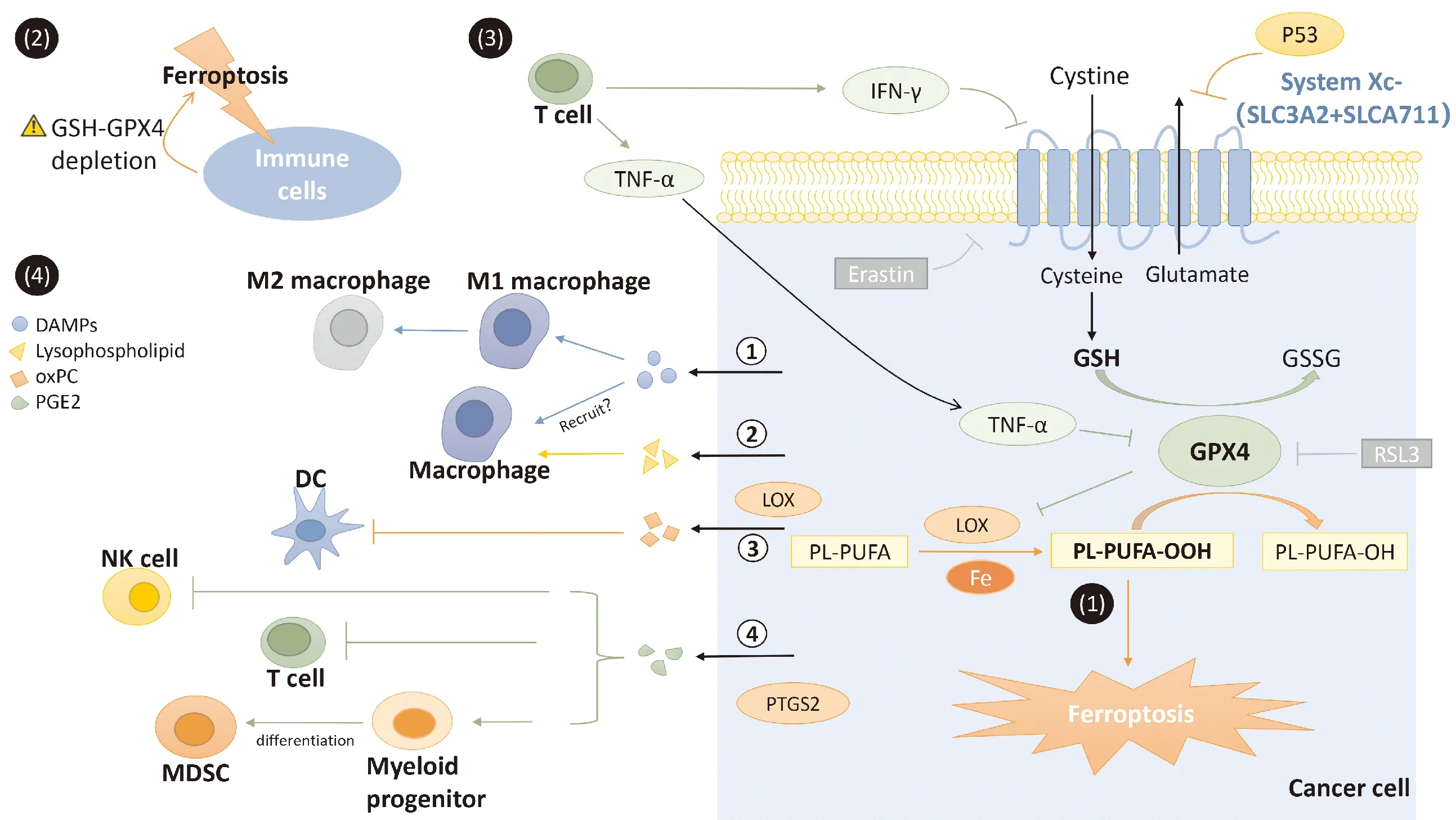
注:(1)铁死亡发生过程;(2)GSH耗竭和(或)GPX4失活的免疫细胞发生铁死亡;(3)T细胞释放IFN-γ、TNF-α调节细胞内GSH-GPX4,从而调节细胞对铁死亡的敏感性;(4)肿瘤细胞铁死亡诱发的损伤信号参与调节免疫细胞活性与功能。DAMPs:损伤相关分子模式(damage associated molecular patterns);oxPC:氧化磷脂酰胆碱(oxidized phosphatidylcholine);PGE2:前列腺素E2(prostaglandin E2);树突状细胞(dendritic cell);MDSC:髓源性抑制细胞(myeloid-derived suppressor cell)图1 铁死亡与肿瘤免疫调节
2 免疫细胞因子对肿瘤细胞GSH-GPX4轴的调节作用
研究发现,CD8+T细胞可通过释放IFN-γ下调System Xc-的关键组成亚单位SLC7A11和SLC3A2的表达,抑制谷氨酸转运及GSH合成,从而促进肿瘤细胞发生脂质过氧化和铁死亡。联合cysteinase(一种可降解胱氨酸和半胱氨酸的工程酶)与免疫检查点阻滞可能协同地增强T细胞介导的抗肿瘤免疫及诱导细胞铁死亡的作用[7]。
在黑色素瘤中,免疫活性升高引起的炎症性微环境可促进黑色素瘤细胞的去分化,这种去分化状态是黑色素瘤细胞对靶向治疗和免疫治疗交叉耐药的根源。实验证实,用TNF-α和IFN-γ刺激黑色素瘤细胞可分别导致NF-κB或STAT1信号通路的激活,诱导细胞去分化,提高其对erastin和RSL3诱导的铁死亡的敏感性。其机制可能与去分化黑色素瘤细胞中GSH的水平相关[8]。因此,免疫细胞因子通过诱导黑色素瘤细胞对铁死亡的敏感性,可以清除去分化状态的细胞群,进一步阻止具有免疫抑制能力的黑色素瘤细胞累积。可见,这种联合治疗可以在有效杀死肿瘤细胞的同时避免了肿瘤细胞的免疫逃逸。
3 肿瘤细胞铁死亡诱发的损伤信号参与调节免疫细胞活性与功能
研究表明,凋亡细胞可以通过释放“找我(find me)”信号吸引巨噬细胞,同时,凋亡细胞表面暴露的“吃我(eat me)”信号则诱导巨噬细胞将其吞噬[9]。可以想象,发生铁死亡的肿瘤细胞,也释放类似的信号发挥免疫调节作用。在体外,巨噬细胞有效吞噬了发生铁死亡的肿瘤细胞,支持了此类信号的存在[10]。
3.1 肿瘤细胞铁死亡释放损伤相关分子模式 通过坏死性途径死亡的细胞(如坏死、焦亡),其特征是细胞膜破裂并释放细胞内成分,如损伤相关分子模式(damage associated molecular patterns,DAMPs),以吸引巨噬细胞,提高抗原提呈效率。DAMPs包含“find me”和“eat me”信号,如钙网蛋白、ATP、HMGB1等[11]。实验证明,发生铁死亡的肿瘤细胞可通过自噬依赖性方式释放高迁移率族蛋白1(high mobility group box 1,HMGB1)[12]。HMGB1是一种细胞核内的非组蛋白,它被释放到胞外后,作为DAMPs,通过与RAGE、TLR2、TLR4等受体结合,激活相关信号通路,从而诱导免疫细胞的活化及细胞因子的产生[13]。在心脏缺血/再灌注损伤模型中,铁死亡细胞通过释放DAMPs,激活固有免疫,募集嗜中性粒细胞[14]。在胰腺导管腺癌中,发生自噬依赖性铁死亡的肿瘤细胞可以释放Kras作为一种DAMPs,通过RAGE途径诱导巨噬细胞脂肪酸氧化,进而向M2型极化,诱导免疫抑制[15]。
3.2 肿瘤细胞铁死亡释放脂质介质 对发生铁死亡的细胞进行脂质分析,发现有大量双氧合和三氧合的含磷脂酰乙醇胺(phosphatidylethanolamine,PE)的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)积累,这可能是由15-LOX催化产生的[16]。虽然细胞膜外氧化的PE及其氧化分解产物、水解产物的生物学作用尚未可知,但已证实在凋亡细胞中,溶血磷脂可作为免疫调节信号吸引抗原提呈细胞[17]。另外,有实验发现,15-LOX产生的脂质介质可调节树突状细胞(dendritic cell,DC)的成熟并调节适应性免疫反应,如氧化磷脂酰胆碱(phosphatidylcholine,PC)可通过激活转录因子NRF2抑制DC成熟,并抑制辅助性T细胞17(helper T cell,Th17)细胞的分化[18]。然而,在铁死亡环境中释放的脂质介质是否也发挥着同样的作用还有待进一步的研究证实。
研究发现,发生铁死亡的肿瘤细胞中,除了LOX产物增加外,还有PGE2的大量释放,这可能与前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)的表达显著上调有关[19]。目前已经证实,PGE2作为促炎因子发挥作用的同时,也具有免疫抑制活性。PGE2诱导的免疫抑制作用如下:(1)抑制NK细胞的活性及其分泌CCL5和XCL1的能力,从而抑制肿瘤微环境中DC的招募[20];(2)促进DC分泌的细胞因子从Th1 型向 Th2 型转换,从而降低CD8+T细胞的活性[21];(3)诱导髓样祖细胞分化为髓源性抑制细胞(myeloid-derived suppressor cell,MDSC),增强MDSC介导的免疫抑制及其诱导产生Treg细胞的能力,进而促进肿瘤进展[22]。
综上所述,铁死亡细胞释放的脂质介质可能在免疫系统激活的多个步骤中发挥调节作用,包括抗原加工、提呈、免疫细胞的成熟、迁移。但在不同条件下,铁死亡释放的不同信号有可能发挥着促进免疫或抑制免疫两种截然相反的作用。
3.3 GPX4在铁死亡与免疫调节中的作用 细胞内促炎脂质介质的生物合成多由LOX和PTGS催化而来,这些酶的活性则受GSH-GPX4的调控[23]。因此,GSH耗竭和(或)GPX4失活的肿瘤细胞内LOX的酶活性升高,脂质ROS及促炎性细胞因子的合成增多。这些细胞在发生铁死亡的同时,可以释放大量细胞内源性分子(包括DAMPs、脂质介质等)激活免疫系统,诱导中性粒细胞和巨噬细胞分泌促炎因子,如TNF-α、IL-1β等[24]。TNF-α和IL-1β可以诱导PTGS2活化,此外TNF-α还可使GPX4持续下调[25],这些效应最终都导致LOX、PTGS2的酶活性升高,进一步促进了铁死亡及免疫炎症反应。研究表明,固有免疫系统的细胞通过分泌白三烯、hepoxilins等,与PTGS和LOX酶联合维持炎症状态,并且最终通过分泌resolvins和lipoxin使炎症消退[24]。这种自发放大循环(auto-amplification loop)也发生在其他非凋亡性细胞死亡形式中,并且最终可导致组织损伤和器官衰竭[26]。可以想象,如果GPX4水平持续下降,固有免疫系统没有及时释放消除炎症的信号,可能会导致持续的慢性炎症,引起肿瘤环境中的免疫抑制以及免疫炎症性的病理损伤(如缺血/再灌注损伤)等。
4 肿瘤治疗中的铁死亡与免疫调节
肿瘤免疫治疗是一种通过调节人体的免疫防御机制杀伤肿瘤细胞的治疗方法,因其不良反应小、特异性强等优点而备受关注。近年来,不断有用于免疫治疗的新靶点和新技术出现。其中,重组腺病毒P53注射液作为世界上第1个基因治疗产品,已被应用于多种恶性肿瘤的治疗。野生型p53是一种抑癌基因,它除了能够导致细胞周期阻滞、促进细胞凋亡以外,还与抗肿瘤免疫密切相关[27]。研究发现,在肿瘤细胞中,P53蛋白大量积聚,并作为肿瘤相关抗原诱发机体免疫反应,发挥抗瘤效应[28]。目前已有许多研究表明,P53在肿瘤细胞铁死亡的调节中发挥重要作用。在人骨肉瘤与人乳腺腺癌细胞中,P53可以通过与SLC7A11基因的启动子区域结合,抑制SLC7A11的转录,进而导致细胞内GSH合成减少,对erastin诱导的铁死亡敏感性增加[29]。因此,我们设想P53诱导的免疫治疗是否可以与铁死亡诱导剂相结合,提高抗肿瘤治疗的疗效。
如何有效地将免疫检查点疗法与传统的肿瘤治疗方案相结合是目前肿瘤治疗面临的一个巨大挑战。有研究发现,放射治疗诱导的共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)可以协同免疫治疗活化的CD8+T细胞,抑制GSH的合成,从而促进肿瘤细胞脂质过氧化物积累,诱导铁死亡[30]。该研究提示铁死亡激动剂可以作为一种放射治疗及免疫治疗的增敏剂,在两者联合治疗中起桥梁作用。光动力疗法(photodynamic therapy,PDT)是一种新型的肿瘤治疗方法,目前已有许多研究发现PDT对于肿瘤微环境中的免疫调节有重要作用,PDT与免疫的联合治疗也备受关注。据报道,复合纳米药物SRF@Hb-Ce6[由铁死亡诱导剂索拉菲尼(sorafenib,SRF)与血红蛋白(hemoglobin,Hb)、光敏剂chlorin e6(Ce6)组成的复合纳米药物)],可以将铁死亡与PDT相结合,具有良好的协同抗肿瘤活性。实验证明,SRF@Hb-Ce6通过募集肿瘤组织中的CD8+T细胞,增加IFN-γ分泌,协同SRF促进肿瘤细胞发生铁死亡[31]。由此可见,明确免疫与铁死亡的相互调节机制,对于将铁死亡与免疫治疗及其他抗肿瘤治疗方法联合,以提高抗肿瘤疗效具有重要意义。
5 展望
铁死亡的发现,为许多疾病的发生机制阐明提供依据,也为肿瘤治疗开辟了新途径。铁死亡的发生与细胞内铁、脂质ROS、谷胱甘肽的代谢密切相关,许多分子(如ACSL4、LOX、NADPH、CoQ10)则可通过调节以上三要素调控细胞对铁死亡的敏感性。目前不断有研究发现新的铁死亡调控分子机制及可能的抗肿瘤靶点,然而,关于铁死亡背景下的坏死性炎症及免疫调节仍存在一些问题:(1)除了GSH-GPX4轴以外,参与铁死亡的铁离子是否也受到免疫因子的调控;(2)LOX、PTGS等不同酶的催化产物是否会引起不同的免疫应答;(3)肿瘤细胞发生的铁死亡除了杀伤肿瘤细胞外,是否诱导抗肿瘤免疫或者抑制免疫应答。进一步明确这些问题,对于阐明疾病的发生机制,指导如何联合铁死亡与免疫用于肿瘤等疾病的治疗具有重要临床意义。
