氧化胁迫对猪肉内源酶及保水性的影响
2021-10-31王梦琦李洪军贺稚非
王梦琦,李洪军,2,张 东,贺稚非,2,
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
我国是猪肉第一生产和消费大国。保水性作为肉制品重要的品质特征,不仅与肉制品的感官特性密切相关,而且与猪肉加工企业经济效益直接挂钩[1]。一般而言,保水性好的肉制品具有较好的质地特性,拥有良好的滋味和口感。此外,提高肉制品保水性对提高肉类工业的经济效益具有重要意义。影响肉制品保水性的因素有很多,如包装方式[2]、贮藏方式[3]、蛋白质氧化[1]等。
近年来,国内外关于蛋白质氧化对肉品保水性的影响已逐渐成为了研究热点。Huff-Lonergan等[4]指出蛋白质氧化是导致肌肉成熟过程中保水性变化的重要因素。Ali等[5]发现反复冻融鸡胸肉蛋白质氧化是导致保水性下降的主要原因。Liu Zelong等[6]发现氧化引起猪肉保水性下降,这主要是因为蛋白质交联限制了肌原纤维蛋白(myofibrillar protein,MP)扩张。王兆明等[7]指出蛋白氧化破坏了原有的氧化还原平衡,改变了蛋白质与水分子间建立静电相互作用、氢键和毛细管力的能力,从而对肌肉保水性产生影响。Zhang Dong等[8]研究发现MP体外氧化也是引起肌肉保水性变化的原因。此外,肌肉保水性还与钙蛋白酶以及组织蛋白酶等内源酶密切相关。有研究表明,肉中的内源酶对蛋白质的氧化降解具有一定的调控作用[9-10]。但在氧化胁迫条件下,关于氧化、内源酶表达量、蛋白降解三者之间的关系仍不明确,尤其是这三者对肌肉保水能力的综合影响值得进一步深入探讨。
因此,本研究采用羟自由基氧化体系对猪肉进行模拟氧化实验,并对氧化处理后的猪肉进行进一步的生化指标分析。通过蛋白质免疫印迹(Western blotting)实验探讨氧化胁迫对猪肉内源酶表达量的影响,将经氧化处理后的猪肉中的肌浆蛋白(sarcoplasmic protein,SP)和MP提取出来,测定荧光光谱、紫外光谱、羰基含量等指标,探讨氧化胁迫对猪肉蛋白的影响。最后通过皮尔逊相关性分析探讨内源酶的变化与蛋白氧化之间的关系,为深层次揭示氧化胁迫条件下,氧化程度、内源酶变化、蛋白氧化降解三者之间的关系提供一定理论参考,为阐明氧化胁迫条件对猪肉保水性的影响提供一定理论依据。
1 材料与方法
1.1 材料与试剂
猪背部最长肌选购自重庆北碚永辉超市的12 月龄本香猪肉,放置于冷藏箱中运送至实验室,猪肉的L*值为51.08,pH值约为5.9。然后去除可见的脂肪及结缔组织,沿着肌纤维的方向切成1 cm×1 cm×1 cm的块状,放置于-80 ℃下冷冻备用。
磷酸氢二钠、磷酸二氢钠、氯化镁(MgCl2)、抗坏血酸(VC)、三氯化铁(FeCl3)、过氧化氢(H2O2)、氯化钠(NaCl)、乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis (oxyethylenenitrilo) tetraacetic acid,EGTA)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、考马斯亮蓝R250、冰乙酸、甲醇、乙酸乙酯、盐酸胍、十二烷基硫酸钠等(均为分析纯)重庆市钛新化工有限公司。
1.2 仪器与设备
BSA323S型分析天平 德国赛多利斯科学仪器有限公司;Avanti J-30I型冷冻离心机 美国贝克曼库尔特公司;UV-16001型紫外-可见分光光度计 日本岛津仪器有限公司;XHF-D型内切式匀浆机 宁波新芝生物科技股份有限公司;Elix10型纯水机 美国密理博公司;Bio-Rad Protean II xi cell型电泳仪 美国Bio-Rad公司;S25型涡旋混合器 德国IKA集团;F-2500型荧光分光光度计 日本岛津公司。
1.3 方法
1.3.1 猪背部最长肌的准备
将冻存于-80 ℃下的1 cm×1 cm×1 cm的块状背部最长肌放在4 ℃下过夜解冻,然后用吸水纸轻轻擦拭,以去除肉块表面水分。
1.3.2 猪背部最长肌的氧化
猪背部最长肌的氧化参考Liu Zelong等[11]的方法并稍作修改,将背部最长肌与羟自由基生成体系的溶液以1∶4(m/V)混合。羟自由基生成体系溶液中FeCl3和VC的浓度分别为0.01 mmol/L和0.1 mmol/L,不同组别的H2O2浓度分别为0(对照组)、0.5、1、3、5、10、20 mmol/L。背部最长肌样品与自由基生成体系在4 ℃下反应24 h,在氧化过程中将混合物轻轻搅动。氧化处理后,通过添加1 mmol/L EDTA终止氧化反应,将背部最长肌用吸水纸轻轻擦干后测定离心损失率并提取MP和SP。
1.3.3 猪背部最长肌离心失水率的测定
离心失水率的测定参考Shen Xue等[12]的方法并略作修改,取10 g背部最长肌用吸水纸包裹,然后放入离心管中。在2 380×g下(4 ℃)离心10 min,按下式计算离心失水率。
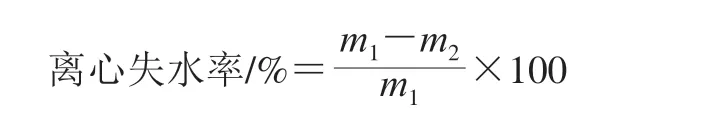
式中:m1表示离心前背部最长肌的质量/g;m2表示离心后背部最长肌的质量/g。
1.3.4 SP和MP的提取
SP和MP的提取参考Wang Zhaoming等[13]的方法并稍作修改,将10 g绞碎的背部最长肌与4 倍体积的0.01 mol/L的磷酸盐缓冲液(包含0.1 mol/L NaCl、0.001 mol/L EGTA、0.002 mol/L MgCl2,pH 7.0)混合,在7 000 r/min下均质1 min。然后在7 680×g下(4 ℃)离心15 min,离心后上清液即为SP。将离心后的沉淀重复上述操作2 次,然后于得到的沉淀中加入4 倍体积的0.1 mol/L的NaCl溶液,按上述操作参数重复两次均质和离心。最后一次离心前加入40 mL 0.02 mol/L的磷酸盐缓冲溶液(pH 6.0),在7 000 r/min下均质1 min,然后用4 层纱布过滤,得到的滤液在7 680×g下(4 ℃)离心15 min,最后得到的沉淀就是MP。
1.3.5 SP和MP相关性质分析
1.3.5.1 羰基含量的测定
参考Wang Zhaoming等[14]的方法,并略作修改。在5 mL离心管中加入0.8 mL质量浓度为5 mg/mL的蛋白,然后加入1.6 mL含有质量分数0.3% 2,4-二硝基苯肼的3 mol/L HCl,在室温下反应30 min,空白组中不添加2,4-二硝基苯肼。然后加入0.8 mL质量分数40%的三氯乙酸,摇匀后离心(7 680×g、4 ℃、5 min),弃上清液。沉淀用2 mL乙醇-乙酸乙酯(1∶1,V/V)溶液洗涤离心3 次,最后得到的沉淀用3 mL 6 mol/L的盐酸胍溶液溶解,在370 nm波长下测吸光度。根据摩尔消光系数(22 000(L/(mol·cm))计算羰基含量。
1.3.5.2 内源荧光光谱的测定
内源荧光光谱的测定参考Wang Zhaoming等[15]的方法,将SP和MP配制成0.5 mg/mL的溶液,用荧光分光光度计记录300~400 nm的荧光光谱。激发波长为295 nm,扫描速率为300 nm/min。
1.3.5.3 紫外吸收光谱的测定
紫外吸收光谱的测定参考Lü Liangtao等[16]的方法并稍作修改。将SP和MP配制成0.5 mg/mL的溶液,然后用紫外-可见分光光度计测定SP和MP溶液在230~320 nm波长处的紫外吸收光谱。
1.3.5.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)参考Gan Xiao等[17]的方法并稍作修改,将SP和MP配制成质量浓度2 mg/mL的溶液,然后,将SP和MP溶液与上样缓冲液按体积比1∶4的比例混匀,于沸水浴加热5 min。使用电泳仪进行电泳。制备质量分数5%的浓缩胶和10%分离胶。将20 μL上述样品混合物加到上样孔中。使用9~245 kDa的标准蛋白来确定分子质量。
1.3.5.5 Western-Blot法测定钙转运ATP酶和组织蛋白酶L表达量
Western-Blot实验参考Fu Qingquan等[18]的方法并稍作修改,配制质量分数10%的分离胶和4%的浓缩胶。上样量为50 μg,电泳电压为80 V,电泳液为甘氨酸缓冲液。电泳完成后,取出一张聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜置于3 层滤纸中间,放入转移槽中,加满转移液,80 V约1 h,转完后将膜自然晾干。用0.01 mol/L磷酸盐吐温缓冲液(phosphate buffered saline-Tween,PBST)洗涤5 min,然后转移至含封闭液的容器中,室温下封闭约4 h。然后用0.01 mol/L PBST洗涤3 次。加入稀释的I抗体,室温下3~4 h,用0.01 mol/L PBST洗涤3 次。加辣根过氧化物酶(herseradish peroxidase,HRP)标记的二抗,室温下1~2 h,用0.01 mol/L PBST洗涤3 次。将PVDF置于化学发光试剂中增强反应1~3 min,最后放入凝胶成像系统进行图像扫描分析。采用Image J图像分析软件对Western Blot条带进行灰度分析,将目标条带与内参条带灰度的比值作为目标蛋白的表达量。
1.3.6 背部最长肌微观结构的观察
微观结构的观察参考Zhang Dong等[19]的方法,将背部最长肌切成0.5 cm×0.5 cm×0.5 cm块状,并在4 ℃下于含有质量分数2.5%戊二醛的磷酸盐缓冲液(0.1 mol/L,pH 7.2)中固定24 h。将固定后的样品用磷酸盐缓冲液(0.1 mol/L,pH 7.2)洗涤3 次,并分别用30%、50%、70%、90%、100%乙醇溶液逐渐脱水(每个阶段1 h)。将样品用真空冷冻干燥机干燥,然后将干燥的样品切片喷金,并通过扫描电子显微镜观察微观结构。
1.4 数据统计分析
实验重复3 次,所有结果均以平均值±标准差的形式表示。运用SPSS 22.0软件对实验结果进行单因素方差分析(analysis of variance,ANOVA),用最小显著差异分析(least significant difference,LSD)进行显著性分析,并利用该软件进行指标间的皮尔逊相关性分析,绘图采用Origin 8.1软件。
2 结果与分析
2.1 体外氧化对猪背部最长肌离心损失率的影响
由图1可知,随着H2O2浓度的增加,猪背部最长肌的离心损失率呈现显著增加的趋势(P<0.05),这可能是由于氧化程度的增加导致肉的蛋白质氧化变性严重,进而影响肉的组织结构,导致结构松散,使得在外力作用下水分损失加剧。一般而言,肌纤维存储了许多水分,当氧化程度增加时,肌束和肌束膜间会出现明显的间隙,细胞排出的水可以储存在间隙中。但是间隙中储存的水分和肌肉结合不紧密,在离心作用下会被轻易排出,导致离心损失率的增加[20]。Xia Minquan等[21]在研究中发现,添加一定量的SP可以缩小MP凝胶中的空隙,使得游离水含量下降,结合水含量增加,进而提高蛋白凝胶保水能力。

图1 不同氧化程度对猪背部最长肌离心损失率的影响Fig. 1 Effects of different oxidation degrees on centrifugal loss of pork Longissimus dorsi
2.2 体外氧化对猪背部最长肌中蛋白羰基含量的影响
由图2可知,随着H2O2浓度的增加,SP和MP中的羰基含量均呈显著增加的趋势(P<0.05)。当H2O2浓度达到20 mmol/L时,SP和MP中的羰基含量均达到最大值,分别为1.51 nmol/mg和2.20 nmol/mg。这与Zhang Dong等[8]发现经不同浓度H2O2处理的MP羰基含量变化类似,其发现当H2O2浓度为20 mmol/L时,相比于对照组,H2O2处理组的MP羰基含量增加了近2 nmol/mg。Lu Han等[22]在研究中也发现,随着H2O2浓度的增加,鱼肉中MP的羰基含量从0.45 nmol/mg增加到1.30 nmol/mg。蛋白质羰基化合物的形成是由于在氧化应激条件下,蛋白质的侧链氨基酸被氧化,进而转为羰基衍生物[22]。此外,活性氧可以从氨基酸残基的α-C—H键提取氢原子,生成稳定的碳中心自由基,碳中心自由基可以继续与氧发生反应进而生成烷氧自由基,然后通过二酰胺、α-酰胺化途径发生裂解,导致蛋白质发生羰基化[15]。也有研究者指出活性氧会导致肽键破坏,引发肽段的裂解以及蛋白质骨架裂解,这也是导致蛋白质羰基化的机制[23]。
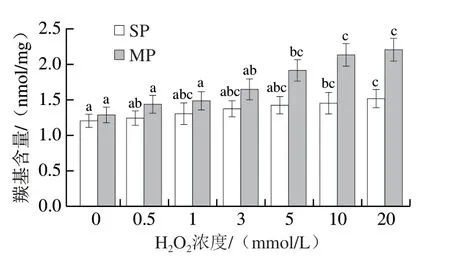
图2 不同氧化程度对猪背部最长肌中SP和MP羰基含量的影响Fig. 2 Effects of different oxidation degrees on the carbonyl contents of sarcoplasmic protein (SP) and myofibrillar protein (MP) in pork Longissimus dorsi
2.3 体外氧化对猪背部最长肌中蛋白内源荧光光谱的影响
蛋白中一些芳香族的氨基酸对氧化应激比较敏感,内源荧光光谱能够反映蛋白中色氨酸等具有荧光基团的氧化反应程度,因此可以表征蛋白质的结构及构象的变化[4]。由图3可知,不同处理组蛋白在波长335 nm附近出现了强荧光吸收峰。随着H2O2浓度的增加,SP和MP的荧光强度相比于对照组均呈下降的趋势。SP和MP的荧光强度在不同处理组中不同,这可能是SP和MP中的荧光基团含量不一样导致的。随着氧化强度的增加,两种蛋白的内源荧光强度呈下降趋势,这可能是由于随着氧化强度的增加,蛋白质的交联聚集加剧,使得色氨酸残基等荧光基团被包埋,引起蛋白荧光强度的下降[24]。也有研究者认为,在氧化应激条件下,隐藏的一些疏水残基,特别是色氨酸的吲哚侧链逐渐暴露在氧化环境中,荧光基团被攻击,最终导致荧光强度的降低[25]。因此,蛋白荧光强度的降低可能是色氨酸残基被活性氧攻击,导致蛋白交联聚集包埋了荧光基团。
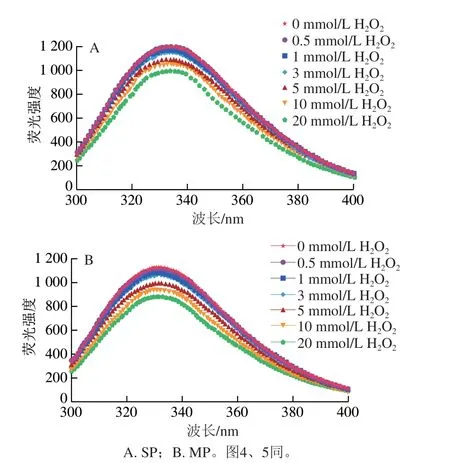
图3 不同氧化程度对猪背部最长肌中SP和MP内源荧光光谱的影响Fig. 3 Effects of different oxidation degrees on the endogenous fluorescence spectra of SP and MP in pork Longissimus dorsi
2.4 体外氧化对猪背部最长肌蛋白紫外光谱的影响
蛋白质紫外光谱可用于评估蛋白中芳香族氨基酸侧链的变化,进而反映蛋白构象的变化[26]。由图4可知,两种蛋白的紫外光谱中,特征吸收峰均出现在270 nm附近,这表明苯丙氨酸、酪氨酸以及色氨酸残基是猪背部最长肌蛋白中最主要的芳香族氨基酸残基[7]。随着H2O2浓度的增加,两种蛋白的紫外特征吸收峰强度均呈下降的趋势,这表明苯丙氨酸、酪氨酸以及色氨酸残基所处的微环境发生了明显变化。Wang Zhaoming等[25]指出氧化会导致蛋白的酪氨酸及色氨酸残基的微环境发生改变,进而导致紫外特征吸收峰强度下降。这一结果与蛋白荧光强度降低的结果一致。Lü Liangtao等[16]在研究中也指出蛋白表面的酪氨酸及色氨酸残基发生氧化修饰会导致蛋白的最大紫外特征吸收峰强度下降。
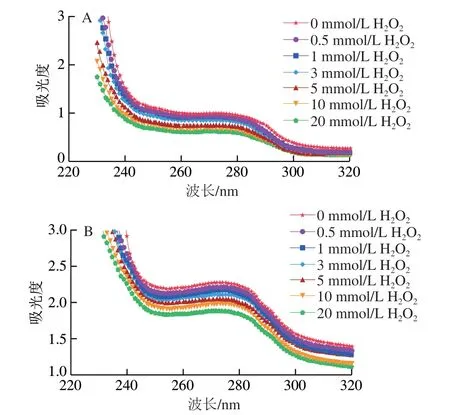
图4 不同氧化程度对猪背部最长肌中SP和MP紫外光谱的影响Fig. 4 Effects of different oxidation degrees on the UV absorption spectra of SP and MP in pork Longissimus dorsi
2.5 体外氧化对猪背部最长肌蛋白的SDS-PAGE图谱影响结果
采用SDS-PAGE在还原(+β-巯基乙醇(β-mercaptoethanol,β-ME))和非还原(-β-ME)条件下,研究了不同H2O2浓度对猪背部最长肌中SP和MP氧化降解的影响。如图5A1所示,与对照组相比,随着H2O2浓度的增加,SP中100、60、45 kDa附近的条带强度逐渐减弱,而在25~45 kDa之间出现新的条带,并且小分子条带强度随着氧化强度的增大而呈增加趋势。如图5A2所示,在β-ME存在的情况下,180、100、60、45 kDa附近的条带被还原。如图5B1所示,随着H2O2浓度的增加,MP中245 kDa附近的条带光密度呈现下降的趋势,而凝胶顶部积累的条带光密度呈上升的趋势。此外,随着H2O2浓度的增加,在35~45 kDa之间出现了新的条带。如图5B2所示,在β-ME存在的情况下,MP中消失的条带会被还原,但凝胶顶部仍有积累的条带,这说明除二硫键外还有其他的化学键参与了蛋白质的交联。这些结果表明随着H2O2浓度的增加,猪背部最长肌中SP和MP氧化降解加剧。有研究者指出,活性氧能从半胱氨酸S—H基团提取出氢原子,从而产生硫中心自由基,硫中心自由基可进一步和其他巯基反应生成二硫键,产生蛋白交联[23]。此外,蛋白中酪氨酸及色氨酸在氧化胁迫下可导致酪氨酸与酪氨酸、酪氨酸与色氨酸之间产生交联[27],进而导致蛋白质聚集体的产生。这一结果与氧化强度的增加导致蛋白内源荧光强度的降低一致。

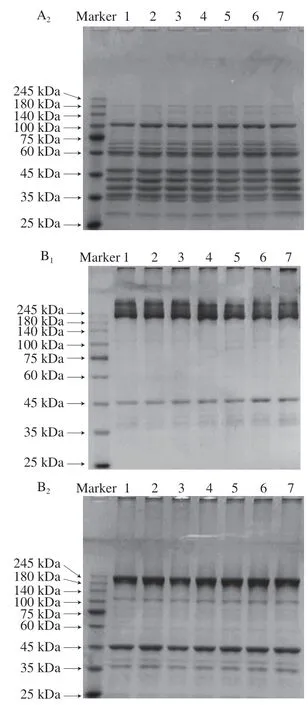
图5 H2O2对背部最长肌中SP和MP在还原和非还原条件下凝胶电泳图谱的影响Fig. 5 Effect of H2O2 on SDS-PAGE patterns of SP and MP in pork Longissimus dorsi under reducing and non-reducing conditions
2.6 体外氧化对猪背部最长肌中钙转运ATP酶表达量的影响
作为一种膜蛋白,钙转运ATP酶在细胞钙稳态及信号传导中起着非常重要的作用。如图6所示,与对照组相比,随着H2O2浓度的增加,猪背部最长肌中钙转运ATP酶的表达量呈现先下降后上升的趋势。但随着氧化强度的进一步增加(H2O2的浓度达到10 mmol/L和20 mmol/L),钙转运ATP酶的表达量无显著差异(P>0.05)。当氧化强度较低时,钙转运ATP酶表达量呈下降趋势可能是由于适当的氧化导致其消耗量增加;但在较低氧化强度下,细胞的稳态没有受到较大的影响,胞内外的钙离子转运处于相对稳定的状态,因此钙转运ATP酶表达量虽然下降,但变化不显著。当氧化强度继续增大时,胞内外的钙离子处于不平衡的状态,为了维持胞内钙离子处于较低水平,钙转运ATP酶被激活以促进将钙离子转运至肌质网,保护细胞免受破坏[28];因此,随着H2O2浓度继续增加,钙转运ATP酶的表达量整体呈现上升的趋势。
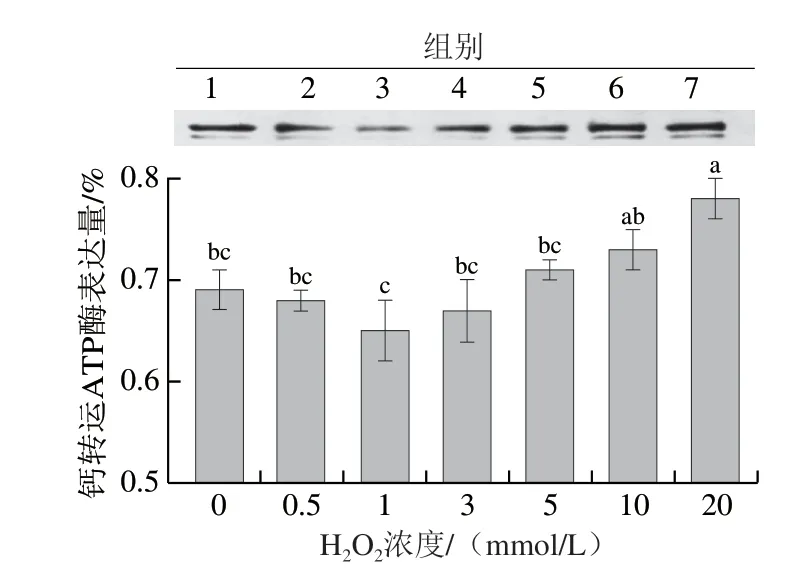
图6 不同氧化程度对猪背部最长肌中钙转运ATP酶表达量的影响Fig. 6 Effects of different oxidation degrees on the expression of calcium-transporting ATPase in pork Longissimus dorsi
2.7 体外氧化对猪背部最长肌中组织蛋白酶L表达量的影响
组织蛋白酶作为一类重要的蛋白酶,广泛存在于动植物及其他生物中[29]。有研究者指出组织蛋白酶L对肉品的嫩度和保水性具有一定影响[30]。组织蛋白酶L作为溶酶体中半胱氨酸蛋白酶的主要成员,其具有独特的合成及转运方式[31]。如图7所示,随着氧化强度的增加,组织蛋白酶L的表达量呈下降趋势,这可能是由于随着氧化强度的增加,组织蛋白酶L与其他蛋白酶发生水解反应,导致其含量下降。此外,氧化强度的增加可能导致溶酶体膜的稳定性下降,进而释放并激活较多的组织蛋白酶L,而激活的组织蛋白酶L又会参与蛋白质的降解,最终导致其含量的下降。张丽等[32]也指出,氧化会导致组织蛋白酶丧失活力。
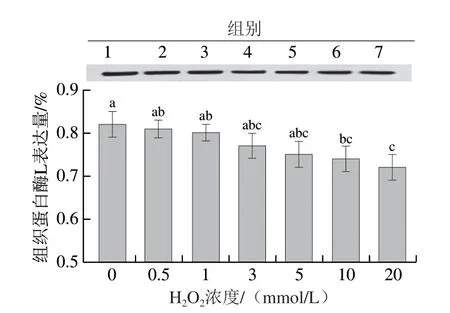
图7 不同氧化程度对猪背部最长肌中组织蛋白酶L表达量的影响Fig. 7 Effects of different oxidation degrees on the expression of cathepsin L in pork Longissimus dorsi
2.8 体外氧化对猪背部最长肌微观结构的影响
肉制品的组织结构与其品质特性如保水能力密切相关[33]。如图8A所示,当H2O2浓度较小时(<1 mmol/L),肌束纤维之间的间隙无明显差异,当H2O2浓度大于3 mmol/L时,肌束纤维之间的间隙增加,当H2O2浓度达到20 mmol/L,肌束纤维之间的间隙明显增大。这说明不同H2O2浓度对肌肉的纤维结构有不同的影响,高浓度的H2O2会导致肌肉纤维结构变得松散。如图8B所示,当H2O2浓度较小时(<1 mmol/L),肌肉的纤维束表面是光滑整齐的。随着H2O2浓度继续增加,纤维束表面开始变得粗糙,当H2O2浓度达到10 mmol/L和20 mmol/L时,一些纤维束的表面遭到严重破坏,甚至出现断裂的现象。这表明高浓度的H2O2会严重影响肌肉的纤维结构,导致纤维束的完整性遭到破坏。有研究者指出,氧化强度的增加导致肌肉组织结构间隙的增加是因为氧化导致了肌原纤维的收缩[11]。活性氧会导致肌纤维中的肌球蛋白和肌动蛋白发生氧化聚集,这一过程涉及到肌球蛋白内部及分子间的交联,以及肌丝内部和相互之间的交联。单个的肌原纤维和肌丝的聚集导致彼此之间间隙增加,累积起来最终导致纤维束之间的间隙显著增加[34]。

图8 不同氧化程度对猪背部最长肌微观结构的影响Fig. 8 Effects of different oxidation degrees on the microstructure of pork Longissimus dorsi
2.9 相关性分析和PCA结果
皮尔逊相关性分析(表1)与主成分分析(图9)被广泛用于评估变量之间的相关性。载荷图中载荷向量的距离和方向可以表征各个指标间的相关性。由表1可知,H2O2浓度与猪背部最长肌的离心损失率之间呈极显著正相关(r=0.759,P<0.01),与曹云刚等[35]得到的结果一致,表明H2O2浓度是影响猪背部最长肌保水性的重要因素。H2O2浓度与猪背部最长肌SP羰基含量(r=0.713,P<0.01)和MP羰基含量(r=0.842,P<0.01)均呈极显著正相关,与猪背部最长肌SP最大荧光强度(r=-0.952,P<0.01)和MP最大荧光强度(r=-0.945,P<0.01)均呈极显著负相关,与猪背部最长肌中的钙转运ATP酶表达量呈极显著正相关(r=0.853,P<0.01),而与组织蛋白L表达量呈极显著负相关(r=-0.738,P<0.01)。钙转运ATP酶和组织蛋白酶L与猪背部最长肌SP和MP的氧化指标具有较高的相关性,与离心损失率也具有较高的相关性。由图9可知,钙转运ATP酶表达量与猪背部最长肌SP和MP的蛋白质氧化指标(羰基含量)在右侧象限且彼此靠近,而组织蛋白酶L表达量与猪背部最长肌SP和MP的蛋白质氧化指标(荧光强度)在左象限且彼此靠近,表明钙转运ATP酶和组织蛋白酶L与蛋白质氧化之间具有潜在的联系。综上,情况表明H2O2浓度越高,猪背部最长肌的SP和MP的氧化降解越严重。此外,H2O2浓度越高,对猪背部最长肌中酶的表达调控影响也越大,酶的表达又会反作用于蛋白质,引起蛋白质的氧化降解。因此,在H2O2的氧化胁迫下,猪背部最长肌中的蛋白及酶活性发生变化,引起微观结构发生改变,进而导致保水能力下降。
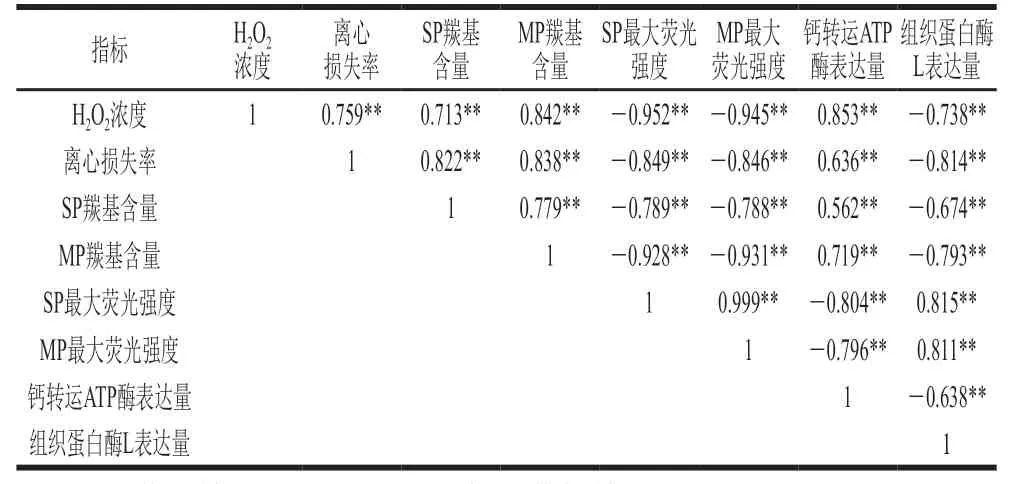
表1 各指标相关性分析Table1 Correlation analysis among all indicators tested
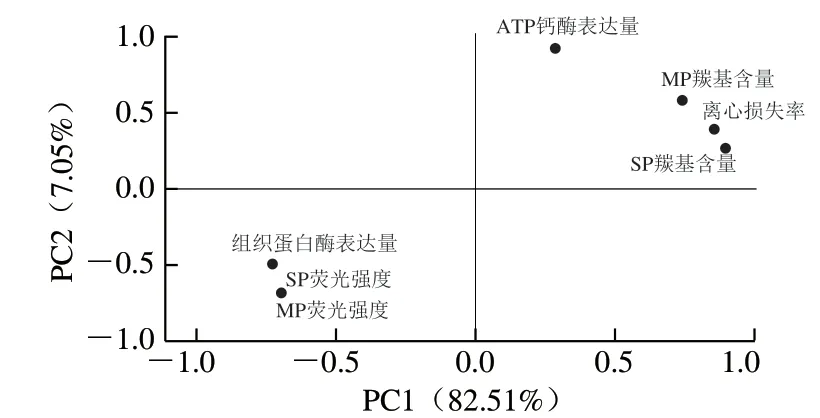
图9 前两个主成分各指标载荷图Fig. 9 PCA Loading plot of PC1 versus PC2
3 结 论
本研究主要探讨了氧化胁迫对猪背部最长肌内源酶及保水性的影响。结果表明,背部最长肌中SP和MP羰基含量随H2O2浓度的增大而升高。SP和MP最大荧光强度随H2O2浓度的增大而下降。H2O2浓度的增加会导致背部最长肌中蛋白质的氧化降解程度加剧,引起猪背部最长肌的离心失水率增加,特别是当H2O2浓度达到10 mmol/L和20 mmol/L时离心损失率与对照组相比显著增加。同时实验也证明了不同H2O2浓度的氧化胁迫下,猪背部最长肌中内源酶具有不同的表达量,而内源酶又会反作用于蛋白质,引起蛋白质的氧化降解。在氧化胁迫条件下,猪肉中的内源酶参与了蛋白质氧化降解的调控,最终影响猪肉的保水能力。
