不同外源物对亚麻籽油室温氧化自由基变化的影响
2021-10-31段虎平寇宇星温毓秀于修烛
段虎平,寇宇星,2,周 笙,温毓秀,高 媛,于修烛,
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.上海交通大学农业与生物学院,上海 200240)
亚麻籽油是一种兼具营养性和功能性的食用油,不饱和脂肪酸质量分数高达85%以上,其中α-亚麻酸在不饱和脂肪酸中的相对含量为40%~60%,其易发生氧化酸败[1-3]。油脂室温氧化过程中主要以不饱和脂肪酸的自动氧化为主,而自动氧化是典型的自由基链式反应[4-6]。在不饱和脂肪酸的自动氧化反应过程中,首先生成烷基自由基(R·),R·再与氧气反应产生烷过氧自由基(ROO·),ROO·会夺取其他不饱和脂肪酸分子中的氢,形成氢过氧化物(ROOH),ROOH易分解形成次级氧化产物(酮、醛、醇和酸等),最终导致油脂氧化酸败[6-8]。Yadav等[9]探究亚麻籽油氧化潜在机制,结果表明α-亚麻酸和亚油酸结构中含有的隔离双键(两个双键之间隔着一个亚甲基,即-CH=CH-CH2-CH=CH-)容易被两边的双键活化而非常活跃,引发自动氧化或光氧化。通过不同外源物可抑制或促进油脂氧化过程中自由基的生成。叔丁基对苯二酚(tert-butylhydroquinone,TBHQ)、VE等抗氧化剂[10-11],可提供氢原子(H·)与ROO·或烷氧自由基(RO·)反应,抑制链引发和链增长[12-14],延缓油脂氧化;偶氮二异庚腈(2,2’-azobisisoheptonitrile,ADVN)和叶绿素(chlorophyll,Chl)等促氧化剂可与氧反应生成自由基[15-18],加速油脂氧化。因此,在加工和贮藏过程中去除促氧化物质也是延缓油脂氧化的手段之一。
电子顺磁共振(electron paramagnetic resonance,EPR)是一种研究顺磁性物质中未成对电子特性的波谱方法[19]。目前,EPR方法已广泛应用于自由基的检测[20-22],油脂氧化过程中产生的自由基性质活泼且不稳定[23-27]。崔娜娜等[28]检测60 ℃烘箱法加速榛子油氧化过程中的自由基产生规律,结果表明:榛子油氧化0~25 d,自由基相对含量从8.41缓慢增加至12.96,氧化25 d后自由基相对含量急剧增加,氧化至40 d时自由基相对含量高达28.09。Xie Yunfei等[29]探究花生油氧化过程中自由基的变化,在90 ℃加速氧化过程中主要产生5,5-二甲基-1-吡咯啉-N-氧化物未知自由基(5,5-dimethyl-1-pyrrolineN-oxide-X radicals,DMPO-X)和RO·,120 ℃氧化时主要产生R·。李培等[30]探究花生油加速氧化过程中自由基链式反应,结果表明:加速氧化过程中产生大量的R·及少量RO·和ROO·。Raitio等[31]探究半固态棕榈油在50 ℃条件下贮存7 d的氧化情况,结果表明油脂贮存过程中次级过氧化物的形成量与自由基的产生量呈正相关。Skoutas等[32]使用DMPO检测和区分初榨橄榄油中的自由基,发现80%~90%为RO·和ROO·。综上,多数研究主要集中在利用EPR方法探究不同油脂加速氧化过程中自由基的变化,对油脂室温氧化过程中自由基变化研究报道较少。
核磁共振氢谱(1H nuclear magnetic resonance,1H NMR)能够提供化合物分子中所有氢原子结构的信息,据此可计算对应结构在样品中的含量并探讨油脂氧化过程[33-34]。本实验以不同抗氧化剂、促氧化剂和亚麻籽油为研究对象,利用EPR方法探究添加外源物对亚麻籽油室温氧化过程中自由基的影响,结合亚麻籽油1H NMR分析其氧化变化,以期为亚麻籽油氧化自由基产生规律的研究提供依据。
1 材料与方法
1.1 材料与试剂
DMPO、VE、TBHQ、ADVN 阿拉丁试剂(上海)有限公司;亚麻籽油(压榨一级,标签注明未添加任何抗氧化剂,脂肪酸组成相对含量为:亚麻酸(50.61±0.23)%、油酸(18.61±0.31)%、亚油酸(16.07±0.01)%、棕榈酸(5.76±0.12)%、硬脂酸(4.22±0.13)%) 锡林郭勒盟红井源油脂有限公司;甲苯、冰乙酸、碘化钾、硫代硫酸钠等(均为分析纯) 天津科密欧化学试剂有限公司。
DMPO溶液的配制:将DMPO溶于甲苯,配制成浓度为2.0 mol/L,置于棕色试剂瓶中,于-20 ℃冰箱中避光密封保存待用。
Chl提取液的制备:取5 g新鲜菠菜,去茎取叶,洗净剪碎,放入研钵中充分研磨,加入20 mL无水乙醇在50 ℃下超声30 min,超声功率为100 W。超声后离心(4 000 r/min、15 min)取上清液,用0.22 μm有机系滤膜过滤,得到Chl提取液。
1.2 仪器与设备
EMX plus-10/12电子自旋共振波谱仪 德国布鲁克Bruker公司;Bruker Avance III型核磁共振波谱仪 瑞士Bruker公司。
1.3 方法
1.3.1 亚麻籽油室温氧化
通过预实验,亚麻籽油在室温暴露于环境中氧化10 d后过氧化值(peroxide value,POV)已超过30 meq/kg,不符合国家标准(POV≤12 meq/kg)。分别取3 mL的亚麻籽油置于50 mL烧杯中,将其置于自然光室温和避光室温两种条件下贮藏氧化10 d。自然光室温条件下的亚麻籽油分为未添加外源物的对照组和添加外源物的实验组。外源物配制过程:分别精确称取0.02 g外源物(TBHQ、VE、ADVN和Chl提取液)溶于100 g的亚麻籽油中,超声3~4 min使外源物溶解,得到质量分数为0.02%外源物的亚麻籽油待测样品。
1.3.2 EPR分析
对室温贮藏样品每隔1 d各取200 μL加入核磁管中,再加入20 μL DMPO溶液混匀,5 min后将核磁管置于达到设定温度的EPR仪器谐振腔内进行测试。
EPR主要技术参数:磁场强度:磁极距72 mm时最大的磁场强度为1.45 T;扫场分辨率:128 000;微波频率:X-波段,9.2~9.8 GHz;灵敏度≤1.5×109spins/G线宽;液氮变温:100~700 K;液氦变温:1.8~300 K。测定条件:中心磁场为3 345.45 G;扫场宽度为100.00 G;扫场时间为20.0 s;微波功率为3.99 mW;调制幅度为1.000 G;转换时间为10.00 ms;加热温度:373.15 K。
1.3.31H NMR分析
取5 mL的亚麻籽油置于50 mL烧杯中,在室温(20±2)℃自然光下氧化10 d,取氧化前和氧化后的样品各50 μL于玻璃离心管中,加入含有0.03%四甲基硅烷(tetramethylsilane,TMS)的氘代氯仿(CDCl3)约0.5 mL,混合均匀,装入直径为5 mm的核磁管中待测。
1H NMR测定条件参考李添宝等[35]的方法并稍作修改,具体参数:500 MHz;BBO探头;1H NMR的观察频率为500.13 MHz;1H分辨率为0.45 Hz。每次测定均进行匀场、调谐;脉冲序列:zg30;谱宽:10 330.6 Hz;扫描16 次;空扫2 次;每个样品测量3 次;谱图处理时以四甲基硅烷定位。
1.3.4 过氧化值测定
POV参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》中的滴定法测定。
1.3.5 相关谱图分析
EPR谱图:自由基的自旋朗德因子(g因子也称g值)为自由基谱图中心点,首先,通过EPR仪器自带的Xenon软件点击谱图中心点可直接读出g值,实验中拟合到的自由基g值均为2.006。其次,对样品的自由基谱图进行基线校正,接着进行二次积分,再使用自旋定量功能,可得到该样品的自旋总数和自旋浓度。通过Xenon软件中的自旋拟合功能对样品的实验谱图进行计算机拟合,得到各自由基加合物的超精细耦合常数,进而确定自由基的种类,根据拟合谱图中不同自由基的峰面积对其定量。1H NMR谱图使用Topspin3.5软件进行处理,谱图经校正零点后标峰,并读出峰面积。
1.4 数据统计与分析
所有实验均设置3 次平行,数据结果用平均值±标准差表示。采用SPSS 20.0软件进行数据分析,采用Origin 8.5软件绘图。
2 结果与分析
2.1 亚麻籽油室温氧化过程中自由基变化分析
2.1.1 亚麻籽油室温氧化过程中自由基种类变化
亚麻籽油室温氧化过程中的EPR实验谱图、拟合谱图及各自由基自旋数的变化分别见图1A、B,亚麻籽油的EPR谱图经拟合得到4 种自由基加合物:烷基自由基加合物(alkyl radical adducts,ARA)、烷氧自由基加合物(alkoxyl radical adducts,AORA)、烷过氧自由基加合物(alkyl peroxyl radical adducts,APRA)以及DMPO-X,其通常被认为是DMPO氧化后产生的自由基。
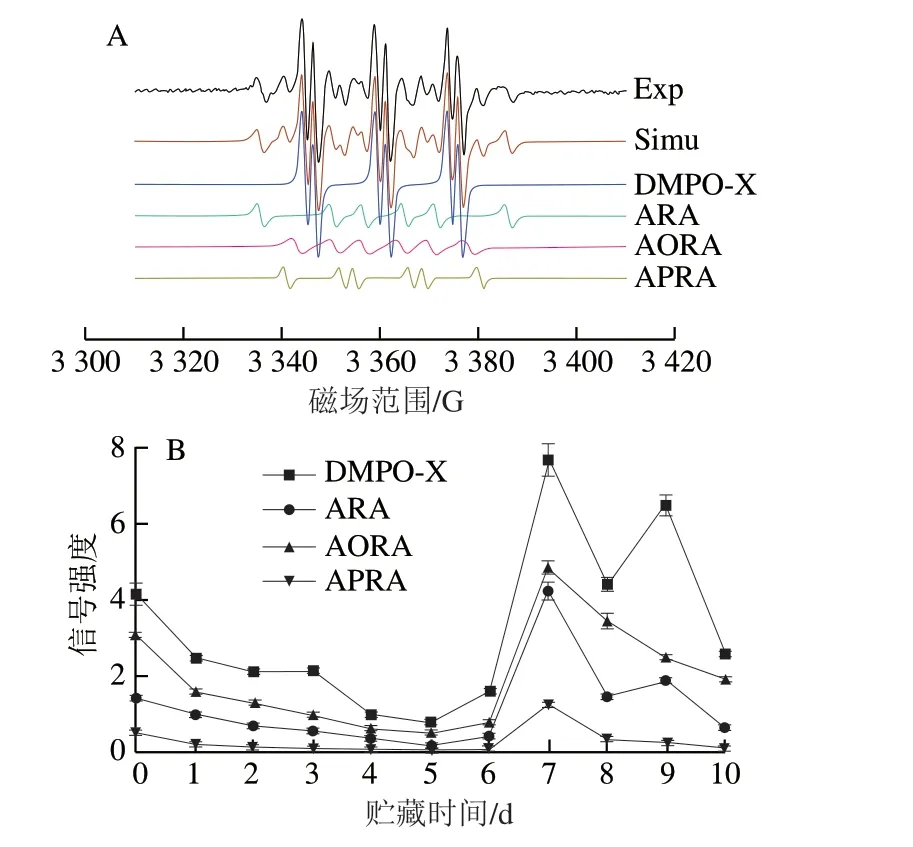
图1 亚麻籽油的EPR实验谱图、拟合谱图(A)及其各自由基自旋数的变化(B)Fig. 1 Experimental and simulated EPR spectra (A) and change in the number of spins in free radicals of linseed oil (B)
由图1A可知,亚麻籽油的EPR实验谱图与拟合谱图基本一致,拟合效果良好。从拟合结果可以看出,亚麻籽油中存在4 种自由基,它们分别是DMPO-X、R·、RO·和ROO·,其各自的超精细耦合常数如表1所示。由图1B可知,亚麻籽油中含量最高的自由基是DMPO-X,RO·次之,R·和ROO·含量最低,在氧化至第6天时,4 种自由基含量呈明显上升趋势,这可能是处于自由基链式反应的分裂阶段,氢过氧化物分解产生较多的自由基,第7天后逐渐下降。
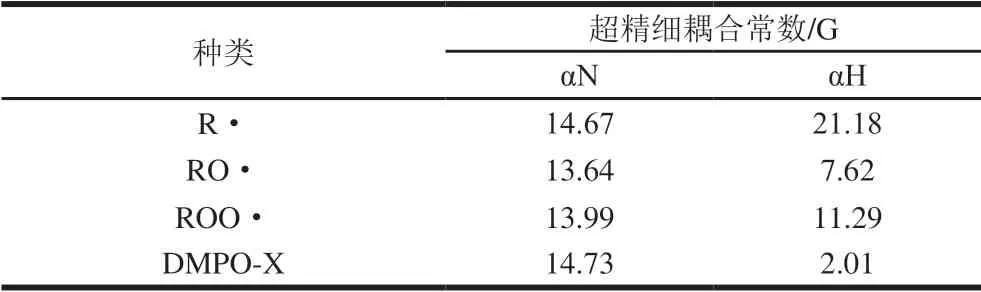
表1 亚麻籽油中DMPO捕获的自由基EPR参数Table1 EPR parameters of trapped radicals by DMPO in linseed oil
2.1.2 亚麻籽油室温氧化前后的1H NMR变化
亚麻籽油氧化前和室温氧化10 d后的1H NMR谱图分别见图2A和图2B。亚麻籽油中最主要的脂肪酸是亚麻酸,δ0.96归属为亚麻酸末端-CH3上的H,δ1.29归属为-CH2上的H(脂肪族亚甲基氢),δ1.60归属为与-C=O相隔1 个-CH2的亚甲基上的H,δ2.02归属为与-C=C双键相邻的亚甲基上的H(烯丙基氢),δ2.25归属为和-C=O直接相连的亚甲基上的H,δ2.78归属为位于两个-C=C-双键之间的亚甲基上的H(双烯丙基氢),δ4.15和δ4.3归属于甘油三酯中甘油醇上亚甲基的2 个H,δ5.28为甘油醇次甲基上的H,δ5.32归属为所有脂肪酸中双键上的H,δ7.26属于溶剂CDCl3[35]。由图2A和图2B可知,氧化前后亚麻籽油中各图谱没有发生明显变化,仅数量略有变化。对比氧化前后谱图上各峰的面积积分可知,氧化后的亚麻籽油中双烯丙基氢质子和烯丙基氢质子的数量降低,表明RH氧化前期被引发生成R·和H·;而双键上的氢及亚麻酸末端甲基上的氢质子数量均降低,表明H·与活跃的ROO·结合生成ROOH后,随着ROOH的积累,其中一部分ROOH 发生分解和聚合反应生成醛、酮、醇和酸等小分子,这与亚麻籽油的EPR谱图相吻合,ROO·随着氧化的进行发生分解,导致其含量相对较低。
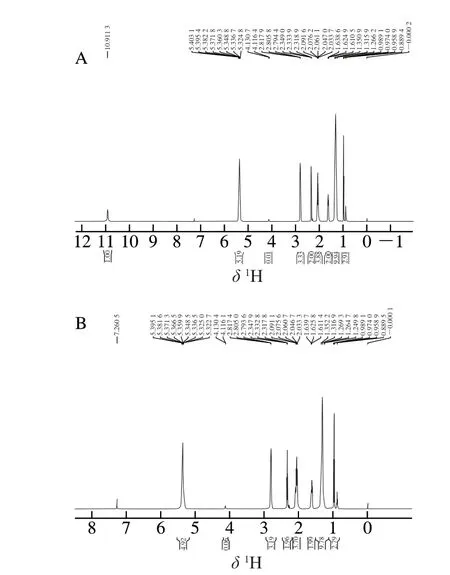
图2 亚麻籽油氧化前(A)和室温氧化10 d后(B)的1H NMR谱图Fig. 2 1H NMR spectra of linseed oil before (A) and after 10 d oxidation at room temperature (B)
2.2 不同外源物对亚麻籽油室温氧化过程中自由基变化的影响
2.2.1 不同外源物对亚麻籽油室温氧化过程中POV变化的影响
由图3可知,添加不同外源物对亚麻籽油的氧化有不同程度的影响,避光及添加TBHQ可有效减缓亚麻籽油的氧化,添加ADVN对亚麻籽油的POV影响很小,而Chl则会促进亚麻籽油的氧化。VE对亚麻籽油的影响具有两面性,在氧化前期由于其具有强还原性,贮藏第1天添加VE的亚麻籽油样品中POV低于其他样品,而在氧化中后期,VE消耗到一定程度后加速其氧化,且氧化速率高于其他处理组。
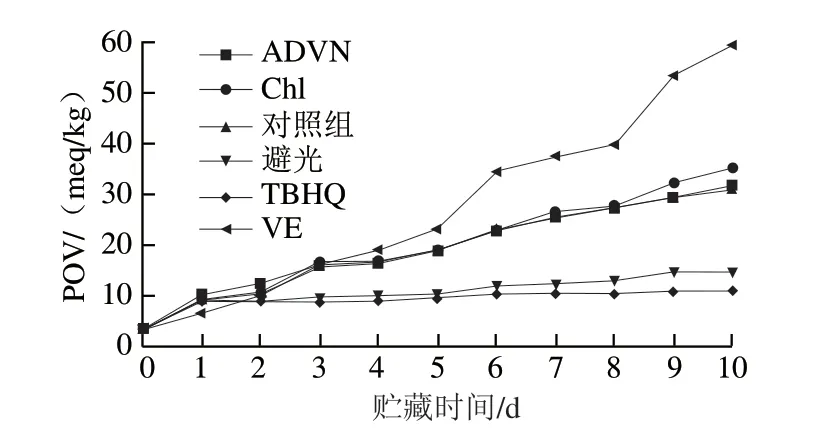
图3 添加不同外源物的亚麻籽油室温氧化过程中POV的变化Fig. 3 Changes in peroxide value of linseed oil added with various exogenous substances during the oxidation process at room temperature
2.2.2 不同外源物对亚麻籽油室温氧化过程中各自由基自旋总数变化的影响
不同外源物对亚麻籽油室温氧化过程中各自由基自旋总数变化的影响见图4。添加不同外源物的亚麻籽油在室温氧化过程自旋总数一直处于波动状态,避光贮存的亚麻籽油的自旋总数相对较高,可能是由于亚麻籽油中最主要的脂肪酸是亚麻酸,在避光条件下引发的自由基不活泼,短时间内不易转化为氧化产物,导致DMPO捕获到的自由基含量偏多[36],因此检测得到的自旋总数相对较高。而其他条件下亚麻籽油在氧化前期自旋总数低,氧化后期略有升高,这可能是在光照的影响下,DMPO捕获的自由基快速转化成油脂氧化的非自由基产物,如次级产物醛、酮、醇和酸等小分子物质,导致整个氧化过程自旋总数偏低。加入TBHQ的亚麻籽油整体自旋总数都处于较低水平,这可能是TBHQ作为抗氧化剂,可有效减少RO·和ROO·的含量,一定程度上阻断了自由基链式反应,从而起到抗氧化作用。加入VE的亚麻籽油在氧化前期自旋总数较低,氧化后期自旋总数大幅升高,这可能是由于VE消耗后的产物引发了某种自由基的生成,进而促进了亚麻籽油氧化。ADVN作为自由基引发剂,加入后使体系中自旋总数不断升高。Chl刚加入亚麻籽油中即引发大量自由基的生成,使得初始自旋总数较高,这主要是由于Chl是光敏性物质,作为促氧化剂可加速亚麻籽油氧化,产生大量自由基,随氧化时间的延长,自由基含量则维持在较低水平。
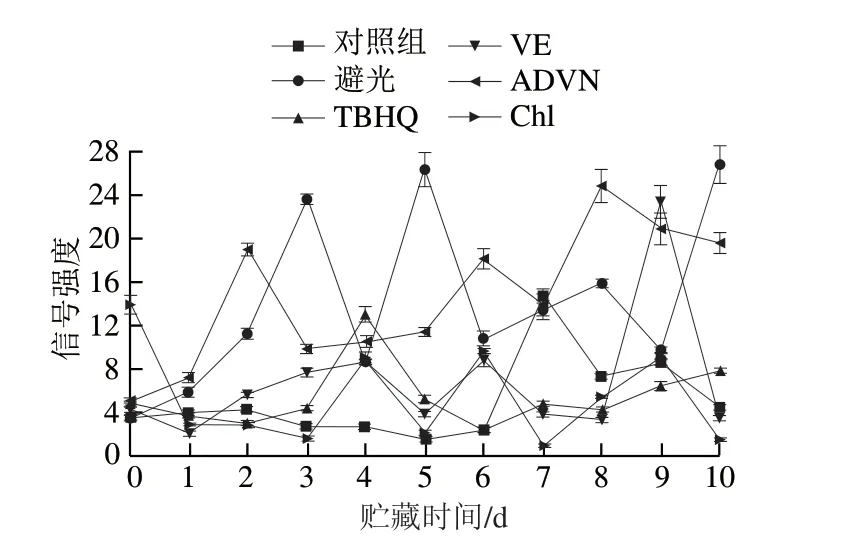
图4 添加不同外源物的亚麻籽油各自由基自旋总数随贮藏时间的变化Fig. 4 Changes in the number of spins in free radicals of linseed oil added with various exogenous substances over time
2.2.3 亚麻籽油室温避光氧化过程中自由基变化分析
亚麻籽油室温避光氧化的EPR实验谱图、拟合谱图及各自由基自旋数的变化分别见图5A、B。由图5A可知,亚麻籽油在避光氧化时主要形成4 种自由基,分别是DMPO-X、R·、RO·、ROO·,与自然光照下相一致。由图1B可以看出,在不同的氧化条件下,这4 种自由基的含量有明显区别。自然光下氧化的亚麻籽油中自由基含量排序为DMPO-X>RO·>R·>ROO·,由图5B可知,避光氧化的亚麻籽油中自由基含量排序为RO·>DMPO-X>R·>ROO·,这可能是由于避光氧化时,DMPO捕获的自由基不活泼,生成的自由基加合物未发生裂解反应,导致避光时自由基含量比自然光下高。据此推断,自然光利于DMPO-X的产生,而避光利于RO·的产生。
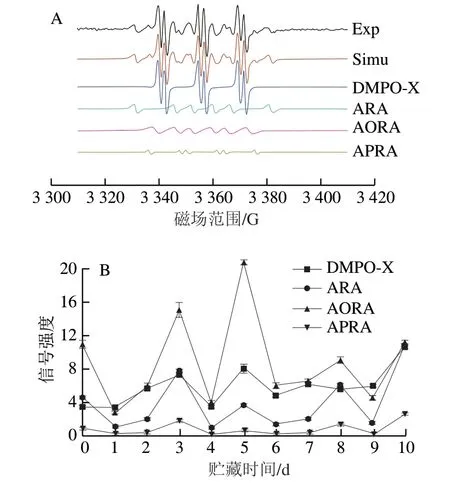
图5 室温避光氧化的亚麻籽油的EPR实验谱图、拟合谱图(A)及各自由基自旋数的变化(B)Fig. 5 Experimental and simulated EPR spectra (A) and change in the number of spins in free radical of oxidized linseed oil at room temperature and in darkness (B)
2.2.4 不同外源物对亚麻籽油室温氧化过程中自由基变化的影响
亚麻籽油室温氧化过程中添加VE、Chl、ADVN和TBHQ的EPR实验谱图、拟合谱图及各自由基自旋数的变化分别见图6A~G。

图6 不同外源物的亚麻籽油的EPR实验谱图、拟合谱图及各自由基自旋数的变化Fig. 6 Experimental and simulated EPR spectra and change in the number of spins in free radicals of linseed oil added with various exogenous substances

由图6A、B可知,添加VE的亚麻籽油中自由基含量排序为DMPO-X>RO·>R·>ROO·,VE作为抗氧化剂加入亚麻籽油减缓了自由基链式反应的进行,在氧化后期样品中自旋总数急剧升高,主要依赖于DMPO-X的含量升高。由图6C、D可知,添加Chl的亚麻籽油在氧化初期自旋总数高,可能的原因是,Chl的加入引发了RO·和ROO·大量生成,随着氧化时间的延长,RO·和ROO·回到初始水平,而DMPO-X的含量大幅升高。由图6E、F可知,添加ADVN的亚麻籽油在氧化初期与添加Chl的亚麻籽油自由基变化趋势基本一致,自旋总数高,不同的是,在氧化初期本组样品中仅产生3 种自由基,分别是DMPO-X、无机碳中心自由基和R·,在整个氧化过程中DMPO-X的信号强度一直保持在较高水平,无机碳中心自由基次之。氧化中期体系中开始生成ROO·,氧化后期开始生成RO·。当样品处于快速氧化期间时,RO·一旦产生则很快参与自由基链式反应而生成其他中间产物,导致其含量低,达不到仪器检测限。因此,该组样品氧化至第8天时开始出现RO·,ROO·的变化与RO·类似。由图6G可知,添加TBHQ的亚麻籽油的EPR谱图信号过低,不同的自由基之间谱带重叠多,难以解析,这主要是由于TBHQ作为抗氧化剂阻断了自由基链式反应的进行。
3 结 论
在亚麻籽油室温氧化过程中,RO·的产生和分解与氧化程度直接相关。不同外源物主要影响亚麻籽油室温氧化过程中各自由基含量变化,而对自由基的种类变化影响不大。亚麻籽油在室温自然光,避光,室温自然光添加TBHQ、VE和Chl氧化过程中产生的自由基种类为DMPO-X、R·、RO·和ROO·,添加ADVN会引发无机碳中心自由基。自然光条件下产生的自由基以DMPO-X为主;避光条件下的自旋总数整体上高于其他组,以RO·为主;添加TBHQ可有效减少RO·和ROO·的含量,自旋总数都处于较低水平;添加VE后,在氧化前期自旋总数较低,后期大幅升高,可延迟DMPO-X最高信号强度的出现时间,且对R·生成也有显著抑制作用;添加Chl后,在氧化前期大量生成RO·和ROO·,可抑制DMPO-X的生成,后期对RO·的生成有一定的抑制,而DMPO-X的含量大幅升高;ADVN添加组在氧化初期仅产生3 种自由基,分别是DMPO-X、无机碳中心自由基和R·,氧化过程中DMPO-X保持较高水平,氧化中期产生ROO·,后期产生RO·。
