宰后N-硝基-L-精氨酸甲酯盐酸盐处理对藏羊肉品质的影响
2021-10-31张攀高师希雄李雪茹
张攀高,师希雄,田 铸,陈 骋,韩 玲,李雪茹
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
藏羊又称藏系绵羊,是我国三大粗毛羊品种之一,原产于青藏高原,主要分布于我国西藏、青海和甘肃等海拔3 000 m以上的高寒缺氧地区[1]。甘肃省的藏羊主要分布在甘南藏族自治州以及张掖市肃南裕固族自治县等地区[2]。甘南藏族自治州的藏羊有甘加、欧拉、乔科3 种类型,其中,欧拉藏羊作为藏系绵羊的一种,其羊肉具有高蛋白、低脂肪、矿物质含量丰富、维生素和氨基酸含量高的特点[3],但其嫩度较低,口感较差,生鲜肉的品质不稳定,从而影响了欧拉藏羊产业的发展。因此,有必要研究生鲜肉品质形成的影响因素,以便为改善肉品质提供理论依据。影响生鲜肉品质的因素包括宰前因素和宰后因素,其中,宰后因素主要包括成熟和宰后处理。肉成熟的本质是宰后肌肉中发生一系列生理生化代谢的总和,宰后肌细胞重要的生化代谢可一定程度上解释生鲜肉品质变化的差异性[4]。然而,目前对于宰后肌细胞的生化代谢有待深入研究,肉的成熟机理尚不明确。
宰后肌肉细胞中由一氧化氮合成酶(nitric oxide synthase,NOS)催化精氨酸向瓜氨酸代谢产生NO,NO与蛋白质半胱氨酸巯基的共价结合会使蛋白质发生亚硝基化,蛋白质的亚硝基化可改变蛋白质的结构和功能[5]。此外,NO还可与超氧化物产生过氧亚硝酸盐,该物质是蛋白质的强氧化剂。因此,NO可影响宰后肉品质的形成[6]。目前,国内外已有学者研究了NOS抑制剂对宰后肉品质的影响。Cottrell等[7]研究发现,宰前注射NOS抑制剂可显著降低绵羊腰大肌的剪切力与pH值,对肉色无显著影响。刘瑞[4]也报道,宰后猪肉经NOS抑制剂(N-硝基-L-精氨酸甲酯盐酸盐(N-nitro-Larginine methyl ester hydrochloride,L-NAME))浸泡后pH值降低。Hou Qin等[8]发现NOS抑制剂处理可提高牛肉半膜肌嫩度。Zhang Chaoyang等[9]的研究表明,NO可调节宰后成熟过程中肌肉蛋白酶水解活性,NOS抑制剂(L-NAME)处理可促进牛肉肌间线蛋白和肌钙蛋白-T的降解,有利于牛肉的嫩化。然而,Cottrell等[10]报道,山羊宰前注射L-NAME抑制了半膜肌中的蛋白水解,降低了嫩度。Liu Rui等[11]也发现,NO被认为是钙蛋白酶1的调节因子,可抑制猪骨骼肌中细胞骨架结构的蛋白水解,不利于肉的嫩化。Zhang Wangang等[12]的研究表明,宰后初期NOS抑制剂组的肉样中羰基含量显著低于对照组和NO增强剂组,在冷藏过程中,NOS抑制剂组的鸡胸肉具有更高的L*值和更低的a*值,但b*值在宰后成熟过程中无显著变化。Li Yupin等[13]也发现,经NO供体处理后的猪肉,羰基含量显著上升,蛋白氧化水平明显升高。
综上所述,关于NOS抑制剂对宰后肉品质的研究主要以鸡肉、猪肉、牛肉、山羊肉为主,而且结论不一致。目前,关于NOS抑制剂如何影响宰后藏羊肉品质鲜见文献报道。因此,本实验以甘南欧拉藏羊后腿肉为实验材料,分别采用30、60、90 mmol/L的L-NAME处理肉样(以去离子水浸泡作为对照)。在4 ℃条件进行成熟,测定成熟期间(0、1、3、5、7 d)NOS活力、NO含量并分析总巯基含量、羰基含量、肌原纤维小片化指数(myoifbril fragmentation index,MFI)以及pH值、肉色等指标的变化,研究NOS抑制剂对宰后藏羊肉品质的影响,为宰后藏羊肉品质改善提供理论依据。
1 材料与方法
1.1 材料与试剂
4~5 岁的欧拉藏羊6 只,体质量相近,生理成熟度等指标基本相似,选自甘肃安多清真绿色食品有限公司。宰前保证藏羊健康状况良好,跟腱吊挂,从半胴体上取下后腿肉作为实验材料。
L-NAME 美国Sigma公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、2,4-二硝基苯肼(2,4-dinitrophenyl-hydrazin,DNPH) 天津市光复科科技发展有限公司;乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol bis(2-aminoethyl)tetraacetic acid,EGTA) 上海中秦化学试剂有限公司;天津市光复精细化工研究所;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid), DTNB) 北京拜尔迪生物公司;盐酸胍、尿素 天津市科密欧化学试剂有限公司;NOS、NO检测试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
FSH-2A型可调高速匀浆机 江苏省金坛市友联仪器研究所;HH-2型电热恒温水浴锅 西安科昊生物工程有限责任公司;雷磁PHS-25型pH计 上海仪电科学仪器股份有限公司;TGL-16MC型台式高速冷冻离心机 湖南湘仪集团;CR-10型色差仪 日本柯尼卡美能达公司;DW-86L828型海尔超低温冰箱 青岛海尔特种电器有限公司;SP-756P型紫外-可见分光光度计 上海美谱达仪器有限公司;HX202T型电子天平 慈溪市天东衡器厂。
1.3 方法
1.3.1 样品的制备
选取4~5 岁藏羊后腿肉,剔去筋膜、脂肪等后,切成大小均匀的薄片(8 cm×8 cm×0.5 cm),用20 G穿刺针均匀穿刺,分别用去离子水(对照组)和30、60、90 mmol/L的L-NAME(处理组)溶液将肉样以料液比1∶1进行浸泡,在4 ℃下浸泡1 d后,用滤纸轻轻按压吸干肉块表面水分,在4 ℃条件下进行成熟,在不同成熟时间点(0、1、3、5、7 d)分别采样。现场测定pH值和色泽,其余样品在-80 ℃条件下贮存,用于测定NO含量、NOS活力、总巯基含量、羰基含量及MFI。
1.3.2 NOS活力和NO含量测定
NOS活力和NO含量使用NOS活力和NO含量试剂盒进行测定,结果以蛋白质量计。
1.3.3 pH值的测定
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[14]的方法进行测定。
1.3.4 色泽测定
采用CR-10型色差仪测定样品的L*、a*、b*值,先将仪器预热30 min后用校正板校准,光源为D65,视角为2°,样品测定3 个平行[15]。
1.3.5 MFI的测定
参考Wang Linlin等[16]的方法并略作修改。称取2 g肉样(剔除筋膜),加入20 mL的MFI缓冲液(100 mmol/L KCl、20 mmol/L Na3PO4、1 mmol/L EDTA、1 mmol/L MgCl2、1 mmol/L NaN3,pH 7.1),肉样冰浴匀浆30 s后,于4 ℃、1 000×g下离心15 min,弃去上清液,再次加入20 mL MFI缓冲液使沉淀重新处于悬浊态,再于4 ℃、1 000×g下离心15 min,弃去上清液。再用5 倍体积的MFI缓冲液重悬沉淀,并通过200 目尼龙过滤器过滤悬浮液。再用上述沉淀5 倍体积的MFI缓冲液冲洗过滤器。用双缩脲法测定所得悬浊液中蛋白含量。用MFI缓冲液调节肌原纤维悬浮液中蛋白质量浓度为0.5 mg/mL,于540 nm波长处测定吸光度,将所得结果乘以200后即为MFI。
1.3.6 羰基、总巯基含量测定
1.3.6.1 肌原纤维蛋白的提取
肌原纤维蛋白的提取参考Park等[17]的方法并略作修改。准确称取2 g肉样,加入4 倍体积标准盐溶液(10 mmol/L磷酸钾缓冲液、0.1 mol/L KCl、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7.0),13 000 r/min匀浆10 s,4 ℃、2 000×g下离心15 min,弃去上清液,用4 倍体积的标准盐溶液溶解沉淀后,4 ℃、2 000×g下离心15 min,弃上清液,重复2 次;沉淀再用4 倍体积的0.1 mol/L KCl溶液以上述条件洗涤2 次之后,经单层纱布过滤以去除残留结缔组织等,于4 ℃离心15 min(1 250×g)后弃上清液,所得膏状沉淀即为肌原纤维蛋白。沉淀用4 倍体积的0.1 mol/L KCl溶液溶解后,用双缩脉法测定蛋白含量,用牛血清白蛋白作标准曲线。
1.3.6.2 羰基含量测定
羰基含量参考Wang Huihui等[18]的方法进行测定。使用DNPH法测定羰基含量。稀释后的肌原纤维蛋白样品(5 mg/mL)中加入2 mL含质量分数2% DNPH的HCl溶液(2 mol/L),37 ℃避光条件下水浴60 min(每15 min涡流振荡一次)。测定370 nm波长处的吸光度,根据摩尔吸光系数2 200 L/(mol·cm)计算羰基含量。
1.3.6.3 总巯基含量测定
巯基含量参考Wang Huihui等[18]的方法进行测定。用25 mmol/L磷酸钠缓冲液(pH 6.25)将肌原纤维蛋白样品稀释至2 mg/mL。取0.5 mL蛋白悬液于2.0 mL尿素-十二烷基硫酸钠溶液(8.0 mol/L尿素、30 g/L十二烷基硫酸钠、0.1 mol/L磷酸钠缓冲液,pH 7.4)和0.5 mL 10 mmol/L DTNB试剂(溶解在0.1 mol/L磷酸钠缓冲液中,pH 7.4)。室温孵育15 min后,在412 nm波长处测定其吸光度。总巯基含量按摩尔吸光系数13 600 L/(mol·cm)计算。
1.4 数据处理与分析
所有实验均重复3 次,数据均采用Excel 2013软件进行处理,结果用平均值±标准差表示,采用Orign 2017软件作图,采用SPSS 22.0软件进行单因素方差分析,采用Duncan’s进行多重差异显著性分析(以P<0.05表示差异显著)。
2 结果与分析
2.1 宰后藏羊肉NOS活力及NO含量的变化
由图1可知,对照组与各处理组中NOS活力、NO含量均随宰后时间的延长总体呈现下降趋势,L-NAME处理组的NOS活力及NO含量均低于对照组。成熟7 d时,30、60、90 mmol/LL-NAME处理组的NOS活力分别比对照组低29.5%、38.2%、41.3%(P<0.05),但不同处理组之间差异不显著;不同处理组的NO含量分别比对照组低35.6%、29.6%、66.9%(P<0.05),30 mmol/L与60 mmol/LL-NAME处理组的NO含量差异不显著,但显著高于90 mmol/LL-NAME处理组的NO含量。可见,采用NOS抑制剂处理欧拉藏羊肉后,NOS活力、NO含量均降低。
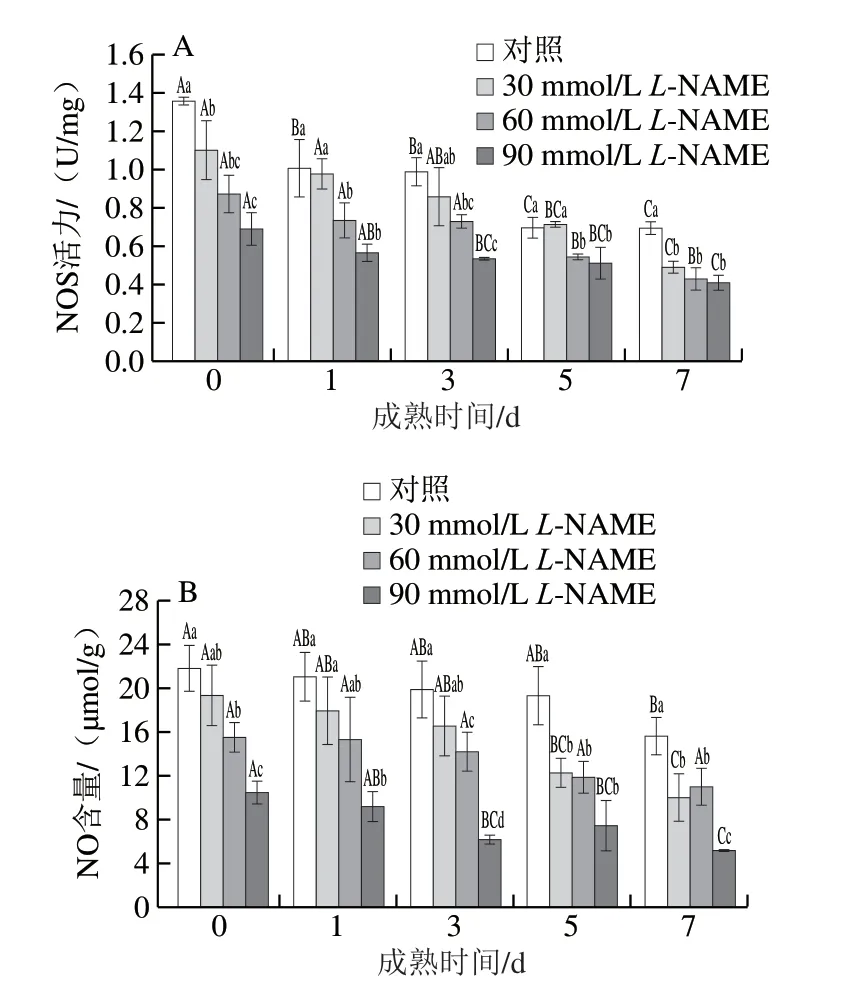
图1 不同浓度NOS抑制剂处理对藏羊肉NOS活力(A)、NO含量(B)的影响Fig. 1 Effects of different concentrations of NOS inhibitor on the contents of NOS (A) and NO (B) in Tibetan sheep meat
2.2 NOS抑制剂处理对宰后藏羊肉pH值的影响
由图2可知,对照组与处理组的pH值随宰后时间的延长总体呈现显著下降趋势(P<0.05)。不同成熟时间下与对照组相比,30、60、90 mmol/LL-NAME处理组的pH值均显著降低(P<0.05),且随L-NAME浓度的增大pH值显著减小(P<0.05)。处理后成熟7 d时,30、60、90 mmol/LL-NAME处理组的pH值分别比对照组低7.3%、12.7%、14.7%(P<0.05)。由此可见,NOS抑制剂处理欧拉藏羊肉后,pH值显著降低。
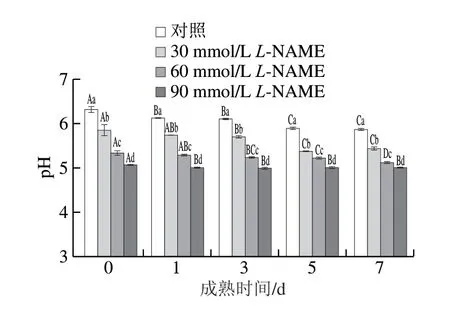
图2 不同浓度NOS抑制剂处理对藏羊肉pH值的影响Fig. 2 Effects of different concentrations of NOS inhibitor on pH of Tibetan sheep meat
2.3 NOS抑制剂处理对宰后藏羊肉色泽的影响
表1反映了L-NAME处理对藏羊肉肉色的影响,对照组与NOS抑制剂处理组的肉色L*、a*、b*值随宰后成熟时间的变化趋势不一致,但处理后成熟7 d时,30、60、90 mmol/LL-NAME处理组的肉色L*值分别比对照组高4.4%、9.1%、7.9%(P<0.05),a*值分别比对照组低7.8%、24.9%、39.8%(P<0.05),b*值与对照组差异不显著。由此可见,采用L-NAME处理后,欧拉藏羊肉的肉色L*值显著提高,a*值显著降低。
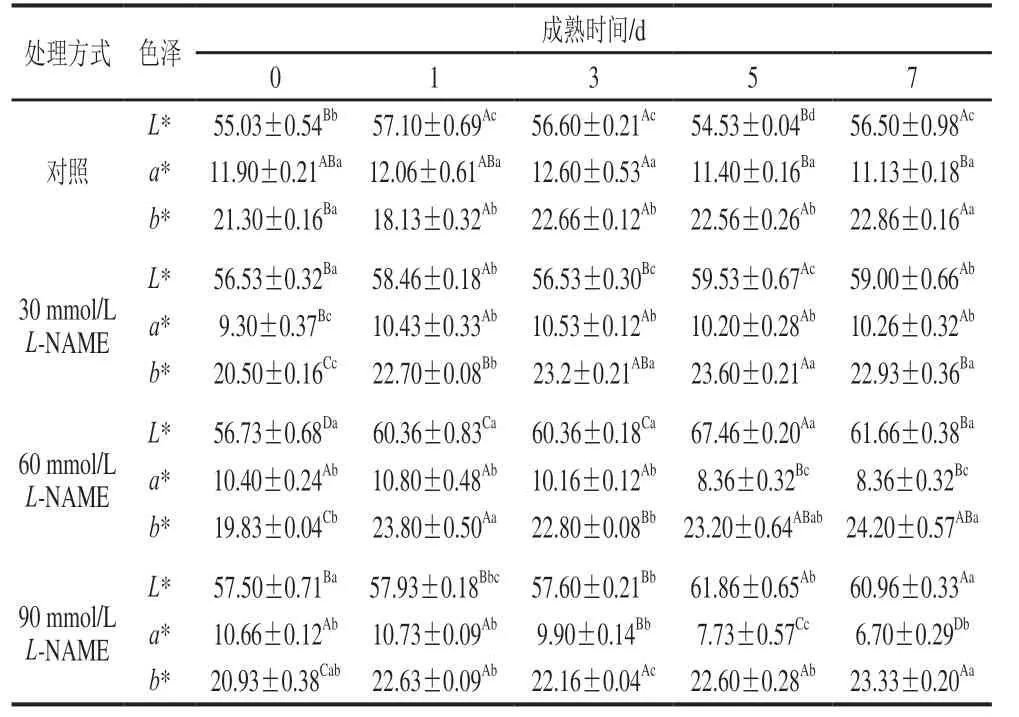
表1 不同浓度L-NAME处理对藏羊肉色泽的影响Table1 Effects of different concentrations of NOS inhibitor on color parameters of Tibetan sheep meat
2.4 NOS抑制剂处理对宰后藏羊肉MFI的影响
由图3可见,对照组与L-NAME处理组的MFI均随着宰后成熟时间的延长整体呈显著上升趋势(P<0.05)。L-NAME处理后成熟7 d时,30、60、90 mmol/LL-NAME处理组的MFI分别比对照组高16.5%、7.9%、4.0%(P<0.05),而且3 个处理组之间差异显著。综上,采用NOS抑制剂处理后,欧拉藏羊肉的MFI显著提高,说明肌原纤维蛋白的降解程度增大。
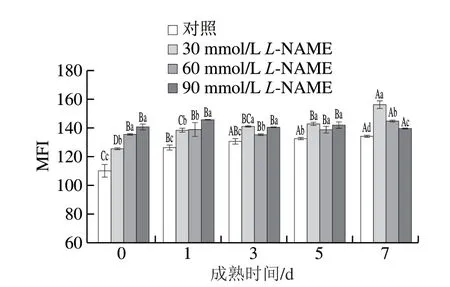
图3 不同浓度NOS抑制剂处理对藏羊肉MFI的影响Fig. 3 Effects of different concentrations of NOS inhibitor on MFI in Tibetan sheep meat
2.5 NOS抑制剂处理对宰后藏羊肉蛋白氧化的影响
由图4可知,随着贮藏时间延长,对照组与L-NAME处理组的羰基含量总体呈显著上升趋势(P<0.05),总巯基含量总体呈显著降低趋势(P<0.05),处理后成熟7 d时,30、60、90 mmol/LL-NAME处理组的羰基含量分别比对照组低24.1%、14.5%、32.8%(P<0.05),总巯基含量分别比对照组高18.1%、16.9%、29.0%(P<0.05)。由此可见,采用NOS抑制剂对宰后藏羊肉进行处理后,羰基含量降低,总巯基含量升高,降低了蛋白质的氧化程度。
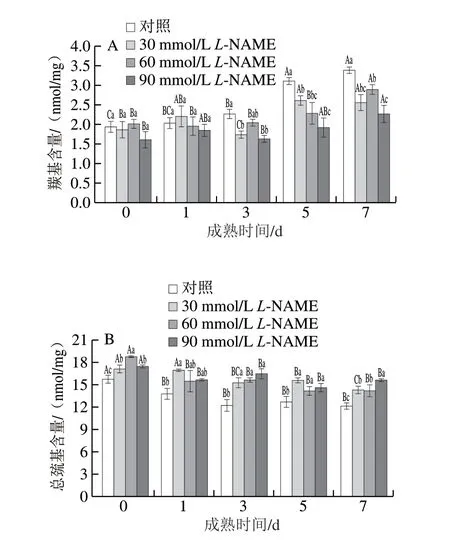
图4 不同浓度NOS抑制剂处理对藏羊肉羰基(A)、总巯基(B)含量的影响Fig. 4 Effects of different concentrations of NOS inhibitor on the contents of carbonyl (A) and total sulfhydryl (B) in Tibetan sheep meat
3 讨 论
NO主要由肌肉细胞中NOS催化精氨酸向瓜氨酸代谢所产生,其作为活性氮的主要来源,在调节肌肉收缩、钙稳态、糖酵解和蛋白降解中发挥重要作用[19]。已有研究发现,在宰后早期,动物肌肉中NOS的活性随着冷藏时间的延长而逐渐减弱[6]。L-NAME作为L-精氨酸类似物,可通过与L-精氨酸竞争NOS的催化位点来抑制NOS的活性,从而导致肌肉中NO生成减少。本研究表明,采用NOS抑制剂处理后,藏羊肉的NOS活力与NO表达量显著降低。该结果与Cottrell等[10]报道的宰前注射NOS抑制剂,宰后羊羔肉成熟过程中NO表达量降低的结果相一致。
pH值是衡量肉品质重要指标之一,直接反映肌糖原和葡萄糖酵解产生乳酸的积累程度,影响肉的嫩度和肉色等品质[20]。本实验发现,采用L-NAME处理后,随着抑制剂浓度的增加,藏羊肉的pH值显著降低,该结果可能是NOS抑制剂处理提高了肌酸激酶、甘油醛-3-磷酸脱氢酶和磷酸果糖激酶等糖酵解酶的活性,从而导致糖酵解速率加快,pH值降低[21]。张丽丽[22]研究表明,宰后经L-NAME处理的猪肉pH值显著下降。以上报道与本实验结果一致。
肉色是重要的感官评价指标,反映了肉品的新鲜度,主要由肌红蛋白含量决定[23]。Moller等[24]研究发现,NO与肌红蛋白发生反应,使肉制品呈现粉红色。本实验结果表明L-NAME处理组中的a*值较低,可能与NO含量较少有关。同时,L-NAME处理组L*值显著提高,可能是处理组具有较低的pH值,从而引起肌肉表面渗出水分增多,导致光线照射到肉表面会被反射回来,使得肉色L*值变大[25]。本实验结果与Zhang Wangang等[12]报道的鸡胸肉成熟期间NOS抑制剂处理组具有更高L*值和更低a*值的结果相一致。
MFI能够反映肌原纤维蛋白的降解情况,是评估肉嫩度的一个重要指标[26]。MFI越大,肌原纤维内部结构完整性受到破坏的程度越大,肌肉成熟度越高[27]。钙蛋白酶系统负责细胞骨架蛋白(肌联蛋白和伴肌动蛋白)和中间丝蛋白(肌间线蛋白)的水解[28]。研究发现,蛋白质硝基化可能通过间接改变细胞内钙离子浓度或直接影响钙蛋白酶的活性从而对肌原纤维蛋白的降解产生影响[29]。本实验发现,采用L-NAME处理后,欧拉藏羊肉的MFI显著提高,说明肌原纤维蛋白的降解程度增大。可能由于NO是钙蛋白酶的调节因子,抑制了骨骼肌细胞中细胞骨架结构的蛋白水解[11]。Hou Qin[8]与Li Yupin[13]等也发现,采用L-NAME处理能显著加速肌原纤维蛋白的降解。
蛋白氧化是影响肉品质的一个重要因素,其氧化程度可用羰基与总巯基含量反映[30]。NO作为自由基能够加速蛋白质的氧化[5]。随着宰后肌肉抗氧化能力的减弱,NO会与肌肉中产生的超氧阴离子自由基(O2-·)生成过氧亚硝酸根离子(ONOO-),从而提高肌肉的氧化水平[6]。本实验发现,L-NAME处理组的羰基含量降低,总巯基含量升高,降低了蛋白质的氧化程度,可能是抑制剂组的NO表达量减少,从而降低了蛋白质的氧化程度。Zhang Wangang[12]和Li Yupin[13]等分别发现鸡胸脯肉和猪背最长肌在宰后成熟过程中NO供体处理组羰基含量高于对照组与NOS抑制剂组。
4 结 论
NOS抑制剂L-NAME处理能够显著降低NOS活性,减少NO的含量(P<0.05),导致宰后藏羊肉成熟过程中pH值、肉色a*值及羰基含量显著降低(P<0.05)。同时,肉色L*值、MFI和总巯基含量显著上升(P<0.05)。综上,NOS抑制剂L-NAME处理抑制了宰后藏羊肉成熟过程中蛋白质氧化,促进了肌原纤维蛋白的降解,对宰后藏羊肉品质具有改善作用。因此,可采用注射L-NAME的方法调控宰后藏羊肉的品质,但是,L-NAME对宰后藏羊肉品质的影响机制还需进一步深入研究。
