贮藏时间及缫丝工艺对桑蚕蛹蛋白质和脂肪酸组成及蛹油体外抗氧化活性的影响
2021-10-31吴宝祥梁舒韵朱立宏江虹锐刘小玲
吴宝祥,梁舒韵,朱立宏,江虹锐,刘小玲,姜 毅
(广西大学轻工与食品工程学院,广西 南宁 530004)
蚕发育包括卵、幼虫、蚕蛹及蚕蛾4 个阶段,桑蚕蛹是鳞翅目蚕蛾科家蚕(Bombyx moriL.)的蛹,当五龄幼虫进入熟蚕阶段后停止进食,熟蚕吐丝结茧后变态成蛹,该过程中,蚕贮藏了丰富的营养物质以供蛹期发育[1-2]。我国年产桑茧约65万 t,占世界总产茧量的70%以上,鲜蚕蛹年产量约50万 t,是蚕业加工主要副产品之一[3],通常被当成废弃物或作为价格低廉的饲料[4]。2004年,蚕蛹被我国卫生部批准列入“作为普通食品管理的食品新资源名单”,其在食品工业上的开发应用逐渐受到人们的重视[5-6]。蚕蛹油脂中的α-亚麻酸和蛋白质含量丰富,氨基酸评分符合联合国粮食及农业组织/世界卫生组织推荐的标准蛋白模式值。近年来,我国鲜茧缫丝的蚕蛹主要以食品级蚕蛹形式出口日本、韩国,仅少数研究报道了将蚕蛹开发为蚕蛹罐头[7]、蚕蛹蛋白饮料[8],以及将蚕蛹粉添加至面食中提升面食的营养度[9]或作为高能量饼干的蛋白质来源[10]。
蛋白质、脂肪酸的生物活性对于开发蚕蛹功能性食品的价值有重要影响。Long Xingyao等[11]发现蚕蛹油对于盐酸/乙醇诱导的胃溃疡小鼠具有一定的保护作用。Hu Bin等[12]发现桑蚕蛹油的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率与蛹油中的总酚含量有关。Felix等[13]通过铁离子还原能力法分析发现蚕蛹蛋白浓缩物在pH 8.0时具有较高的抗氧化活性。目前,为提高蚕丝的品质和蚕蛹的附加值,工业化的缫丝工艺已逐渐由传统的干茧缫丝改进为鲜茧缫丝。由于收茧具有季节性和批量大的特点,工厂将鲜茧收集后,需经历选茧、煮茧、缫丝等加工程序,而关于收茧缫丝过程中茧的贮藏时间、缫丝煮茧工艺对蛹虫的营养价值及活性还鲜见报道。
本研究通过采集不同贮藏时间的桑蚕蛹和鲜茧缫丝后桑蚕蛹,分析贮藏时间和缫丝工艺对蛹的基本化学成分、脂肪酸组成、蛋白质组成等的影响;并探讨桑蚕蛹油的体外抗氧化活性。通过对比贮藏期桑蚕蛹与缫丝鲜蛹之间的营养组成的变化、蛹油体外抗氧化活性的差异,为桑蚕蛹功能活性产品工业的样品采集提供理论指导。
1 材料与方法
1.1 材料与试剂
‘两广二号’桑蚕茧 广西宜州茂源茧丝有限公司;缫丝蚕蛹 广西壮歌丝绸有限公司。
DPPH、14%(质量分数)三氟化硼-甲醇溶液上海麦克林生化科技有限公司;α-生育酚、磷酸盐缓冲液(0.15 mol/L、pH 7.0)、Folin-Ciocalteu试剂 北京索莱宝公司;BCA试剂盒 上海碧云天生物技术公司;2,2’-联氮-二(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、正己烷(色谱级)、没食子酸标准品 美国Sigma公司;正己烷、无水乙醇、甲醇、硫酸铵、无水碳酸钠、氯化钠、无水硫酸钠、过硫酸钾均为国产分析纯。
1.2 仪器与设备
7890B/5977A气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪 美国安捷伦公司;CR21N高速冷冻离心机 日本Hitach公司;Infinite M200 PRO光栅型多功能微孔板检测仪 瑞士Tecan公司;UV1102II紫外-可见分光光度计 上海天美科学仪器有限公司;PowerPac Basic电泳仪、Mini-Protean Tetra Cell电泳槽、CHEMIDOC XRS凝胶成像系统美国伯乐公司;FD-1D-50真空冷冻干燥机 北京博医康实验仪器公司;SH220F石墨消解仪、K9840自动凯氏定氮仪 济南海能仪器公司;SZF-06A粗脂肪测定仪上海新嘉电子有限公司;SX2-10-13箱式电阻炉 上海实研电炉有限公司;RE-201D旋转蒸发仪、N100氮吹仪上海精密仪器仪表有限公司;EMS-40数显恒温磁力搅拌水浴锅 常州爱华仪器制造有限公司。
1.3 方法
1.3.1 桑蚕蛹样品的采集与形态观察
取结茧6 d的蚕茧置于通风条件良好的贮藏室中,于(22±1)℃的条件下避光贮藏。每天定时随机采集茧样品20 只,记录质量后破茧取蛹,对蚕蛹样品进行形态观察并记录质量及体长。样品按照蚕蛹发育过程中历经复眼未着色、复眼着黑色、触角着色以及体软皮皱呈土色4 个主要形态变化[14]分为不同贮藏阶段,并记录为阶段I、阶段II、阶段III和阶段IV。为减少组内样品间差异,采集时剔除死蛹以及与同时期蛹发育有显著差异的样品。将采集到的鲜茧蚕蛹、缫丝后的蚕蛹样品于-20 ℃冰箱保存,一周内完成分析。
1.3.2 基本化学成分分析
蛋白质量分数依据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[15]中凯氏定氮法进行检测;脂肪质量分数依据GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》[16]中索氏抽提法进行检测;灰分质量分数依据GB 5009.4—2016《食品安全国家标准食品中灰分的测定》[17]中第一法食品中总灰分的测定进行检测。
1.3.3 蚕蛹蛋白质的提取
将采集到的贮藏阶段蚕蛹、缫丝蚕蛹经蒸馏水冲洗3 遍后,参考Chen Jianqing等[18]的方法稍作修改提取蛋白。取适量蚕蛹按质量体积比1∶1加入预冷的磷酸盐缓冲液于4 ℃下以10 000 r/min均质至无明显大颗粒。匀浆液经8 层纱布过滤蛹壳,滤液于4 ℃、12 000 r/min下离心30 min,弃去油脂层,收集上清液,重复离心两次,将合并收集的上清液加入硫酸铵至硫酸铵饱和度为70%,4 ℃静置2 h后,经5 000 r/min离心20 min,收集蛋白质沉淀。将硫酸铵沉淀得到的蛋白质复溶于磷酸盐缓冲液,经7 000 Da透析膜透析脱盐,经冷冻干燥后于4 ℃密封保存。样品的蛋白质量浓度使用BCA法[19]进行测定。
1.3.4 蚕蛹油的提取
将1.3.1节中采集到的各贮藏阶段蚕蛹及缫丝蚕蛹经冷冻干燥后粉碎,经100 目过筛后,于4 ℃下密封贮存备用。蚕蛹油的提取参照魏兆军等[20]的方法并稍作修改,将蚕蛹与正己烷以质量体积比1∶8混合,经38 ℃恒温水浴搅拌2 h后,将混合液于4 ℃、8 000 r/min离心10 min,收集上清;沉淀以相同条件再次提取上清液,合并两次提取获得的上清液。使用氮吹仪将上清液中有机溶剂去除,获得蚕蛹油,于4 ℃密封贮存。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
将1.3.3节获得的蛋白质样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),采用质量分数5%浓缩胶和12%分离胶检测蛋白质分子质量分布,电泳条件:样品上样量10 μL,样品蛋白质量浓度为2 mg/mL,溴酚蓝指示条带位于浓缩胶时电压为80 V,待指示条带迁移至分离胶时电压调整至120 V。经考马斯亮蓝R250染色液染色30 min,使用脱色液脱色至背景清晰后使用凝胶成像仪拍照,使用Image Lab软件分析蛋白质分子质量。
1.3.6 蚕蛹油脂肪酸含量的测定
1.3.6.1 蚕蛹油的甲酯化
蚕蛹油的甲酯化参照路萍等[21]的方法。将3 mL 0.5 mol/L的NaOH-CH3OH溶液加入0.10 g的蚕蛹油,于60 ℃水浴30 min后冷却。将冷却后的溶液加入14%三氟化硼-甲醇溶液2 mL,60 ℃水浴5 min,流动水冷却后再加入正己烷2 mL、饱和NaCl溶液2 mL,取上层溶剂层,加入无水Na2SO4脱水后,使用0.22 μm有机相针头过滤器过滤甲酯化蚕蛹油至样品瓶中,待测。
1.3.6.2 GC-MS分析条件
GC条件:使用DB-Wax毛细管色谱柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃、载气He、载气流速1 mL/min、进样量1 μL、分流比50∶1;升温程序:170 ℃保持1 min,以25 ℃/min升至195 ℃,再以3 ℃/min升至230 ℃并保持3 min。
MS条件:电离方式为电子电离,质谱传输线温度260 ℃、离子源温度230 ℃、MS四极杆温度150 ℃、质量扫描范围m/z40~500、溶剂延迟时间2 min,监测模式为全扫描模式。
1.3.6.3 GC-MS定性及定量分析
采用GC-MS全扫描模式分析得到蚕蛹油脂肪酸总离子流图;使用安捷伦化学工作站的增强型数据分析系统NIST 14.L质谱库对总离子流色谱峰对应的质谱图进行解析,根据质谱库中质谱数据匹配度及脂肪酸甲酯质谱断裂规律进行定性分析,饱和脂肪酸特征离子质荷比m/z74,单不饱和脂肪酸m/z55,双不饱和脂肪酸m/z67,多不饱和脂肪酸m/z79;通过安捷伦化学工作站的增强型数据分析软件计算蚕蛹油中各脂肪酸组分的特征离子响应值,通过面积归一化法计算脂肪酸组分的相对含量。
1.3.7 油脂中总酚含量的测定
蚕蛹油中总酚含量的测定采用Folin-Ciocalteu比色法[22]。将2.5 mL正己烷加入0.120 g蚕蛹油中,漩涡振荡溶解1 min,油相加入2.5 mL体积分数80%甲醇溶液后超声萃取10 min,混合液经10 000 r/min离心10 min。取2 mL甲醇溶液萃取相至10 mL容量瓶中,加入500 μL的Folin-Ciocalteul试剂,混匀1 min后加入2 mL 10% Na2CO3溶液,使用蒸馏水定容,于室温下避光反应1 h,于765 nm波长处测定吸光度。以质量分数10% Na2CO3溶液为对照组。配制100 μg/mL的没食子酸标准溶液,以0、100、200、300、400、500、600 μL没食子酸标准溶液(蒸馏水定溶至10 mL)对应的吸光度得到标准工作曲线方程y=0.009 2x+0.034 6(R2=0.994 5),蚕蛹油总酚含量以每千克蚕蛹油中所含没食子酸质量表示,单位为mg/kg。
1.3.8 DPPH自由基和ABTS阳离子自由基清除率的测定
使用无水乙醇将蚕蛹油分别配制成质量浓度为10、20、30、50 mg/mL和70 mg/mL溶液。DPPH自由基清除率的测定参考Peixoto等[23]的方法。取2 mL浓度为0.2 mmol/L的DPPH工作液与2 mL的样品溶液混合,室温下避光反应30 min,于517 nm波长处测定吸光度,DPPH自由基清除率按式(1)计算。以α-生育酚为阳性对照组,无水乙醇为空白对照组。
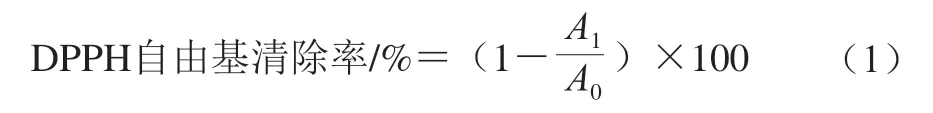
式中:A1为蚕蛹油或α-生育酚组的吸光度;A0为空白对照组的吸光度。
ABTS阳离子自由基清除率测定参考Zhao Ling等[24]的方法并稍作修改。取50 μL样品溶液与150 μL的ABTS工作液混合,25 ℃避光反应20 min,在734 nm波长处测定吸光度,ABTS阳离子自由基清除率按式(2)计算。以α-生育酚为阳性对照组,无水乙醇为空白对照组。
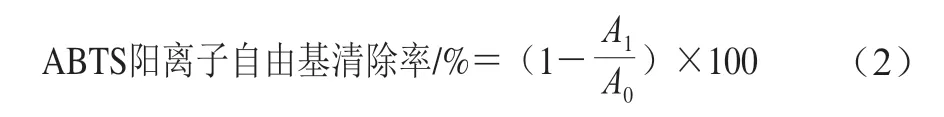
式中:A1为样品或α-生育酚与ABTS工作液的吸光度;A0为空白对照组的吸光度。
抗氧化活性结果以清除50%自由基所需的样品质量浓度——半抑制质量浓度(median inhibition concentration,IC50)表示。
1.4 数据统计与分析
实验数据采用Excel 2019软件进行处理,结果用平均值±标准差表示,每个实验至少进行3 次重复。采用Image Lab软件处理电泳图像,Origin 2019软件绘图。通过SPSS 25.0软件对实验数据进行单因素方程分析-最小显著性差异(least significant difference,LSD)检验,分析数据差异显著性(以P<0.05表示差异显著)。
2 结果与分析
2.1 贮藏期桑蚕蛹的形态变化
从结茧第6天起对蚕茧取样,根据蚕蛹形态的变化,于结茧第8、11、12、13天收集蚕蛹,样品采集时间分别记录为贮藏期阶段I、II、III和IV,各阶段蚕蛹形态变化如图1所示。

图1 贮藏期中各阶段蚕蛹形态变化Fig. 1 Change in morphology of silkworm pupa during storage
在贮藏阶段I,蚕蛹表皮呈金黄色,复眼呈淡褐色(图1A2)。阶段II的蚕蛹复眼由淡褐色变为黑色,除复眼外的其余形态特征与阶段I无明显差异(图1B2)。阶段III蚕蛹复眼着黑色,触角呈现褐色,且肛门部位变为深褐色(图1C2)。阶段IV蚕蛹触角的颜色变为深褐色,表皮呈现出深土褐色(图1D2)。阶段IV的蚕茧继续贮藏1~2 d,蚕蛹变态成蛾。蚕蛹在发育期间表皮逐渐变硬且颜色变深,与其体内的漆酶和酪氨酸有关。蛹表皮中的酪氨酸是蚕蛹表皮鞣化过程中的色素前体物质[25],蚕结茧后蛹的皮肤会分泌酪氨酸的酚类衍生物,经由漆酶作用后形成醌类物质,表皮中的蛋白质发生鞣化,使得蚕蛹的外表皮逐渐变硬、颜色变深,酪氨酸含量会随着表皮颜色的变深急剧降低[26]。
本实验通过对不同阶段蚕茧、蚕蛹的质量以及蚕蛹的体长进行记录,发现在蚕蛹发育的过程中,蚕蛹以及蚕茧的质量呈下降的趋势(表1)。与阶段III相比,阶段IV蚕茧和蛹的质量显著降低了10.22%(P<0.05),而各阶段蛹的体长无显著变化。从阶段I~IV(羽化前),蛹体质量下降,蛹体的颜色变深,这与其变态过程中机体营养物质的消化吸收有关。
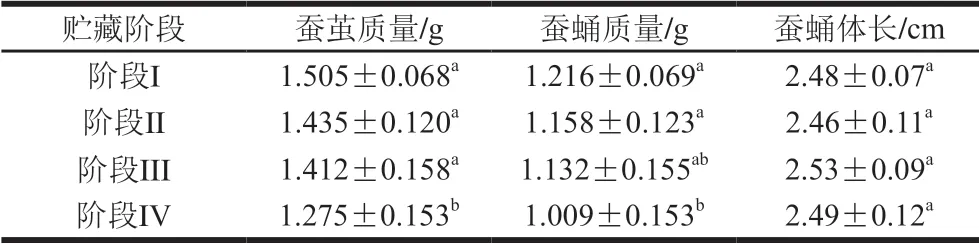
表1 蚕蛹贮藏期间蚕茧质量、蚕蛹质量及蚕蛹体长(n=20)Table1 Silkworm cocoon mass, silkworm pupa mass and silkworm pupa body length during storage (n = 20)
2.2 贮藏期桑蚕蛹和缫丝蚕蛹的基本化学成分变化
4 个贮藏阶段的蚕蛹以及缫丝蚕蛹的蛋白质、脂肪和灰分质量分数分析结果如表2所示。阶段II的蚕蛹蛋白质量分数显著高于阶段I(P<0.05),贮藏阶段III、IV蛋白质量分数没有显著差异(P>0.05)。蛋白质量分数与脂肪质量分数比值(protein/ glyceride,P/G)≥2的昆虫为高蛋白昆虫,而P/G<2的昆虫为高脂肪昆虫[27]。本实验中,蚕蛹P/G在1~2之间,说明蚕蛹是一种高脂肪的食用昆虫。随着贮藏的时间延长,蚕蛹脂肪质量分数变化呈现下降的趋势,这可能是由于贮藏期蚕蛹的发育消耗体内贮藏的脂肪。缫丝蚕蛹的蛋白质和脂肪质量分数介于阶段I和阶段II的鲜蛹之间,说明缫丝工艺对蚕蛹的蛋白质和脂肪含量无显著影响。蚕蛹属于高脂肪昆虫,可作为食品级昆虫油脂的提取原料,贮藏时间会影响其基本化学成分含量。后续实验将对贮藏期桑蚕蛹、缫丝后蚕蛹进行蛋白质组成和油脂组成进行分析,研究贮藏时间及缫丝工艺是否会对蚕蛹蛋白质以及脂肪的组成有影响。
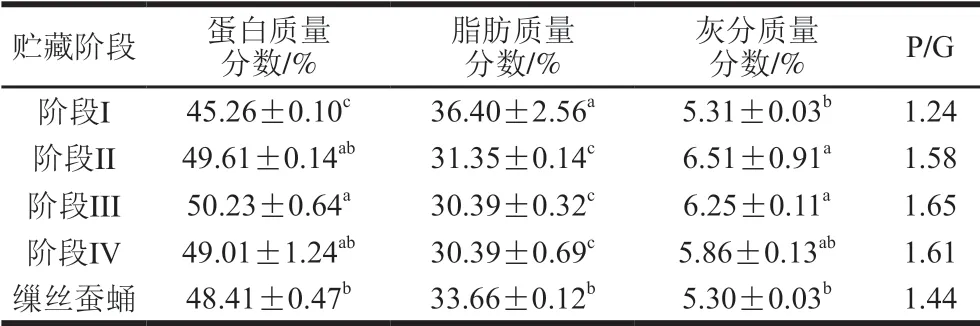
表2 不同贮藏阶段的蚕蛹基本化学成分(n= 3)Table2 Proximate composition of silkworm pupa during storage (n = 3)
2.3 贮藏期桑蚕蛹和缫丝蚕蛹的蛋白质变化
蚕蛹体内蛋白质在分子质量30、70 kDa附近含量高,随着贮藏时间延长呈下降趋势,180 kDa附近的蛋白含量随着贮藏时间延长不断增加(图2)。与阶段I和II相比,阶段III在70 kDa附近的蚕蛹蛋白含量显著降低,40~50 kDa范围出现了新的蛋白质条带。阶段IV在70 kDa和30 kDa附近的蚕蛹蛋白含量均明显下降。与贮藏期蚕蛹相比,缫丝蚕蛹30 kDa附近的蛋白质含量相对较低,70 kDa附近的蛋白质含量高,且在245 kDa附近出现新条带。
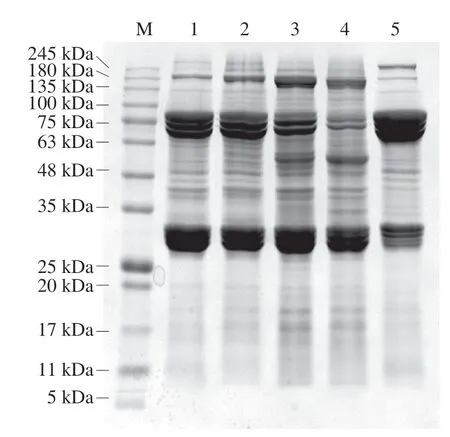
图2 贮藏期中不同贮藏阶段蚕蛹蛋白的分子质量分布Fig. 2 Molecular mass distribution of silkworm pupa proteins during storage
蚕蛹的蛋白质表达与其生长发育有密切关系。桑蚕中30 kDa附近的蛋白质主要存在于血淋巴中,属于鳞翅目低密度脂蛋白家族,被称为30K蛋白。30K蛋白由桑蚕幼虫的外周脂肪体合成并以阶段性依赖的方式转运到血淋巴,最终以颗粒的形式贮藏在内脏脂肪体中,为非进食的蛹提供生长发育必要的营养物质[28-30]。30K蛋白的抗细胞凋亡活性是目前的研究重点,于威等[31]利用Bac-to-Bac杆状病毒表达系统在家蚕卵巢培养细胞(BmN)中表达3 种30K蛋白,发现30Kc6、30Kc12p和30Kc19G1 3 种30K蛋白对H2O2诱导的人血管内皮细胞凋亡有抑制作用。在本实验中,‘两广二号’桑蚕蛹30K蛋白含量随着蚕茧贮藏时间的延长呈下降趋势,可能与其基因表达的时间特异性有关。Hou Yong[30]和Sun Quan[32]等均发现‘p50’品系的桑蚕中30K蛋白水平在化蛹前增加,化蛹后表达量下降;李擎等[33]发现在‘菁松’ב皓月’品系桑蚕中30K蛋白基因在5龄期幼虫中表达量最高,在蛹期表达量次之,到蛾期表达量下降,与本实验中30K蛋白含量变化趋势一致。说明蚕蛹30K蛋白表达与蚕蛹发育有关,而与蚕蛹品系无关。
目前对蚕蛹的研究发现70 kDa附近蛋白主要是家蚕贮藏蛋白(storage protein,SP)和酚氧化酶。SP分为SP 1(分子质量82 kDa)、SP 2(分子质量72~76 kDa)和SP 3(分子质量82.1 kDa)[34-36]。SP1属于昆虫血蓝蛋白家族中的一种六聚体蛋白,是一种雌性家蚕特有蛋白,富含蛋氨酸[37]。蛋氨酸残基能够与机体内氧化酶、过氧化氢等多种氧化剂反应形成蛋氨酸亚砜,可降低氧化应激损伤和抗哺乳动物细胞凋亡的活性[38]。SP2蛋白不仅为家蚕的生长发育提供能量,而且对于细胞凋亡具有抑制作用[39]。SP2和SP3具有高度的序列相似性,在家蚕体内形成稳定复合物,该复合物降解后为蚕蛹的发育提供氨基酸来源[40]。昆虫的酚氧化酶根据作用底物的不同可分为酪氨酸酶类型酚氧化酶和漆酶类型酚氧化酶,Yatsu[41]和Yamazaki[42]等在蚕蛹中分离到的漆酶分子质量为70 kDa,韩宏岩等[43]从家蚕表皮分离纯化得到的酪氨酸酶分子质量约为80 kDa。酚氧化酶是黑化反应过程中黑色素合成的关键因素,本实验中阶段IV蚕蛹的黑化与70 kDa蛋白的表达相关,但该阶段70 kDa附近蛋白质表达量降低的原因未知。本实验结果表明,缫丝蚕蛹中70 kDa蛋白质含量丰富,可作为70 kDa蛋白质的提取来源。目前,关于桑蚕蛹蛋白质组成及活性的研究较少,其组成变化与生理活性之间的联系有待于进一步研究。
2.4 贮藏期桑蚕蛹油及缫丝蚕蛹油脂肪酸组成的变化
贮藏期蚕蛹油中含有16 种脂肪酸,缫丝蚕蛹油含有15 种脂肪酸(表3)。在各贮藏阶段,样品含饱和脂肪酸8 种,含量最高的是棕榈酸(30.70%~32.47%);单不饱和脂肪酸3 种,含量最高的是油酸(15.08%~16.86%);多不饱和脂肪酸5 种,含量最高的是α-亚麻酸(26.03%~28.49%)。阶段I、阶段II蛹油中ω-6脂肪酸和ω-3脂肪酸的含量比(ω-6/ω-3)没有显著变化,阶段IIIω-6/ω-3显著上升(P<0.05),蛹油中ω-3脂肪酸含量的动态变化可能与蚕蛹体内的脂肪酸脱氢酶的调节有关[44]。于海彦等[45]研究发现在蚕蛹发育的过程中初期ω-3脂肪酸脱氢酶表达量降低,在发育后期脱氢酶表达量上升,使蛹体内ω-6/ω-3比例上升。与贮藏期蛹油相比,缫丝蛹油未检出二十碳五烯酸(eicosapentaenoic acid,EPA),但α-亚麻酸含量显著较高(P<0.05),这可能与缫丝工艺中热处理及脂肪酸的不饱和程度有关。鲜茧缫丝工艺中的加热温度低于100 ℃,能够防止多不饱和脂肪酸的热裂解或降低蚕蛹油脂的氧化速率,但高温加速了EPA的氧化分解。
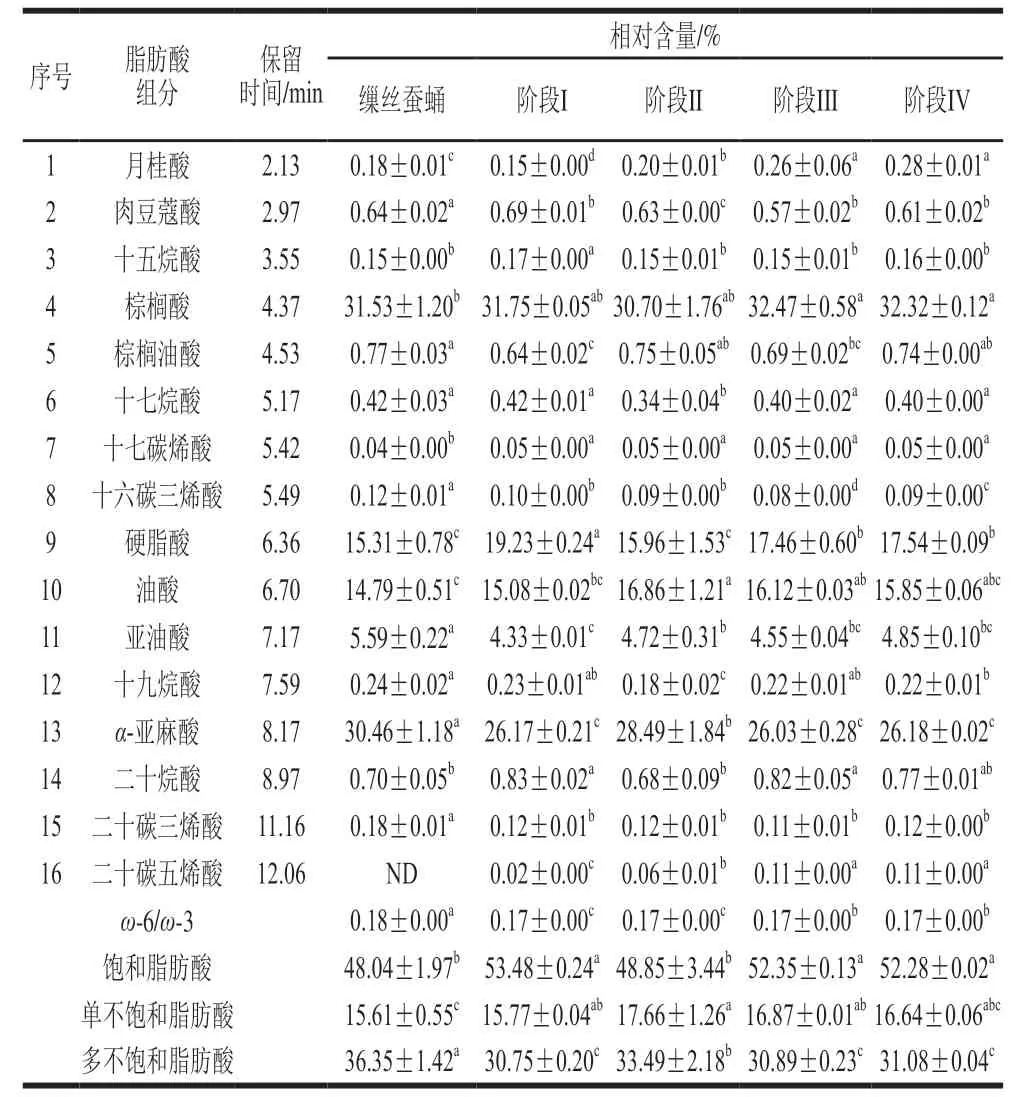
表3 贮藏期各阶段蚕蛹油的脂肪酸组成(n=3)Table3 Fatty acid composition of silkworm pupa oil during storage (n = 3)
目前的研究表明,富含ω-3系α-亚麻酸的蚕蛹油具有抗氧化、降血糖、降血脂和改善记忆的功效[46-47],本实验结果表明,随着贮藏时间的延长,蚕蛹油中ω-3脂肪酸相对含量呈现先上升后下降的趋势,而缫丝蛹油中的ω-3脂肪酸相对含量高于贮藏期蚕蛹。
2.5 贮藏时间对桑蚕蛹油DPPH自由基、ABTS阳离子自由基清除率和总酚含量的影响
蚕蛹油DPPH自由基和ABTS阳离子自由基清除率的IC50在贮藏期呈减小的趋势(52.00~20.93 mg/mL和156.81~33.32 mg/mL),总酚含量在贮藏期呈现上升趋势(15.95~77.50 mg/kg)(表4),各阶段蚕蛹油及缫丝蚕蛹油对自由基的清除力与蚕蛹油质量浓度成正比。各贮藏阶段的蚕蛹油DPPH自由基和ABTS阳离子自由基清除率的IC50及油脂总酚含量有显著性差异(P<0.05)阶段IV蚕蛹油的总酚含量最高(77.50 mg/kg),其DPPH自由基和ABTS阳离子自由基清除率也达到最高。这一现象可能与蚕蛹贮藏的过程中蛹体内的生理变化有关[43],实验的结果表明蚕蛹油体外抗氧化能力可能与蚕蛹体内酚含量呈正相关。缫丝蚕蛹油的DPPH自由基和ABTS阳离子自由基清除率的IC50分别为37.63 mg/mL和92.42 mg/mL,其DPPH自由基和ABTS阳离子自由基清除率显著高于贮藏期I和II阶段(P<0.05),但显著低于贮藏期III和IV阶段的蚕蛹油(P<0.05)。Hu Bin等[12]采用微波辅助联合乙醇-正己烷混合提取四川雅安地区桑蚕蛹油,并测定其DPPH自由基清除能力,结果发现该方法所提蛹油DPPH自由基清除能力(IC50=26.47 mg/mL)高于索氏抽提法得到的蚕蛹油(IC50=34.53 mg/mL)。Manosroi等[48]使用石油醚冷浸提得到的泰国本地蚕蛹油IC50为10.08 mg/mL。本实验采用正己烷浸提蚕蛹油,阶段IV的蚕蛹油DPPH自由基清除能力高于Hu Bin等[12]提取的蚕蛹油,但低于Manosroi等[48]提取的蚕蛹油。阶段IV蚕蛹油的总酚含量与Hu Bin等[12]微波辅助联合乙醇-正己烷法提取的蚕蛹油(78.36 mg/kg)接近,而缫丝蚕蛹油总酚含量低于Hu Bin等[12]索氏抽提法提取的蚕蛹油(42.76 mg/kg),说明蚕蛹的品种、蛹的发育、提取工艺均会影响蛹油的总酚含量及其体外DPPH自由基清除能力。葛双双等[49]发现油脂的体外抗氧化活性与其含有的α-亚麻酸共轭双键自由基引起的分子重排有关,该过程包括了单分子加成、碳碳双键氧化及环氧化的复杂过程。本实验中,阶段II的蚕蛹油α-亚麻酸相对含量最高(28.49%),但其DPPH自由基清除能力(IC50=51.04 mg/mL)低于阶段IV蚕蛹油的DPPH自由基清除能力(IC50=20.93 mg/mL)。此外,本实验中蛹油DPPH自由基清除率的IC50远低于其ABTS阳离子自由基清除率的IC50。这可能是由于DPPH自由基与脂溶性的物质具有较强的结合能力,更适用于评价脂溶性的物质的抗氧化活性[50]。综上,α-亚麻酸含量与蚕蛹油的体外抗氧化活性没有相关性,蚕蛹油的自由基清除能力可能与蚕蛹油中的酚类物质含量有关。
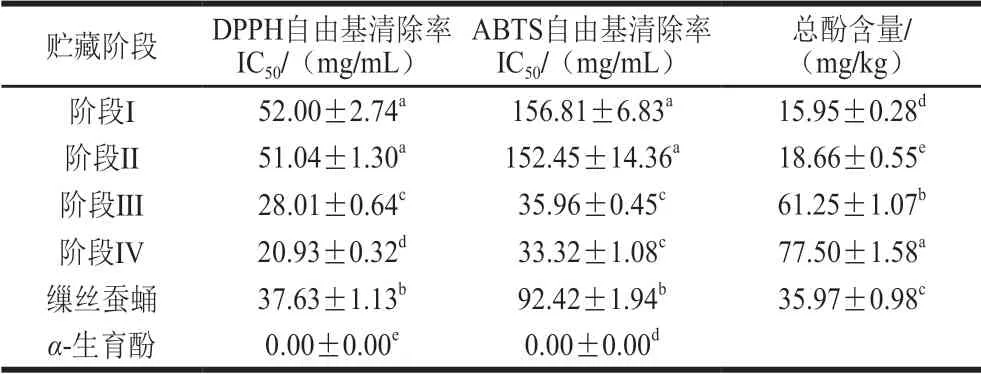
表4 贮藏阶段蚕蛹油自由基清除率和总酚含量Table4 Free radical scavenging capacity and total phenol content of silkworm pupa oil during storage
3 结 论
本实验所用的‘两广二号’桑蚕蛹属于高脂肪昆虫,含有丰富的蛋白质和不饱和脂肪酸。贮藏时间显著影响蚕蛹营养品质及蛹油的抗氧化活性,这可能与贮藏过程中蚕蛹的发育有关。蛹油中的总酚含量与其抗氧化活性呈正相关。蚕蛹是蚕茧缫丝的副产品,目前工业生产收集蚕茧有季节性,蚕茧贮藏条件不稳定且贮藏时间较长,这些会影响缫丝蚕蛹的营养品质和生理活性。因此,缫丝蚕蛹综合利用可根据不同贮藏时期蚕蛹样品的营养价值来选择原料对象,提高缫丝副产物的品质和利用率。
