肉苁蓉苯乙醇苷对HepG2肝癌细胞增殖和凋亡的影响
2021-10-30齐鑫鑫由淑萍何转霞
齐鑫鑫,由淑萍,何转霞,赵 军,刘 涛
(1新疆医科大学公共卫生学院;2新疆医科大学护理学院;乌鲁木齐 830011;3新疆维吾尔自治区药物研究所,乌鲁木齐 830004)
肝癌在全球都是严重的公共卫生问题。2018年,肝癌发病率在全球癌症发病率中排第6 位,死亡率在全球癌症相关死亡率中排第2位,其中超过一半的新发病例和死亡病例在中国[1]。传统的肝癌治疗方法存在许多局限,与化疗药物相比,天然药物因具有温和、毒副作用小、无耐药性的特点,能有效改善患者症状,提高生活质量,延长肿瘤患者生存期等独特的优势而逐渐得到广泛研究与应用。
肉苁蓉(Cistache deserticola)是我国传统的名贵补益类中药,自古就有“沙漠人参”的美誉。近年来,肉苁蓉以其显著的生物活性备受人们关注。其化学及药理作用研究显示,苯乙醇苷是肉苁蓉发挥药效的主要物质基础之一,它具有抗氧化、抗炎、抗病毒、抗肿瘤、抗菌和免疫调节等多种生物活性[2]。研究发现,其单体松果菊苷可通过降低氧化损伤、减轻肝脂肪病变来预防酒精引起的肝损伤[3],而类叶升麻苷可有效预防肝细胞癌的发生[4]。已有研究发现类叶升麻苷可有效减缓酒精性肝损伤中的炎症反应[5];此外,CPhGs、松果菊苷与毛蕊花糖苷均具有良好的抗纤维化作用[6-7]。因此,本实验旨在通过CPhGs 调控HepG2 肝癌细胞增殖、凋亡防治肝癌的实验研究进一步充实CPhGs在医药领域的应用。
1 材料与方法
1.1 材料
1.1.1 细胞株 HepG2 肝癌细胞株(货号:ZQ0022,上海中桥新舟生物科技有限公司)。
1.1.2 药物与试剂 肉苁蓉苯乙醇苷(CPhGs,含松果菊苷≥35%,毛蕊花糖苷≥16%;批号:20180502,和田帝辰医药生物科技有限公司);MEM 不完全培养基(美国Gibco 公司);胎牛血清(批号:1928702)、谷氨酰胺(批号:1941832)、丙酮酸钠(批号:1916979);双抗(青霉素与链霉素)、细胞凋亡试剂盒与细胞周期试剂盒(北京博奥森生物技术有限公司);四甲基偶氮唑盐MTT(批号:EZ5679C133)、二甲基亚砜(DMSO与Hoechst33258(美国Sigma公司)。
1.1.3 仪器 超净工作台与全管波长自动酶联免疫反应检验测试仪(美国Thermo Scientific 公司);CO2细胞培养箱(英国NEW BRUNSWICK Galaxy 系列);CK-40 影型荧光倒置显微镜(日本Olympus 公司);AEL-200 型电子天平;TGL-16G 型台式低温高速离心机;低温离心机(美国Sigma 公司);数显恒温水浴锅(上海博迅实业有限公司医疗设备厂)。
1.2 方法
1.2.1 细胞培养及分组 HepG2 肝癌细胞用MEM 完全培养基(含10%FBS、1% 双抗、1% 谷氨酰胺、1% 丙酮酸钠),在37℃、5%CO2培养箱中培养,待细胞长至对数生长期实验。实验分为4 组:空白对照组(完全培养基)、CPhGs 低、中、高剂量组(含不同浓度CPhGs的完全培养基),并使用相差倒置显微镜拍照,观察不同浓度CPhGs对HepG2细胞形态的影响。
1.2.2 MTT 法检测HepG2 细胞增殖抑制的影响 取对数生长期的HepG2细胞,调整细胞密度为3×104个/孔,接种于96 孔细胞培养板中,待细胞贴壁后,分别加入含0、78、110、125、150、170、188、220、375、500µg/mL CPhGs 的完全培养基培养24 h,加MTT 溶液处理4 h,再加入DMSO 避光孵育10 min,然后用酶标仪在490 nm 处检测吸光度值(OD 值)。计算细胞半数抑制率(IC50)并设置后续实验干预剂量。抑制率=[(空白对照组OD 值-实验组OD 值)/空白对照组OD值]×100%]。
1.2.3 平板克隆实验观察CPhGs 对HepG2 肝癌细胞克隆率的影响 取对数生长期的细胞,以2000 个/孔的细胞密度均匀的铺至六孔板中,细胞贴壁后,换含不同浓度的CPhGs完全培养基培养。7 d后,弃上清,PBS 洗涤2次,加入1 mL 4% 组织固定液固定30 min。30 min 后,弃去组织固定液,加入1 mL 结晶紫,染色30 min,然后再用PBS洗涤细胞2次,室温晾干拍照。
1.2.4 倒置显微镜拍照观察CPhGs 对HepG2 细胞形态学的影响 取对数生长期的HepG2 细胞,以1×105个/mL 的细胞密度接种于6 孔细胞培养板中,分别加入含0、32、64、128 µg/mL CPhGs 的完全培养基培养24 h 后,在倒置显微镜下拍照观察细胞形态变化情况。
1.2.5 Hoechest33258 检测CPhGs 对HepG2 细胞 核 的影响 取对数生长期的HepG2 细胞,以1×105个/mL的细胞密度接种至4分格玻底皿中,细胞分组处理同“1.2.4”实验。 待细胞处理24 h 后,收集细胞用Hoechst33258 稀释液染色15 min,然后在激光共聚焦显微镜下观察细胞核损伤情况。
1.2.6 线粒体染色检测CPhGs 对HepG2 细胞线粒体的影响 取对数生长期的HepG2细胞,以1×105个/mL的细胞密度接种至4分格玻底皿中,细胞分组处理同“1.2.4”实验。待细胞处理24 h 后,收集细胞用线粒体染剂染色15 min,然后在激光共聚焦显微镜下观察细胞线粒体损伤的发生情况。
1.2.7 AnnexinV-FITC1PI双染法观察CPhGs 对HepG2 细胞凋亡率的影响 取对数生长期的HepG2细胞,以1×105个/mL 的细胞密度接种于6 孔细胞培养板中,分别加入含0、32、64、128 µg/mL CPhGs 的完全培养基培养24 h 后,收集细胞根据凋亡试剂盒说明逐步处理细胞,然后用流式细胞仪检测细胞凋亡率。
1.2.8 流式细胞术检测CPhGs 对HepG2 细胞周期的影响 HepG2 细胞按“1.2.4”步骤接种至6 孔板中,细胞分组处理同“1.2.4”实验。待细胞处理24 h 后,收集细胞用预冷的75% 乙醇中固定过夜,次日洗涤并收集细胞,按试剂盒说明书逐步处理细胞,然后采用流式细胞仪检测细胞周期。
1.2.9 Western-blot 检测不同浓度CPhGs 对HepG2 细胞凋亡蛋白Bcl-2、Cleaved⁃Caspase3 及PARP 表达的影响 HepG2 细胞按“1.2.4”步骤接种至6 孔板中,细胞分组处理同“1.2.4”实验。待细胞处理24 h 后,收集蛋白进行定量并使蛋白变性。根据目的蛋白分子量大小配置12%、10% 的分离胶及5% 的浓缩胶,每个样品按等质量上样,恒压电泳,恒流转膜,5% 的脱脂牛奶室温封闭2 h,4 ℃孵育一抗过夜,室温孵育二抗1 h,曝光拍照,并用image J进行条带灰度值分析。
1.3 统计学分析采用SPSS21.0 统计软件进行统计分析,多样本均数比较采用方差分析,结果以均数±标准差(±s)表示,两两比较采用LSD法,检验水准α=0.05。
2 结果
2.1 CPhGs 对HepG2 细胞的增殖抑制作用随着CPhGs 药物浓度的增加,CPhGs 对HepG2 细胞的抑制逐渐增加,当CPhGs 药物浓度为500 µg/mL 时,抑制率为(82±2.3)%,经过probit 分析,CPhGs 对HepG2 细胞的IC50为187 µg/mL,见图1。在24、48、72 h 干预后,与空白对照组比较,CPhGs各剂量组OD值均显著降低,抑制率均显著增高,且差异均有统计学意义(P<0.01);干预24 h 后,CPhGs 对HepG2 细胞的增殖抑制具有一定的剂量依赖性(P<0.01)。同时,比较CPhGs 各剂量组在3 个时间段的抑制率发现,CPhGs中、高剂量组,3 个时间段HepG2 细胞抑制率差异均有统计学意义(P<0.01)。见表1。

图1 CPhGs对HepG2细胞的IC50
表1 CPhGs对HepG2细胞增殖的影响(±s,n=3)

表1 CPhGs对HepG2细胞增殖的影响(±s,n=3)
注:与空白对照组比较,*P<0.01;与低剂量组比,#P<0.01;与中剂量比,&P<0.01;与中剂量比较,&&P<0.05;与24 h 比较,aP<0.01;与48 h比较,bP<0.01
分组空白对照组CPhGs低剂量组CPhGs中剂量组CPhGs高剂量组剂量/(µg/mL)0 32 64 128 24 h吸光度值1.00±0.08 0.91±0.07*0.69±0.01*#0.62±0.01*#&&抑制率/%-9.19±6.50 37.23±1.92 37.65±0.81 48 h吸光度值1.06±0.02 0.89±0.01*0.64±0.03*#0.54±0.01*#&a抑制率/%-10.15±0.60 35.90±3.11 43.72±1.29 72 h吸光度值1.02±0.05 0.86±0.02*&0.57±0.05*#ab 0.47±0.06*#& ab抑制率/%-13.77±0.80 41.62±4.72 52.05±6.02
2.2 不同浓度CPhGs 对HepG2 肝癌细胞克隆率的影响随着CPhGs 药物浓度的增加,细胞克隆形成能力逐渐降低,当CPhGs 为64 µg/m 与128 µg/mL 时,HepG2肝癌细胞的克隆形成能力降低为对照组的7%与1%(P<0.01),见图2。

图2 不同浓度CPhGs对HepG2细胞平板克隆率的影响
2.3 从形态学观察不同浓度CPhGs 对HepG2 细胞凋亡的影响在不同浓度CPhGs 处理组中,HepG2 细胞随着药物浓度增高,细胞形态发生改变,细胞出现空泡,细胞折光度下降,细胞密度降低,细胞间连接疏松,细胞轮廓发生改变。CPhGs 各剂量组干预24 h后,细胞核出现染色质浓缩、核碎裂、核边集的细胞凋亡现象,并且细胞核发出的蓝色强光较空白对照组强。线粒体染色发现,CPhGs各剂量组细胞发生线粒体肿胀、碎片化、数量以及荧光强度都发生改变,且随着CPhGs剂量的增加,线粒体损伤特征也越来越明显。此外,还可以看出,CPhGs 高剂量组的细胞数量下降明显,细胞皱缩。除了细胞核与线粒体发生明显改变外,细胞边界不清,处于即将崩裂、死亡的状态。
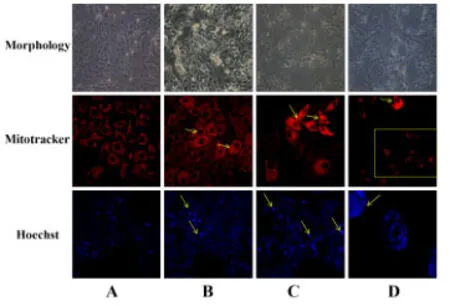
图3 不同浓度CPhGs诱导HepG2细胞凋亡的形态学观察(600×)
2.4 不同浓度CPhGs 对HepG2 细胞凋亡率的影响CPhGs 各剂量组(32、64、128 µg/mL)作用HepG2细胞24 h 后,各组细胞均发生了细胞凋亡,且随着CPhGs浓度增加而增加:空白组凋亡率(早期+晚期)为(7+1.18)%,CPhGs 低剂量组凋亡率为(11.2+0.1)%,CPhGs 中剂量组凋亡率为(19.5+2.94)%,CPhGs 高剂量组凋亡率为(69.3+3.35)%。与空白对照组比较,CPhGs 中、高剂量组的早期凋亡率与总凋亡率均增高,差异有统计学意义(P<0.01),且呈现一定的剂量依赖性(P<0.01)。见图4。

图4 Annexin V-FITC/PI双染流式细胞术检测CPhGs对HepG2细胞凋亡的影响
2.5 不同浓度CPhGs 对HepG2 细胞周期的影响G1 期与G2/M 期细胞比例,与空白对照组比较,CPhGs 各剂量组均出现显著降低(P<0.01);而S 期细胞比例,与空白对照组比较,GPhGs 各剂量组均出现明显增加(P<0.01)。此外,CPhGs 各剂量组之间比较,差异也具有统计学意义(P<0.01)。见表2,图5。
表2 不同浓度CPhGs对HepG2细胞周期的影响(±s,n=3)

表2 不同浓度CPhGs对HepG2细胞周期的影响(±s,n=3)
注:与空白对照组比较,*P<0.01;与低剂量组比较,#P<0.01;与中剂量组比较,&P<0.01
分组空白对照组CPhGs低剂组CPhGs中剂组CPhGs高剂组剂量/(µg/mL)0 32 64 128细胞周期G1/G0 67.10±2.70 62.24±2.89 56.40±2.81*#43.93±3.49*#&G2/M 8.97±0.58 6.01±0.83*3.31±0.59*#2.80±1.56*#&S 23.93±2.15 31.76±2.76*40.29±2.23*#53.25±3.73*#&
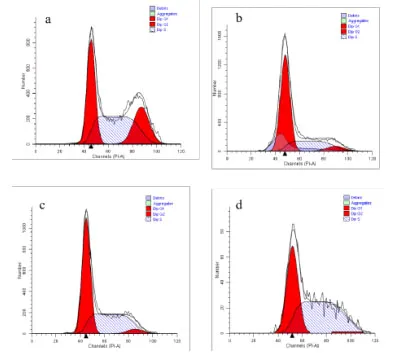
图5 不同浓度CPhGs对HepG2细胞周期的影响
2.6 不同浓度CPhGs 对HepG2 细胞凋亡相关蛋白Bcl-2、Cleaved - Caspase3 及PARP表达的影响CPhGs 各剂量组凋亡蛋白Cleaved⁃Caspase3表达均增加,与空白对照组比,差异有统计学意义(P<0.01),且各剂量组之间比较,差异有统计学意义(P<0.01或P<0.05)。 CPhGs 中、高剂量组凋亡蛋白PARP表达增加,抗凋亡蛋白Bcl-2 表达降低,与空白组比较,差异有统计学意义(P<0.01 或P<0.05);且各剂量组之间比较,差异有统计学意义(P<0.01 或P<0.05)。见图6。
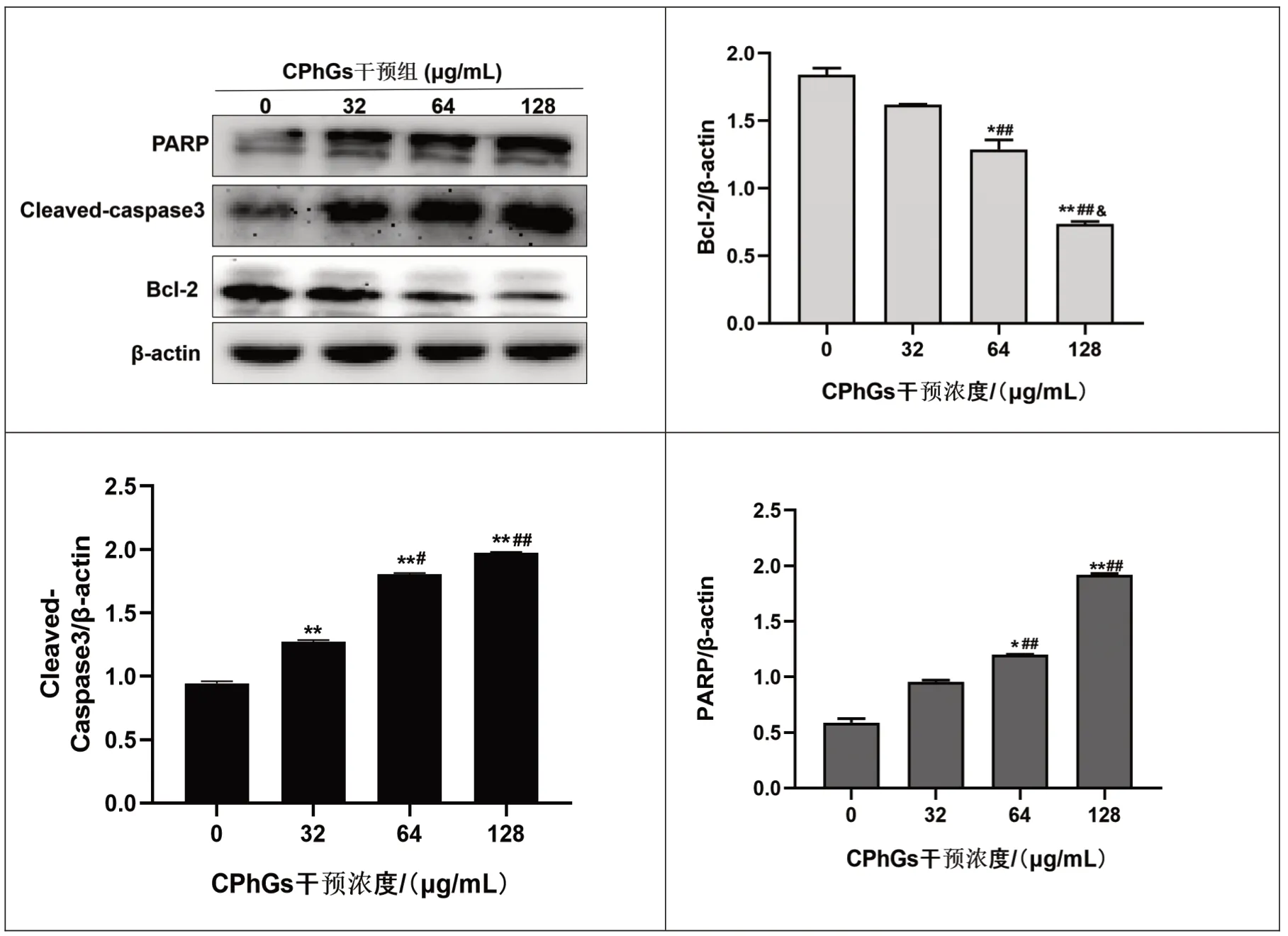
图6 不同浓度CPhGs对HepG2细胞凋亡蛋白Bcl-2、Cleaved-Caspase3及PARP表达的影响
3 讨论
细胞凋亡作为一种潜在的抗癌机制,一直受到研究人员的密切关注。大量证据表明,细胞凋亡是肿瘤发展与治疗的重要机制[8-9]。本实验发现,CPhGs可抑制HepG2 肝癌细胞增殖、诱导HepG2 细胞发生凋亡,同时还能将细胞周期阻滞在S 期。众所周知,真核生物通过无限的有丝分裂进行生长增殖,因此,就形成了有规律细胞周期,细胞周期分成G1 期、S期、G2 期及M 期4 个阶段。研究表明,S 期阻滞是诱导凋亡的潜在机制[10],例如:抗坏血酸可诱导肠道细胞S 期的DNA 损伤,从而激活下游凋亡相关蛋白引发细胞凋亡[11]。槐定碱可通过阻滞S 期激活JNK 与ERK通路,诱导胰腺癌细胞凋亡[12]。尽管,真核生物有丝分裂及DNA复制取得很多进展,但在DNA损伤或细胞周期阻滞触发细胞死亡的事件还有待进一步研究。
免疫印迹实验结果显示,CPhGs可通过下调Bcl-2,上调Cleaved⁃Caspase3 及PARP 凋亡蛋白来诱导HepG2 细胞凋亡。B 细胞淋巴瘤2(Bcl-2)基因家族成员在调节细胞程序性死亡中起着核心作用,Bcl-2蛋白的增加可抑制细胞凋亡的发生,因此它的降低也可理解为促凋亡[13]。凋亡蛋白Cleaved⁃Caspase3 是内在线粒体凋亡途径与外在死亡受体途径的交汇点,是凋亡的主要执行者[14],在凋亡启动时剪切其底物聚腺苷二磷酸核糖聚合酶(PARP)从而引发凋亡的发生,变构的PARP 又可激发其他Caspase 家族蛋白水解,以确保凋亡的顺利进行[15]。 有研究表明,Cleaved ⁃ Caspase3 可作为癌症治疗的早期监测指标[16],而在本实验中,CPhGs 各剂量组均能促进HepG2 细胞发生早期凋亡,Hochest33258 染色发现CPhGs 低剂量组即可见轻微的细胞凋亡现象。细胞凋亡是一种依赖蛋白酶的级联反应,它主要存在两种相互交错的途径:外在死亡受体途径和内在线粒体途径[17],此外,还包含一些非经典途径,这些细胞凋亡途径大都依赖Caspase 介导的级联反应。确定CPhGs 诱导的细胞凋亡方式还需通过其他实验进行综合判断。
目前,天然药物与肿瘤治疗的相关研究颇多,机制也复杂多样。因此,深入探讨CPhGs 抑制HepG2细胞增殖、诱导HepG2 细胞凋亡的具体分子学机制尤为重要,这为探讨防治肝癌的分子机制及肉苁蓉药物抗肝癌的研发提供一定的实验依据,也为新疆管花肉苁蓉药物的开发提供研究基础。
