玫瑰黄酮提取物对高脂血症大鼠血脂水平和抗氧化作用的研究
2021-10-30魏志勇阿衣古丽麦麦提海热姑丽马木提阿依考赛尔亚力坤景玉霞
魏志勇,阿衣古丽·麦麦提,海热姑丽·马木提,阿依考赛尔·亚力坤,景玉霞
(1新疆生产建设兵团奎屯中医院,奎屯 833200;2 新疆医科大学中医学院,乌鲁木齐 830011;3新疆生产建设兵团医院,乌鲁木齐 830002)
高血脂、高血糖、高血压一直以来都是全世界关注的焦点,而且随着生活水平提高、工作压力不断增加,三高已经越来越年轻化,由此引发的并发症及其死亡人数也是越来越多。对于高脂血症目前除了加强锻炼和控制饮食就是依靠药物,而可以有效降低血脂水平且不良反应小的药物还很匮乏。玫瑰花含多酚类、黄酮等多种成分,其含有的黄酮成分具有清除自由基、降血糖、抗病毒和免疫调节、防治血管硬化等多种功效[1-3],有良好的药用价值,其作用可能与抗氧化作用有关。目前,对于玫瑰黄酮的研究主要集中在玫瑰花中黄酮化合物的提取以及降糖作用的研究[4-6]。据报道,玫瑰花总黄酮(RFE)具有清除氧自由基的能力,并且随着质量浓度的增加,清除率呈线性关系[7-8]。SOD、MDA、GSH-Px 的联合测定可以反映机体清除氧自由基的能力,说明机体的抗氧化应激能力[9]。但很少有研究对玫瑰黄酮提取物在高脂血症模型中的抗氧化作用从SOD、MDA、GSH-Px 角度作进一步研究,本研究制备大鼠高脂血症模型,观察玫瑰黄酮提取物对高脂血症的抗氧化作用,为玫瑰黄酮治疗高脂血症提供一定的理论依据。
1 材料与方法
1.1 动物及分组SPF 级SD 大鼠60 只,体重(200±20)g,购自新疆医科大学动物实验中心,动物许可证号:SYXK(新)2018-0003。所有SD 大鼠均在新疆医科大学动物实验中心按照国际AAALAC 标准统一管理,动物实验经过新疆医科大学第一附属医院实验动物与使用管理委员会审核。SD 大鼠经适应性饲养1w,根据随机数字表将60 只大鼠随机分为6 组:对照组、模型组、阳性药物组及玫瑰黄酮提取物低剂量组(RFE-L 组, 6 mg/kg)、中剂量组(RFE-M, 12 mg/kg)、高剂量组(RFE-H组, 24 mg/kg),每组10只。
1.2 试剂及仪器高脂饲料(83% 基础饲料、10% 猪油、6% 白砂糖、1% 胆固醇);95% 的玫瑰黄酮提取物(赣州华汉生物科技有限公司,90106-38-0);甘油三酯试剂盒(深圳库贝尔,190401);胆固醇试剂盒(深圳库贝尔,190501);高密度脂蛋白试剂盒(深圳库贝尔,190501);低密度脂蛋白试剂盒(深圳库贝尔,190601)苏木素染料、伊红染料(北京索莱宝科技有限公司);病理染色常规试剂;SOD 试剂盒(E-30266,上海恒远生物科技有限公司);MDA 试剂盒(E-30265,上海恒远生物科技有限公司);GSH-Px 试剂盒(E-31036,上海恒远生物科技有限公司);石蜡切片机(德国Leica);图像采集系统(德国Leica);恒温培养箱(上海精宏);酶标仪(Thermo 公司);生化仪(深圳库贝尔,iMagic-V7)。
1.3 动物模型制作对照组大鼠普通饲料喂养,其余各组均给予高脂饲料喂养,自由采食饮水,制作高脂血症动物模型。喂养8 w 后,对照组继续给予普通饲料喂养,其余组均以高脂饲料喂养,同时给予药物干预:对照组普通饲料喂养,其余各组仍然高脂饲料喂养;阳性药物组给予4 mg/kg体质量辛伐他汀灌胃,95% 的玫瑰黄酮提取物按RFE-L 组(RFE-L 组, 6 mg/kg)、中剂量组(RFE-M 组, 12 mg/kg)、高剂量组(RFEH 组, 24 mg/kg)灌胃,模型组和对照组给予同等体积生理盐水灌胃,每日1次,连续1个月。
1.4 血脂水平测定药物干预结束后,处死各组大鼠,取全血,全血静置约1 h,3000 r/min,离心5 min,吸取血清用生化仪检测TG、TC、HDL、LDL。
1.5 肝脏病理HE 染色药物干预结束后,处死大鼠,取肝脏,固定于4 %福尔马林中,48 h 后,固定好的肝脏经修整,脱水,包埋,切片,进行HE染色。
1.6 检测SOD、MDA、GSH-Px 的表达水平药物干预结束后,处死各组大鼠,取全血,全血静置约1 h,3000 r/min,离心5 min,吸取血清用于试剂盒检测。采用酶联免疫吸附(ELISA)法检测血清SOD、MDA、GSH-Px中水平,方法严格按说明书操作进行。
1.7 统计学分析采用SPSS 23.0 统计学软件进行数据分析。计量资料以均数±标准(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠成模率对照组普通饲料喂养,其余各组均给予高脂饲料喂养,到第8周内眦静脉取血用于检测血脂水平,除去12只大鼠血脂升高不明显,其余各组和对照组比较TC、TG、HDL-C、LDL-C差异均有统计学意义(P<0.01),见表1,各组经血脂水平测定后,筛选出成模动物,经测算平均成模率达到约76%,详见表2。
表1 高脂血症模型大鼠血脂表达水平(±s,mmol /L)
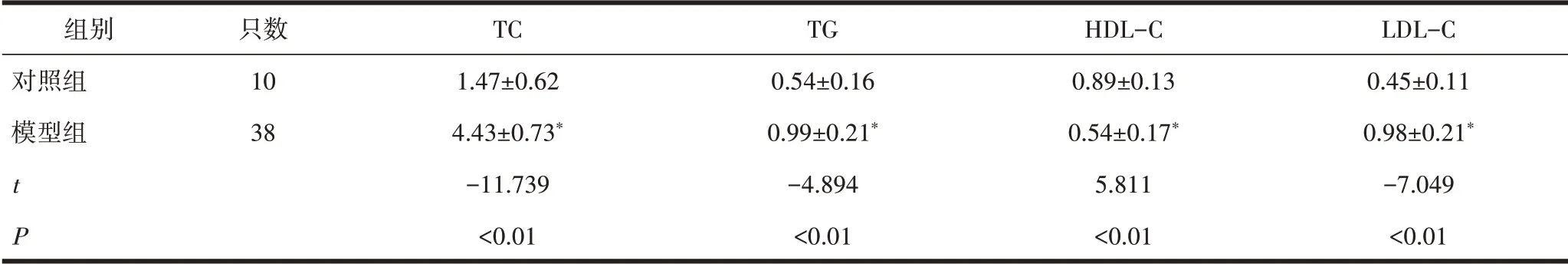
表1 高脂血症模型大鼠血脂表达水平(±s,mmol /L)
注:与对照组比较,*P<0.05
组别对照组模型组tP只数10 38 TC 1.47±0.62 4.43±0.73*-11.739<0.01 TG 0.54±0.16 0.99±0.21*-4.894<0.01 HDL-C 0.89±0.13 0.54±0.17*5.811<0.01 LDL-C 0.45±0.11 0.98±0.21*-7.049<0.01

表2 各组动物制成高脂血症模型成模率
2.2 各组大鼠不同组药物干预后肝脏的病理改变对照组大鼠肝组织无病理改变,有正常的肝小叶结构,肝索排列整齐,肝细胞呈放射状围绕中央静脉排列,细胞大小正常。模型组大鼠肝组织中肝小叶结构被破坏,显微镜下可见大量的脂肪空泡,肝细胞排列不规则;阳性对照组中肝小叶结构正常,高倍镜下仍可见少量脂肪空泡,肝索排列整齐;玫瑰黄酮提取物RFE-L 组可见肝小叶结构被破坏,肝细胞有大量的脂肪空泡,肝细胞排列不规则;玫瑰黄酮提取物中剂量组可见肝小叶结构已经有所恢复,部分视野可见完整的肝小叶结构,肝索排列整齐,但是仍可见较多肝细胞变性,整个视野有较多脂肪空泡;玫瑰黄酮提取物高剂量组可见肝小叶结构已经恢复较好,肝索排列整齐,肝细胞少见脂肪变性,细胞大小形态正常。各组大鼠肝组织病理改变见图1。
2.3 各组大鼠经药物干预后血脂水平的改变与对照组比较,模型组TC、TG、LDL-C 显著升高,HDL-C显著降低,差异有统计学意义(P<0.01)。与模型组比较,阳性药物组、RFE-L、RFE-M、RFE-H 中大鼠血清中TC、TG、LDL-C 水平降低,HDL-C 水平升高,差异有统计学意义(P<0.05)。与阳性药物组比较,RFEL、RFE-M 组TC 差异均有统计学意义(P<0.05),与RFE-H 组差异无统计学意义(P>0.05);与RFE-L 组TG 比较,RFE-M、RFE-H 组差异均无统计学意义(P>0.05);与RFE-H 组LDL-C 比较,与RFE-L、RFEM组差异无统计学意义(P>0.05),见表3。
表3 玫瑰黄铜提取物对高血脂大鼠血清中血脂水平的影响(±s,mmol /L)

表3 玫瑰黄铜提取物对高血脂大鼠血清中血脂水平的影响(±s,mmol /L)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与阳性药物组比较,△P<0.05
组别对照组模型组阳性药物组RFE-L组RFE-M组RFE-H组FP动物数/只10 8 7 8 8 7 TC 1.846±0.57#△5.40±0.93*△3.22±0.805#4.68±0.68△4.29±0.77#△2.75±0.56#28.643<0.01 TG 0.54±0.13#1.18±0.25*△0.52±0.11#0.83±0.14*#△0.62±0.13#0.51±0.12#23.244<0.01 HDL-C 0.72±0.14#0.39±0.13*0.48±0.11#0.53±0.10#0.57±0.13#0.52±0.12#7.208<0.05 LDL-C 0.51±0.15#△1.17±0.33*#△0.82±0.16*#0.98±0.18*#0.72±0.14*#0.48±0.10#△15.833<0.01
2.4 各组大鼠的SOD、MDA、GSH-Px 改变不同组SOD、MDA、GSH-Px 的改变不同,差异均有统计学意义(P<0.01)。进一步采用L-SD 法进行两两比较,SOD 结果表明:与对照组比较,阳性药物、RFE-M、RFE-H 组差异均有统计学意义(P<0.01);与模型组比较,阳性药物、RFE-M、RFE-H 组差异均有统计学意义(P<0.05);与RFE-L 比较,RFE-M、RFE-H 组差异有统计学意义(P<0.05);随着玫瑰黄酮提取物药物浓度增加,SOD 水平逐渐升高。MDA 结果表明:与对照组比较,模型、RFE-L、RFE-M 组差异有统计学意义(P<0.01);与模型组比较,其余组差异均有统计学意义(P<0.05);阳性药物组和RFE-H 组差异无统计学意义(P>0.05);随着玫瑰黄酮提取物药物浓度增加,MDA 水平逐渐降低。GSH-Px 结果表明:与对照组比较,其余各组差异均有统计学意义(P<0.05);与模型组比较,阳性药物、RFE-M、RFE-H 组差异有统计学意义(P<0.05);与RFE-L 组比较,RFE-M、RFEH组差异均有统计学意义(P<0.05)。见表4。
表4 各组动物SOD、MDA、GSH-Px表达水平比较(±s)

表4 各组动物SOD、MDA、GSH-Px表达水平比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与阳性药物组比较,△P<0.05;与RFE-L组比较,▼P<0.05
组别对照组模型组阳性药物组RFE-L组RFE-M组RFE-H组FP SOD/(pg/mL)3.89±0.91△3.24±0.61△6.70±1.5*#4.06±0.49△5.68±0.78*#△▼6.34±1.07*#▼22.196 0.001 MDA/(nmol/L)0.21±0.08#0.99±0.30*△0.16±0.09#0.79±0.17*#△0.53±0.09*#△▼0.16±0.10#▼49.143 0.001 GSH/(pmol/mL)10.47±2.00#△4.09±1.53*△7.96±1.54*#5.33±1.51*△6.89±1.19*#▼8.65±1.92*#▼19.713 0.001
3 讨论
随着人们生活水平不断提高,摄入越来越多的高脂高糖饮食,高脂血症、糖尿病、冠心病的发病率年轻化。尽管临床已经有成熟应用于临床的降脂降糖药物,但是这些药物在发挥作用时,有不同程度的肝肾功能损伤。因此亟需寻找既能发挥降低血脂水平又能降低血糖水平的药物。据报道,玫瑰花中含有的黄酮成份具有降血脂、降糖、抗菌、抗炎和镇痛等生物活性作用[10-13]。因此本实验主要对玫瑰黄酮提取物对高脂血症大鼠的降脂作用及其抗氧化作用展开研究。据文献报道,黄酮类化合物有降低血脂的作用[14-15]。筛选出的符合高脂血症要求的模型动物,经不同浓度药物连续灌胃一个月后取得样本,结果显示玫瑰黄酮提取物低、中、高组大鼠血清中TC、TG、LDL-C 水平降低,HDL-C 水平升高,且玫瑰黄铜提取物RFE-H 组降脂作用最好,说明玫瑰黄铜提取物低、中、高剂量组均有不同程度降低血脂的功能,且降脂作用与给药浓度成正比,呈剂量依赖关系[16]。
本实验中高脂血症模型组的病理改变与文献[17]报道一致,对照组大鼠肝组织无病理改变,而模型组大鼠肝组织中肝小叶结构被破坏,显微镜下可见大量的脂肪空泡,这是高脂血症动物模型最主要的病理特征。经药物干预后的动物模型病理改变明显好转,而且随着给药浓度的增加,脂肪空泡越来越少,并且肝细胞逐渐恢复正常形态和大小,肝小叶结构也逐渐恢复,以玫瑰黄酮提取物RFE-H组HE染色与对照组及阳性药物组比较,差异最小,说明玫瑰黄酮提取物RFE-H 组有利于修复高脂饲料造成动物的肝细胞损伤。
玫瑰花总黄酮具有清除自由基,抑制产生活性氧,从而减少氧化应激[18]。SOD、MDA 和GSH-Px 联合测定,可以反映机体清除氧自由基的能力,说明机体的抗氧化应激能力[19]。SOD 是抗氧化体系中最关键的酶,能够清除氧自由基,保护细胞[20],成模动物经过玫瑰黄酮提取物灌胃治疗后,随着干预药物浓度的增加,SOD 水平不断增加,说明玫瑰黄酮提取物在一定程度上发挥了抗氧化作用,且随着药物浓度的增加,其作用逐渐增强。MDA 产生的量与氧自由基的量可反映机体内脂质过氧化的程度,间接反映出细胞损伤的程度[21-22]。本研究中MDA 在模型组中表达最高,说明模型组中的肝细胞损伤最为严重,这与病理结果一致,随着玫瑰黄酮提取物药物浓度的增加,MDA 水平逐渐降低,说明玫瑰黄酮提取物的药物剂量与MDA 表达呈反向趋势,模型损伤程度与MDA呈正向趋势。GSH-Px 是体内重要的催化过氧化氢分解的酶,将其还原成无害的羟基化合物和水,可以起到保护细胞膜及细胞功能的作用,与SOD 的作用趋势一致[23]。GSH-Px在本实验中,与模型组相比,随着干预药物浓度的增加GSH-Px 水平不断增加,说明玫瑰黄酮提取物可能分解了氧自由基,增强了机体抗氧化作用,且随着药物浓度的增加,其作用逐渐增强。本研究显示,玫瑰黄酮提取物RFE-H 组的SOD和GSH-Px 明显高于模型组,而MDA 远低于模型组,表明RFE-H 组可能是清除了机体内氧自由基,使机体脂质过氧化程度显著降低,增强了机体的抗氧化作用,说明高剂量的玫瑰黄酮提取物的降血脂作用可能与机体的抗氧化酶活性有关。
综上,玫瑰黄酮提取物的降血脂作用可能与机体的抗氧化酶活性有关,且与玫瑰黄酮提取物呈剂量依赖性。
