lncRNA RAB30-AS1对宫颈癌Hela细胞增殖和凋亡影响的机制研究
2021-10-29万淑琼鲍群丽黄耿姜艳萍张青冬王楚平
万淑琼 鲍群丽 黄耿 姜艳萍 张青冬 王楚平
1鄂东医疗集团黄石市中心医院湖北理工学院附属医院妇科 435000;2鄂东医疗集团黄石市中心医院湖北理工学院附属医院检验科 435000;3鄂东医疗集团黄石市中心医院湖北理工学院附属医院泌尿外科 435000
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,发病率近年来持续上升,威胁女性健康[1]。宫颈癌的发生是正常宫颈上皮细胞由增生到癌变的复杂过程,发病因素包括早婚、多产及病毒感染等[2]。深入探究宫颈癌发病相关分子机制对宫颈癌的防治具有重要意义。长链非编码RNA(lncRNA)无蛋白编码功能,是一类长度大于200个核苷酸的RNA[3-5]。lncRNA在转录调控、端粒维护、DNA与蛋白结合等生物学过程中起到重要作用,影响细胞的行为和功能,与各种疾病的发生显著相关[6-8]。既往大量研究表明,lncRNA在宫颈癌中表达上升或降低,参与调节宫颈上皮细胞的恶性转化[9]。RAB30-AS1是一个尚未被报道的lncRNA,由607个核苷酸构成。本研究探究RAB30-AS1对宫颈癌细胞增殖和凋亡的影响及其作用机制。
1 材料与方法
1.1 细胞与主要试剂 宫颈癌细胞Hela购于中国科学院典型培养物保藏委员会细胞库;DMEM培养基购于美国Gibco公司;荧光定量PCR(qRT-PCR)试剂盒购于大连宝生物公司;pcDNA-NC质粒和pcDNA-RAB30-AS1质粒购于上海碧云天生物技术有限公司;Edu试剂盒和膜联蛋白V-异硫氰酸荧光素/碘化丙啶细胞凋亡试剂盒购于上海生工生物工程股份有限公司;二喹啉甲酸(BCA)蛋白定量检测试剂盒购于南京建成生物工程有限公司;Lipofectamine 3000购于美国Life Technologies公司;一抗和辣根过氧化物酶标记的二抗购于美国CST公司。
1.2 细胞培养和转染 将Hela细胞置于含10%胎牛血清的DMEM培养基进行培养,培养条件为37℃、体积分数5%CO2。取对数生长期Hela细胞,分别将pcDNA-NC质粒和pcDNA-RAB30-AS1质粒转染至Hela细胞,分别命名为NC组和RAB30-AS1组,转染过程参照Lipofectamine 3000试剂说明书进行。
1.3 qRT-PCR检测RAB30-AS1、磷脂酰肌醇蛋白聚糖-5(GPC5)mRNA表达 收集各组Hela细胞,Trizol法提取RNA,应用超微量分光光度计检测RNA浓度,反转录合成cDNA。qRT-PCR反应体系为20μl,以GAPDH为内参基因,采用2-ΔΔCt法计算RAB30-AS1、GPC5 mRNA的表达。引物序列如下,GPC5引物正向序列:5’-TCTAATATCTCGAAATGCGGCTG-3’,反 向 序 列:5’-GGCCATGTTCCTGTAGGTACTG-3’;RAB30-AS1引物正向序列:5’-GAAGACAAGAGGGCCCTAG-3’,反向序列:5’-AAGCAATGGGCGACAGAC-3’;GAPDH引物正向序列:5’-GGAGCGAGATCCCTCCAAAAT-3’,反 向 序 列:5’-GGCTGTTGTCATACTTCTCATGG-3’。
1.4 Edu试验检测Hela细胞增殖情况 调整两组Hela细胞浓度并接种于激光共聚焦培养皿,加入Edu染料A液孵育5 h;清洗细胞后,加入甲醛固定20 min;清洗细胞后,加入TritonX-100试剂孵育15 min;清洗细胞后,加入Click-iT鸡尾酒反应液避光孵育20 min;清洗细胞后,加入Hoechst 33342试剂避光孵育20 min;清洗细胞后,在激光共聚焦显微镜下计数总细胞数和增殖细胞数,计算细胞增殖率=增殖细胞数目/总细胞数×100%。
1.5 流式细胞术检测Hela细胞凋亡率 收集两组处于对数生长期的Hela细胞,采用磷酸缓冲盐溶液(PBS)清洗3次,加入600μl结合缓冲液,加入10μl Annexin V-FITC,加入10μl PI,在暗室孵育20 min,通过流式细胞仪检测Hela细胞凋亡率。
1.6 蛋白质印迹法(Western blot)检测靶基因蛋白的表达 收集两组处于对数生长期的Hela细胞,加入细胞裂解液提取总蛋白,BCA法检测蛋白浓度后,蛋白上样在SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)中反应,电泳产物转移至硝酸纤维素膜。5%脱脂牛奶室温下封闭,4℃条件下一抗中孵育过夜,二抗室温孵育2 h。洗膜后,加入电化学发光(ECL)显影液曝光,通过Image J软件分析条带灰度值。
1.7 统计学分析 采用SPSS 17.0统计学软件进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组Hela细胞中RAB30-AS1的表达 如图1,Hela细胞转染24 h后,NC组和RAB30-AS1组Hela细胞中RAB30-AS1的 表 达 分 别 为(1.34±0.27)和(8.90±1.60),RAB30-AS1组 相 比NC组 上 调 了6.64倍(t=4.65,P<0.01)。
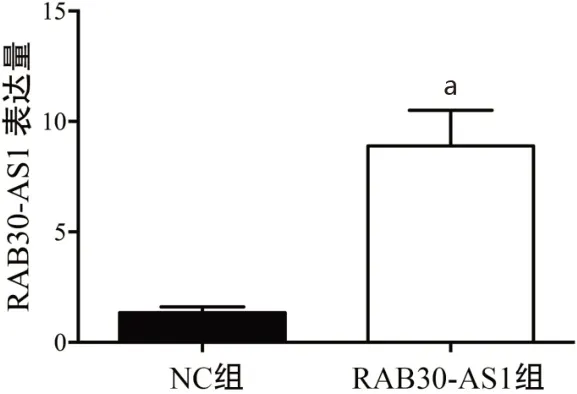
图1 NC组和RAB30-AS1组宫颈癌Hela细胞中RAB30-AS1的表达
2.2 RAB30-AS1对Hela细胞增殖活性的影响 NC组和RAB30-AS1组Hela细胞增殖率分别为(41.82±2.86)%和(20.85±3.82)%,RAB30-AS1组细胞增殖率明显低于NC组(t=4.39,P<0.01);表明RAB30-AS1过表达抑制宫颈癌Hela细胞增殖活性(图2)。
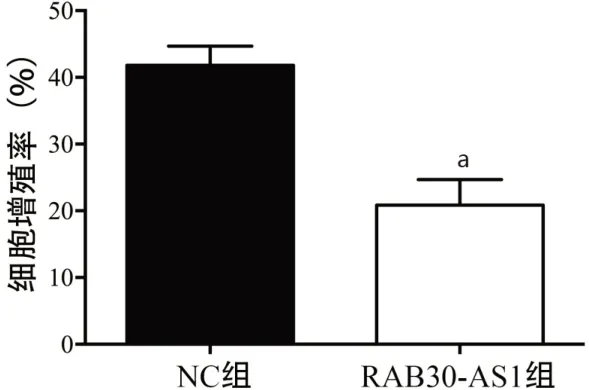
图2 高表达RAB30-AS1对宫颈癌Hela细胞增殖能力的影响
2.3 RAB30-AS1对Hela细胞凋亡率的影响 NC组和RAB30-AS1组Hela细胞凋亡率分别为(12.61±1.96)%和(32.19±4.29)%,RAB30-AS1组细胞凋亡率明显高于NC组(t=4.16,P<0.01);提示RAB30-AS1过表达可促进宫颈癌Hela细胞的凋亡(图3)。

图3 RAB30-AS1对宫颈癌Hela细胞凋亡率的影响
2.4 RAB30-AS1对GPC5 mRNA表达的影响 如图4,NC组和RAB30-AS1组Hela细胞中GPC5 mRNA的表达分别为(1.17±0.11)和(5.72±0.90);表明RAB30-AS1可促进GPC5 mRNA的表达(t=5.01,P<0.01)。

图4 RAB30-AS1对宫颈癌Hela细胞GPC5 mRNA表达的影响
2.5 RAB30-AS1对GPC5蛋白表达的影响 Western blot结果(图5)表明,与NC组相比,RAB30-AS1组Hela细胞GPC5蛋白增加,细胞周期Cyclin H表达降低,促凋亡蛋白Bax表达增加。
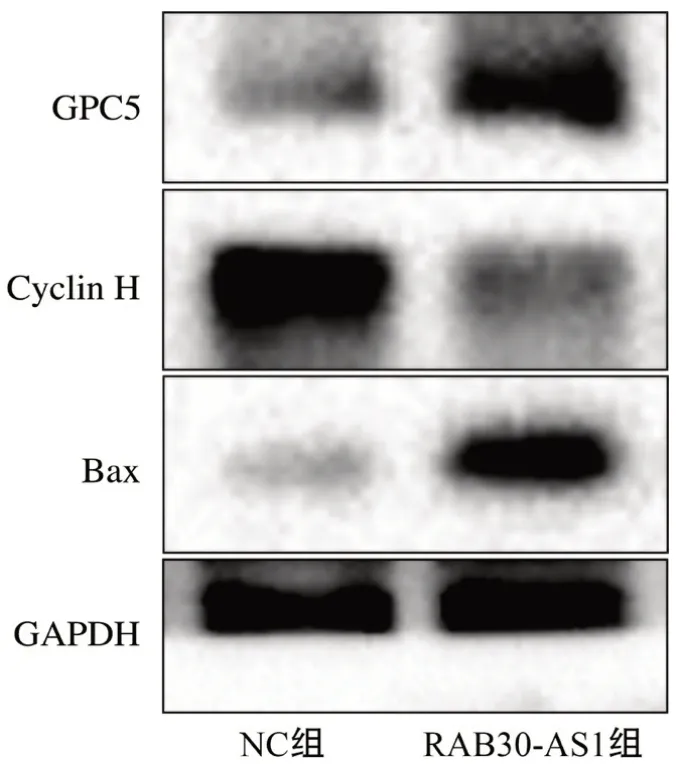
图5 高表达RAB30-AS1对宫颈癌Hela细胞GPC5蛋白表达的影响
3 讨 论
lncRNA与前列腺癌、肾癌、宫颈癌等肿瘤细胞的恶性生物学行为显著相关[10-11]。Zhang等[12]报道,lncRNA MIAT在宫颈癌组织和细胞系中表达上调,其能够促进宫颈癌中的细胞增殖、迁移和侵袭,敲低lncRNA MIAT会导致宫颈癌细胞增殖、迁移和侵袭被抑制。Zhou等[13]报道,在宫颈癌中lncRNA EWSAT1的表达增强,并可导致患者的不良预后,下调EWSAT1通过靶向miR-330-5p抑制了宫颈癌Hela细胞的迁移、增殖和侵袭。RAB30-AS1对宫颈癌细胞增殖和凋亡研究未见报道。本研究结果显示,RAB30-AS1过表达后,宫颈癌Hela细胞增殖率显著降低,细胞凋亡率明显增加,提示RAB30-AS1在宫颈癌细胞中表现为抑癌作用。
GPC5蛋白属于Glypican蛋白家族,负责编码细胞表面蛋白聚糖[14]。GPC5蛋白在胰腺癌、胃癌、非小细胞肺癌、乳腺癌等肿瘤表达显著降低,在细胞的恶性转化中发挥重要作用[15-16]。上调GPC5蛋白能够抑制肿瘤细胞的增殖、迁移、化疗抵抗等恶性生物学行为,GPC5表现为抑癌作用[17]。本研究结果显示,过表达RAB30-AS1后Hela细胞中GPC5基因的表达显著升高,提示RAB30-AS1可促进GPC5基因的表达,GPC5可能是RAB30-AS1的靶基因。RAB30-AS1促进GPC5基因表达后,Hela细胞周期Cyclin H表达降低,促凋亡蛋白Bax表达增加,间接提示Hela细胞增殖活性降低,细胞凋亡增加。
综上所述,RAB30-AS1可能通过上调GPC5基因表达,抑制宫颈癌Hela细胞增殖并诱导细胞凋亡,RAB30-AS1可能成为宫颈癌靶向治疗的新靶点。
利益冲突:作者已申明文章无相关利益冲突。
