蓝莓花色苷的酶法酰化修饰及其疏水性改善研究
2021-10-29洪森辉杨秀雯黄晓雪
洪森辉,杨秀雯,黄晓雪,费 鹏,
(1.闽南师范大学生物科学技术学院,福建漳州 363000;2.闽南师范大学闽台特色园林植物福建省高校重点实验室,福建漳州 363000)
花青素是以2-苯基苯并吡喃阳离子为母核的黄酮类物质,一种水溶性色素[1−2],现已知的花青素有20 多种,主要存在于植物中[3−5]。然而自然条件下游离状态的花青素极少见,花青素通常与一个或多个葡萄糖、鼠李糖、半乳糖、阿拉伯糖在C3、C5、C7、C3'、C5'位以糖苷键相连形成花色苷,其中,C3 位是最常见的结合点[6−8]。迄今为止,人们已从自然界分离鉴定出600 多种花色苷[9−11]。花色苷除了作为多酚类色素应用于食品之外[12−13],还具有广泛的药理作用,如促进类维生素A 再生、抗炎、增强免疫力、抗氧化、抗衰老、抗肿瘤等生理活性[14−16]。
花色苷作为一种天然抗氧化剂和多酚色素,已成为食品添加剂研究的热点。作为一种抗氧化活性较好的天然色素[17−18],花色苷经常被用作葡萄酒、饮料、果酱、糕点和糖果的染色剂,以改善颜色、风味、保质期和健康特性[19−21]。但花色苷的脂溶性差,不利于在非水体系中发挥抗氧化作用,限制了其在某些高脂食品中的应用,如冰激凌、肉制品、油炸制品和食用油等[22]。向花色苷分子上引入亲脂性基团是提高其疏水性的一个有效方案。在前期研究中,Cai 等[23]以肉桂酰氯为酰化剂,以4-二甲氨基吡啶为催化剂,通过固相反应法对蓝莓花色苷进行了酰化修饰,结果表明花色苷的脂溶性显著提高。但化学酰化法产生较多的副产物,产物的结构难以厘清。Yang等[24]以异丙醇为溶剂,脂肪酶为催化剂,将月桂酸接枝于黑醋栗花色苷上以改善其疏水性。但花色苷在异丙醇中的溶解度很低,酰化花色苷的制备效率难以让人满意。
本文拟以脂肪酶为催化剂,阿魏酸和咖啡酸为基供体,在水/四氢呋喃两相体系中对蓝莓花色苷进行酰化修饰以改善其疏水性,并进一步探讨了酚酸基团的引入对花色苷抗氧化活性的影响。本文为蓝莓花色苷作为着色剂和功能性食品添加剂在高脂类食品中的应用提供了理论支撑与经验参考。
1 材料与方法
1.1 材料与仪器
蓝莓花色苷 西安圣青生物科技有限公司(370.2 mg/g,以矢车菊素-3-O-葡萄糖苷计);脂肪酶(≥5000 U/g,重组酶,在黑曲霉中表达)、溴化钾上海阿拉丁试剂有限公司;阿魏酸、咖啡酸、亚油酸、β-胡萝卜素 上海麦克林试剂有限公司;无水乙醇、吐温80、四氢呋喃 西陇科学股份有限公司;本文所用试剂,除非另有说明,否则均为分析纯。
MultiSkan Go 全波长酶标仪 美国赛默飞世尔有限公司;LC-RE-2000A 旋转蒸发仪 上海力辰仪器科技有限公司;NICOLET IS 10 傅里叶红外光谱仪 美国赛默飞世尔有限公司;T9 紫外-可见分光光度仪 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 酰化花色苷的制备 本文采用Novozym 435 脂肪酶催化法制备酰化蓝莓花色苷[25]。具体步骤如下:将30 mmol 阿魏酸和4.5 g 天然蓝莓花色苷(native anthocyanins,Na-An)分别溶解于100 mL 四氢呋喃和100 mL 去离子水中,然后将两者混合并加入1 g Novozym 435 脂肪酶;将混合物置于50 ℃下磁力搅拌24 h,使阿魏酸接枝到蓝莓花色苷分子上;反应结束后,用旋转蒸发仪在50 ℃下除去混合液中的四氢呋喃,再用微孔膜(Φ=0.45 μm)过滤除去脂肪酶和未反应的阿魏酸;通过冷冻干燥去除改性花色苷溶液中的水分,收集固体粉末,即为阿魏酸修饰花色苷,记为Fe-An。
用同样的方法制备了咖啡酸酰化花色苷,记为Ca-An。
1.2.2 正辛醇/水分配系数测定 将100 mL 正辛醇与300 mL 超纯水混合,恒温搅拌24 h,静置分层后将两相液体分别保存,即水饱和正辛醇和正辛醇饱和水。取0.01 g 花色苷及改性花色苷,溶解于5 mL 水饱和正辛醇中,测定其吸光度为A0,加入5 mL 正辛醇饱和水,震荡1 h 后,在3000 r/min 下离心10 min,取上层正辛醇,测定其吸光度A1[24]。

1.2.3 酰化度测定 参照Pinheiro 等[26−27]测定酰化花色苷的酰化度。取0.2 g 酰化花色苷加入20 mL 0.1 mo/L NaOH 溶液中,在60 ℃条件下搅拌90 min使花色苷水解并皂化;随后,向混合溶液中滴加0.05 mo/L 和0.01 mo/L的HCl 直至pH 为8.5,所消耗HCl 体积分别记为V1和V2。按照下面公式计算花色苷的酸值(Acid Value,AV)和酰化度(Acylation Degree,AD)。

式中:m 为使用的花色苷质量,为0.2 g;C0为0.1 mo/L,V0为20 mL;C1为滴定所使用盐酸溶液的浓度,为0.05 mo/L,V1为该盐酸溶液消耗的体积;C2为滴定所使用盐酸溶液的浓度,为0.01 mo/L,V2为该盐酸溶液消耗的体积。M 为接枝基团的相对分子质量,阿魏酰基为177 g/mol,咖啡酰基为163 g/mol。
1.2.4 总花青素含量测定 通过pH 差示法测定蓝莓花色苷中的花青素含量[23]。将花色苷分别溶解于pH1.0 和pH4.5的缓冲液中,放在黑暗环境中静置60 min,分别测定样品在520 和700 nm 处的吸光度,按照公式(4)计算花青素含量。

式 中:吸光度值A=(A520nm−A700nm)pH1.0−(A520nm−A700nm)pH4.5;Mw 为矢车菊色素-3-葡萄糖苷(Cyanidin-3-O-glucoside)的相对分子量(449.2 g/mol);ε为摩尔消光系数(26900 L·mol−1·cm−1),DF 为稀释因子(V/Wt)。
1.2.5 DPPH 自由基清除率测定 用无水乙醇稀释0.25 mmol/L DPPH 自由基溶液,使其在513 nm 处吸光度约为0.8;取4 mL DPPH 自由基溶液置于7 mL 离心管中,用MultiSkan Go 全波长酶标仪测定其在513 nm 处的吸光度,记为A0;向离心管中加入50 μL 花色苷溶液(250 mg/L),在黑暗中放置30 min后,再次测量其在513 nm 处的吸光度,记为A1[28]。

1.2.6β-胡萝卜素漂白抑制率测定 向梨形瓶中10 mLβ-胡萝卜素氯仿溶液(1 mg/mL)中加入400 μL 亚油酸和4 mL 吐温80,混合均匀后在40 ℃旋转蒸发除去氯仿;在梨形瓶中加入100 mL 蒸馏水,将混合液搅拌均匀,形成乳化液;取10 mL 乳化液,用去离子水定容至100 mL,制得乳化稀释液;将约0.2 mL的花色苷溶液加入到4.8 mL的乳化稀释液中,混合均匀后测定470 nm 处相应的吸光度;将样品置于50 ℃恒温水浴中,2 h 后,测定乳化液在470 nm 处的吸光度。对照样品不加花色苷溶液,用70% 乙醇溶液代替。β-胡萝卜素漂白抑制率计算如下[25]:

1.2.7 结构表征 采用T9 紫外-可见分光光度仪(UV-Vis)对样品进行全波段扫描,扫描范围200~800 nm,扫描步长1 nm;采用NICOLET IS 10 傅里叶变换红外光谱仪(FTIR)测定花色苷的官能团,测定波数范围为4000~400 cm−1,分辨率为16 cm−1。
1.3 数据处理
所有的测试都重复三次并采用SPSS 22.0 进行统计分析。采用单因素方差分析和独立样本检验比较差异,当P<0.05 时认为在统计学意义存在显著性差别,当P<0.01 时认为存在极显著差别。
2 结果与分析
2.1 疏水性分析
本文用辛醇-水分配系数(KOW)来表征蓝莓花色苷改性前后的疏水性变化。KOW 是指物质在正辛醇和水两相中的平衡浓度之比,其数值越大,物质脂溶性也越大[24]。结果如图1 所示,Na-An的KOW 值为−0.20,而Fe-An 和Ca-An的KOW 值分别上升至0.66 和0.78。这表明,经阿魏酸和咖啡酸修饰后,花色苷的脂溶性显著提高。这是由于阿魏酸和咖啡酸均为疏水性物质,当其接枝到花色苷分子上时,从而增强了该物质的疏水性。

图1 蓝莓花色苷及酰化花色苷的辛醇/水分配系数Fig.1 KOW of native and acylated blueberry anthocyanins
2.2 酰化度和花青素含量分析
图2 反映了蓝莓花色苷与酰化花色苷的酰化度和花青素含量。如图2(a)所示,Fe-An 和Ca-An的AD 值分别为3.65 %和3.71%;两种酰化花色苷之间无显著差异(P>0.05)。图2(b)显示,每克天然蓝莓花青素含有370.2 mg的花青素(以矢车菊素-3-O-葡萄糖苷等量物表示),经阿魏酸和咖啡酸修饰后,TAC 值分别降低至219.2 mg/g(Fe-An)和222.18 mg/g(Ca-An)。这主要是由于蓝莓花色苷中外来基团(阿魏酸或咖啡酸)的增加导致。此外,在酰基化反应过程中,蓝莓花色苷中的部分发色基团被破坏或降解,也是导致酰化花青素的TAC 值低于未酰化样品的一个原因。
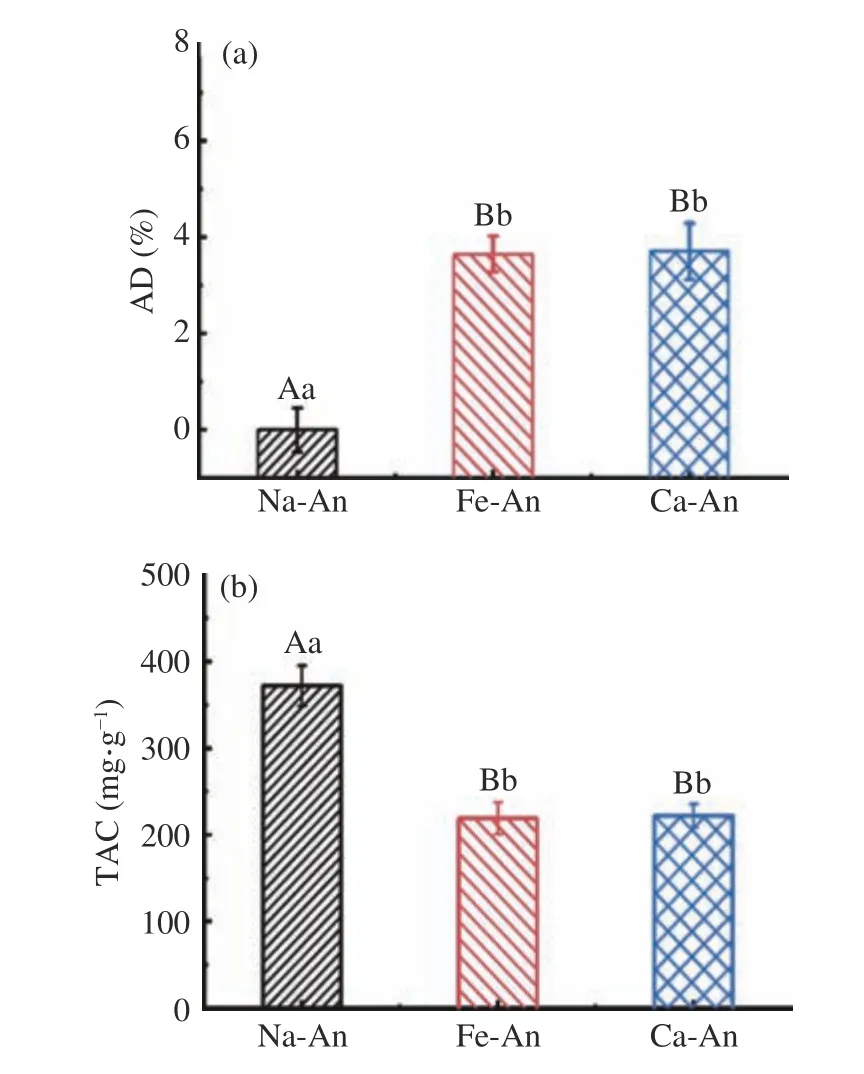
图2 蓝莓花色苷及酰化花色苷的酰化度(a)和花青素含量(b)Fig.2 AD(a) and TAC(b) of native and acylated anthocyanins
2.3 抗氧化活性分析
以β-胡萝卜素漂白抑制率和DPPH 自由基清除率为指标,测定蓝莓花青素及其酰化衍生物的抗氧化活性。结果如图3 所示,蓝莓花色苷在DPPH 自由基清除实验和β-胡萝卜素漂白实验中均表现出良好的抗氧化活性。与阿魏酸和咖啡酸发生酰化反应后,花色苷对DPPH 自由基的清除能力及对β-胡萝卜素漂白的漂白抑制率进一步提高[29]。这是由于阿魏酸和咖啡酸均含有有酚羟基,是良好的电子供体,可以通过提供电子清除溶液中的自由基。其中,阿魏酸分子上有一个酚羟基,而咖啡酸分子上有两个酚羟基,因此,Ca-An 对DPPH 自由基的清除率高于Fe-An。
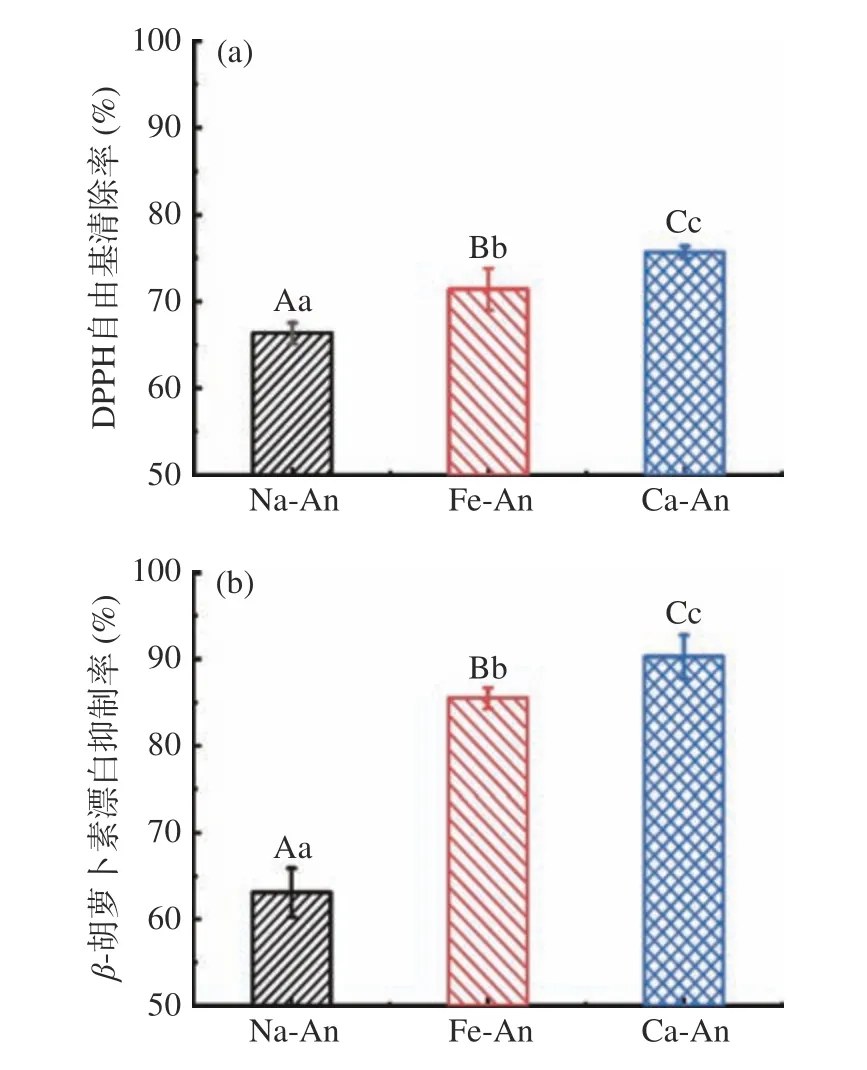
图3 蓝莓花色苷及酰化花色苷的DPPH 自由基清除率(a)和β-胡萝卜素漂白抑制率(b)Fig.3 DPPH radical scavenging rate (a) and inhibition ratio in β-carotene bleaching assay (b) of native and acylated blueberry anthocyanins
Na-An 对DPPH 自由基的清除率和β-胡萝卜素漂白抑制率分别为66.3%和63.1%,当其接枝阿魏酸和咖啡酸后,Fe-An 和Ca-An 对DPPH 自由基清除率分别上升了3.17%和12.67%,而β-胡萝卜素漂白抑制率则分别上升了35.5%和43.1%。DPPH 自由基清除率是物质在极性溶剂中抗氧化活性的指标,而β-胡萝卜素漂白试验中的抑制率反映了物质在乳液环境中的抗氧化活性[10]。这表明,酰化花色苷在乳液体系中的抗氧化能力强于其在极性环境下的抗氧化活性。这一结果可能与蓝莓花色苷在DPPH 自由基清除实验和β-胡萝卜素漂白实验中的作用机制不同有关[22−24]。在DPPH 自由基清除实验中,花青素通过提供电子清除DPPH 自由基,而在β-胡萝卜素漂白实验中,花色苷通过抑制脂质氧化发挥作用。因此,在DPPH实验中,接枝到花色苷分子上的酚酸可以提供电子,并清除DPPH 溶液中的自由基,从而提高花色苷的抗氧化能力。在β-胡萝卜素漂白实验中,酚酸的引入改善了花色苷的脂溶性,使其可以更好地吸附在油酸表面,阻止油酸在加热过程中被氧化而产生自由基,从而进一步抑制了自由基对β-胡萝卜素的漂白作用。
2.4 UV-Vis 分析
图4 展示了天然蓝莓花色苷酰化前后的UVVis 光谱。花色苷在UV-Vis 光谱中有两个特征峰,分别位于500~540 nm(可见光区)和260~290 nm(紫外区)。Harborne[30−31]研究表明酰化花色苷在290~340 nm 处具有特征性吸收,这是由于酰基上的电子跃迁造成的。从图4(a)中可以看出,天然蓝莓花色苷在278 nm 处有一个特征吸收峰,经阿魏酸和咖啡酸修饰后,该特征峰红移至283 nm。于此同时,改性花色苷在320 nm 处出现了一个吸收峰,这是花色苷上的酰基造成的。这表明阿魏酸和咖啡酸通过酰化反应接枝到花色苷分子上。

图4 蓝莓花色苷及酰化花色苷的UV-Vis 图谱Fig.4 UV-Vis spectra of native and acylated anthocyanins
另外,在图4(b)中可以观察到,经阿魏酸和咖啡酸修饰后,蓝莓花色苷在可见光区的特征峰吸光度降低并发生蓝移,这可能是由于接枝到花色苷分子上的酚酸与花色苷母核(2-苯基并吡喃)产生空间位阻效应造成的。以上结果表明,在脂肪酶的作用下,阿魏酸和咖啡酸通过酰化反应接枝到花色苷分子上。
除此之外,在图4(b)的440~460 nm 区域可以观察到明显的肩峰,这表明花色苷中糖苷替代的位置在C3 位置[30−31],这与之前的文献报道的一致。
2.5 FTIR 光谱分析
为了进一步验证蓝莓花色苷与阿魏酸及咖啡酸之间的酰化反应,通过FTIR 表征了蓝莓花色苷酰化前后分子基团的变化。图5(a)中,蓝莓花色苷及酰化花色苷3134 cm−1处均有一个宽且强的吸收峰,这是花色苷苯环中的酚羟基和H2O 中-OH 及氢键的伸缩振动造成的,1400~1650 cm−1处的多个吸收峰是由苯环的骨架振动造成的。图5(b)中,蓝莓花色苷在1730 cm−1处有一个吸收峰,这是C=O的伸缩振动造成的。经阿魏酸和咖啡酸修饰后,花色苷在该处的吸收峰红移至1700 cm−1,且吸收峰强度明显增强并发生红移。这是由于阿魏酸和咖啡酸与花色苷发生了酯化反应造成的。一般而言,ArCOOR 上的C=O 会因为苯环的空间位阻效应导致其吸收峰移向大波数,而芳香酯(RCOOAr)上的C=O 吸收峰因为与C=C 吸收峰共轭,使其吸收峰发生红移。由此可以推断,阿魏酸和咖啡酸分子上的-COOH 与花色苷分子上糖基的-OH 发生了酰化反应,生成了ArCOOR结构,造成了C=O 吸收峰的红移现象。

图5 蓝莓花色苷及酰化花色苷的红外光谱图谱Fig.5 FTIR spectra of native and acylated anthocyanins
3 结论
花色苷作为一种具有良好抗氧化活性的天然色素,其脂溶性较差是阻碍其在油脂中应用的最大障碍之一。为了解决这一问题,本研究通过酶法将阿魏酸和咖啡酸接枝到蓝莓花色苷分子上,以提高其疏水性。相较于化学酰化法,酶法酰化的反应条件相对温和,且副产物较少。研究结果表明,UV-Vis 和FTIR分析表明,在脂肪酶的作用下,这两种酚酸接枝到了花色苷分子上,花色苷中的接枝位点可能主要是花色苷糖基上的-OH。KOW 实验表明,酚酸的引入显著提高了蓝莓花色苷的疏水性。
另外,与天然蓝莓花色苷相比,酰化花色苷的DPPH 自由基清除率和β-胡萝卜素漂白抑制率均显著提高。这是由于一方面,阿魏酸和咖啡酸分子上的酚羟基可以提供电子以清除自由基。另一方面,酰化花色苷中的的酚酸可以吸附在亚油酸分子上,抑制其在高温下氧化,阻碍自由基的生成。
