苦丁皂苷D的分离纯化及其纳米粒的制备表征
2021-10-29胡夏恬张凤清
胡夏恬,张凤清, ,于 敏
(1.长春工业大学化学与生命科学学院,吉林长春 130012;2.吉林省中医药科学院,吉林长春 130118)
苦丁茶冬青(Ilex kudingchaC.J.Tseng)为冬青科冬青属乔木植物,是药、饮兼用之名贵珍品[1−2],富含五环三萜及皂苷类、黄酮、甾体、多糖等多种化学成分[3−4],具有降血脂、降血糖、抗肿瘤、抗氧化等多种生物学活性[5−10]。苦丁皂苷D(Kudinoside D)是从苦丁茶冬青中提取的三萜皂苷类化合物[11−12],研究表明Kudinoside D 能抑制胆固醇肠道吸收,显著降低血浆中总胆固醇、总甘油三酯且升高血浆高密度脂蛋白的水平,此外还有降低甘油三酯、抗氧化、肾保护和改善血液流变学等作用,可以用于治疗高血脂及其相关疾病,具有良好的制药用途[13]。
虽然Kudinoside D 有良好的保健作用,但Kudinoside D 水溶性差,生物利用度低,这是导致其药效作用发挥不佳的重要因素。随着纳米技术的发展,纳米药物载体在提高难溶性药物溶解度方面的作用日益凸现[14−19]。聚谷氨酸(γ-PGA)具有无毒性、生物相容性高等优点[20−21],L-苯丙氨酸乙酯(L-PAE)可作为疏水基团与γ-PGA 形成良好的两亲性纳米载药系统[22−24]。两亲性聚合物γ-PGA-PAE的亲脂端可以包裹脂溶性药物,同时其亲水性可以使被包裹的药物形成良好的水化层,使药物水溶性和稳定性更高[25]。然而目前纳米制剂的研究多为化学药物纳米制剂,对植物提取物纳米制剂的研究较少,与此同时大多数纳米粒的相关研究普遍只从纳米粒的制备方面着手,少有筛选载药纳米粒制备方法的研究报道。
为了提高Kudinoside D的生物利用度,本研究分别采用沉淀法、透析法制备Kudinoside D 纳米粒,并对其理化性质进行表征,为开发保健功能效果更好的Kudinoside D 新型制剂提供一定的实验基础。
1 材料与方法
1.1 材料与仪器
苦丁茶冬青 海南省产;聚谷氨酸(γ-PGA) 海宁市紫金港生物科技有限公司;硅胶100~200 目青岛海洋化工有限公司;L-苯丙氨酸乙酯盐酸盐(LPAE) 上海麦克林生化科技有限公司;碳酰二亚胺盐酸盐(EDC.I) 美国阿拉丁工业公司;二甲基亚砜(DMSO)、氘代二甲基亚砜 北京鼎国昌盛生物技术有限公司;氯化钠、二氯甲烷、盐酸 北京化学试剂公司;乙腈、甲醇 色谱纯,美国Fisher 公司;透析袋 北京索莱宝科技有限公司;超纯水 实验室自制;其他试剂均为分析纯。
LC-20A 型高效液相色谱仪 日本岛津公司;FW10C 高速万能粉碎机 天津市泰斯特仪器有限公司;HH-6 数显恒温水浴锅 常州中捷实验仪器制造有限公司;PHS-3E 型pH 计 上海仪电科学仪器股份有限公司;Millipor-Q 型超纯水机 美国Millipor 公司;LKTC-E 恒温振荡器 金坛市城东新瑞仪器厂;Hwcb-2 恒温磁力搅拌器 温州市医疗电器场;5424R 高速冷冻离心机 德国Eppendorf 公司;FD-1D-50 真空冷冻干燥机 北京博医康实验仪器有限公司;AV600 一维及二维核磁共振谱 美国Bruker 公司;HT7820 透射电镜 日本日立公司;动态纳米粒度仪 英国Malvem Instruments 公司。
1.2 实验方法
1.2.1 Kudinoside D的分离纯化及鉴定 参考文献[26]方法,称取7.5 kg 干燥的苦丁茶冬青叶粉碎,用8 BV 70%乙醇浸提3 次,每次5 d,合并提取液减压浓缩(40 ℃)至无醇味,制得浸膏。分别用3 L×4 L的石油醚、乙酸乙酯、水饱和正丁醇依次萃取:将流体状浸膏转入分液漏斗中,先加入4 L 萃取剂充分振摇,静置分层,收集有机溶剂部分,共萃取3 次,合并萃取液;再在流体状浸膏中加入下一萃取剂用同样方法重复萃取3 次。将各萃取部位减压浓缩、低温蒸干(40 ℃)后,固体粉碎过100 目筛。取正丁醇萃取部位粉末100 g,经正向硅胶柱层析,二氯甲烷-甲醇(4:1)50 倍体积洗脱,收集洗脱部分,再经ODS 填料甲醇-水(8:1)50 倍体积洗脱,半制备型高效液相纯化,得到化合物I-9 162 mg。
色谱条件:选用YMC-Pack C18柱,流动相乙腈(A)-水(B)二元梯度洗脱,0~15 min 30% A,15~45 min 30%~50% A,分析时间45 min,流速2.0 mL/min,柱温35 ℃,检测波长254 nm,进样量40 μL。
鉴定:称取5 mg 化合物I-9 用0.5 mL 氘代吡啶溶解,转移至核磁管中,进行核磁检测(1H-NMR、13CNMR)。1H-NMR 测定条件:测定温度298 K,频率600 MHz,谱宽33333 Hz;13C-NMR 测定条件:测定温度298 K,频率150 MHz,谱宽33333 Hz。
1.2.2 聚谷氨酸与L-苯丙氨酸乙酯共聚物(γ-PGAPAE)的合成 参考文献[27]方法,称取1.01 gγ-PGA,加入超纯水50 mL,在恒温振荡器中振摇5~6 h(37 ℃,200 r/min)充分溶解。调节γ-PGA 溶液的pH 至3.0(1 mol/L HCL 溶液),置于98 ℃恒温水浴中,降解9 min,立即冰浴冷却,再将溶液的pH 调至7.0(1 mol/L NaOH 溶液),结束降解反应,得到小分子γ-PGA 溶液。
称取EDC.I 2.61 g 加入上述小分子γ-PGA 溶液中,于恒温振荡器中振摇15 min(37 ℃,200 r/min),再加入L-PAE 1.06 g,于恒温振荡机中反应24 h(37 ℃,200 r/min)。反应产生白色沉淀,用超纯水洗涤(离心14000 r/min,10 min),弃上清,重复3 次,将沉淀物质真空冷冻干燥48 h,得到产物γ-PGA-PAE 1.24 g。
1.2.3γ-PGA-PAE的纯化与鉴定 将1.2.2 中得到的γ-PGA-PAE 材料溶解于5 mL的DMSO 溶液中,再将该溶液用滴管滴加于5 mL 超纯水中,滴加后得到乳白色半透明溶液,离心(14000 r/min,10 min)后弃去上清,清洗过程重复三次。将沉淀真空冷冻干燥24 h 以上,得到已纯化的γ-PGA-PAE 材料。取500~600 μL 氘代DMSO 加入到纯化后的γ-PGAPAE 材料(6~8 mg)中,于恒温震摇器中振荡24 h 以充分溶解(37 ℃,120 r/min)。将样品溶液转移至核磁管中,进行核磁检测(1H-NMR)。
1.2.4 Kudinoside D 纳米粒的制备 称取5 mg Kudinoside D 和20 mgγ-PGA-PAE,溶解于2 mL DMSO 中,将混合溶液用滴管缓慢滴加于2 mL 超纯水中,磁力搅拌3~4 h(120 r/min),制成纳米粒溶液,同样方法另制备一份纳米粒溶液。将一份纳米粒溶液在高速冷冻离心机中离心10 min(14000 r/min),弃上清,收集底部沉淀;另一份纳米粒溶液,转移至透析袋(截留相对分子质量1500)中并用循环水透析24 h,收集底部沉淀。将收集的两份物质真空冷冻干燥24 h 后分别得Kudinoside D 纳米粒15.08 mg、24.62 mg。比较两种方法制得纳米粒的包封率与载药量,择优进行表征及体外释药特性的考察。
1.2.5 包封率、载药量测定 HPLC 色谱条件:Angilent Eclipse XDB-C18柱(4.6 mm×250 mm,5 μm),流动相乙腈-水(4:6),流速1.0 mL/min,柱温35 ℃,检测波长为254 nm。此色谱条件下对Kudinoside D 对照品进行线性关系考察。精密称取Kudinoside D 10 mg于100 mL 容量瓶中,加入甲醇定容得浓度为100 μg/mL的药物溶液。取适量溶液配制成1.0、3.0、5.0、7.0、9.0、11.0、13.0、15.0 μg/mL的溶液,进样20 μL,以峰面积(Y)与质量浓度(X)进行线性回归。
称取Kudinoside D 纳米粒5 mg 加入1 mL 丙酮,超声10 min 溶解,用旋转蒸发仪(40 ℃)去除有机相,再加入2 mL 甲醇超声5 min,经0.45 μm的微孔滤膜过滤后得到供试品溶液。HPLC 法检测包封率和载药量,HPLC 色谱条件同上。
包封率EE(%)=(W1/W2)×100
载药量DL(%)=(W1/W3)×100
式中:W1为载药纳米粒中药物的质量,mg;W2为总投药量,mg;W3为载药纳米粒总质量,mg。
1.2.6 Kudinoside D 纳米粒的表征 取适量Kudinoside D 纳米粒用超纯水重悬,通过动态纳米粒度仪检测纳米粒尺寸、粒径分布及Zeta 电位。将Kudinoside D 纳米粒重悬样品滴加到铜网上,烘干,用1%的钼酸铵溶液染色后,通过透射电镜检测Kudinoside D 纳米粒的形态和尺寸。
1.2.7 Kudinoside D 纳米粒的体外释药特性考察称取Kudinoside D 纳米粒5 mg,加入适量0.1 mol/L的PBS(pH7.4)超声分散,转移至透析袋中(截留相对分子质量1500),将透析袋扎紧后置于含有50 mL PBS的烧杯中,于恒温振荡器中振荡48 h(37 ℃,100 r/min),定时取样2 mL,同时补加同等体积0.1 mol/L的PBS(pH7.4)。用HPLC 外标法检测Kudinoside D的含量,色谱条件同1.2.5,并计算释药量。
释药量DR(%)=(W4/W1)×100
式中:W4为透析后释放的药物质量,mg;W1为载药纳米粒中药物的质量,mg。
1.3 数据处理
本文所用数据为2 次平行实验结果均值;绘图软件采用ChemDraw。
2 结果与分析
2.1 Kudinoside D的结构鉴定
1.2.1 中制得的化合物为白色粉末I-9。HPLC检测结果显示化合物的色谱峰保留时间与Kudinoside D 一 致,为6.29 min;1H-NMR(600 MHz,Pyridine-d5)谱鉴定结果显示,δ0.85、0.90、1.07、1.24、1.41、1.55、1.71(各3H,s)为五环三萜母核上7 个甲基质子信号,δ3.32(dd,J=11.7 4.4 Hz)为C-3 上连氧次甲基质子信号,5.79(dd,J=10.6,1.9 Hz)和7.53(dd,J=10.5,3.1 Hz)为一对顺式双取代的烯质子信号,δ4.90(d,J=5.7 Hz,1H)、5.14(d,J=7.8 Hz,1H)、6.20(s,1H)分别为三个糖(Ara、Rha、Glc)端基碳质子信号;13C-NMR(600 MHz,Pyridine-d5)谱图中共显示47 个碳信号,其中δc175.34 为C-28 羰基信号,δc127.31、128.55 和140.85、135.12 分别为C-11 和C-12 位及C-13 与C-18 形成的共轭双键碳信号,δc104.99(3-Ara-1)、δc104.92(Glc-1)、δc102.11(Rha-1)分别为三个糖基的端基碳信号。该化合物的核磁数据与文献[28]中Kudinoside D的报道吻合,故确认化合物为 Kudinoside D。化合物液相色谱谱图如图1,核磁结果如图2、图3,分子结构式如图4。
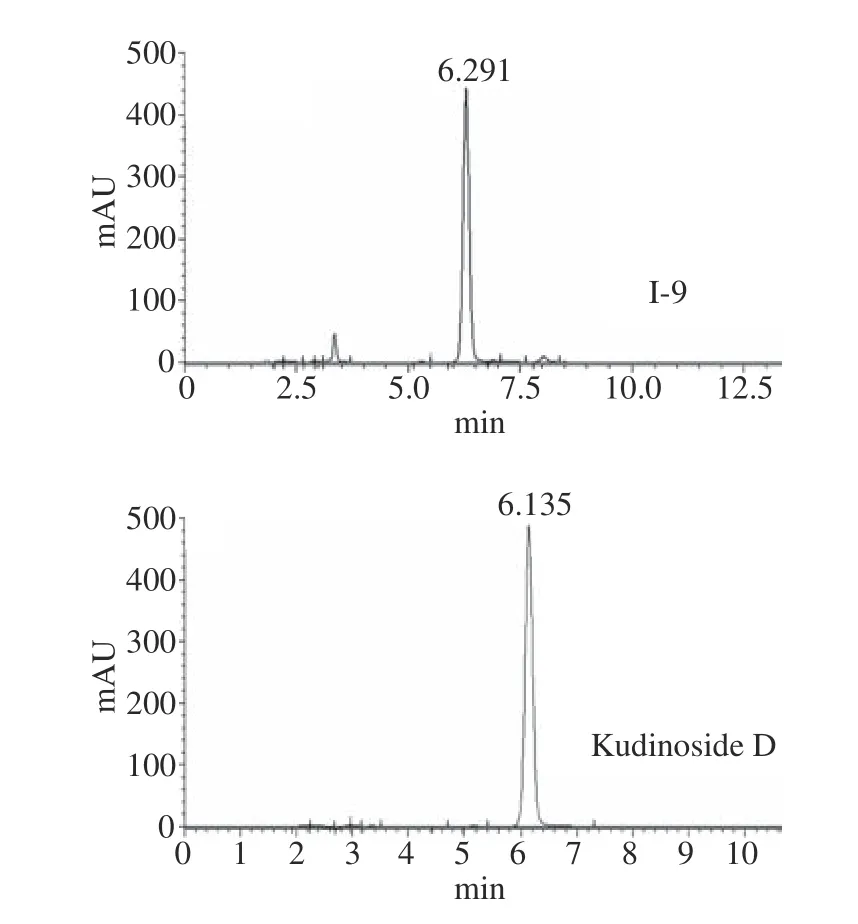
图1 化合物I-9 与Kudinoside D 液相色谱图Fig.1 Liquid chromatogram of compound I-9 and Kudinoside D

图2 Kudinoside D 1H-NMR 图谱Fig.2 1H-NMR spectra of Kudinoside D

图3 Kudinoside D 13C-NMR 图谱Fig.3 13C-NMR NMR spectra of Kudinoside D

图4 Kudinoside D 分子结构图Fig.4 The molecular structure of Kudinoside D
2.2 γ-PGA-PAE的鉴定
为改善高分子材料γ-PGA 水溶液黏度过高不利于L-PAE 进行修饰反应的问题,本文采取了高温酸解法,将分子量较大的γ-PGA 降解,再加入EDC.I 进行缩合反应,从而使γ-PGA 侧链的羧基和L-PAE 上的氨基都脱去一分子的H2O,形成肽键后在γ-PGA的侧链上成功连接L-PAE,形成两亲性聚合物γ-PGA-PAE[27,29−30]。1H-NMR 结果显示(图5),图谱中标注的a、b、c、d 处符合γ-PGA的特征峰(δ值分别为7.89、4.27、1.85、2.13 ppm),图上标注的e、f、g、h、i 和j 处符合L-PAE的特征峰(δ值分别为8.34、4.43、3.99、1.07、3.00、7.18 ppm),与文献[22]一致,说明L-PAE 与γ-PGA 已成功连接组装为两亲性的γ-PGA-PAE 材料。
2.3 Kudinoside D的纳米粒包封率和载药量
经HPLC 检测,回归方程为Y=3963.8X−7.875(R2=0.9997),在1.0~15 μg/mL 范围内线性关系良好,可用于药物含量的测定和体外溶解度实验分析。沉淀法制备的纳米粒包封率为44.14%,载药量为2.99%;透析法制备的纳米粒包封率为65.46%,载药量为13.24%。故选用透析法制备的纳米粒进行表征和体外缓释效果的考察。
2.4 Kudinoside D 纳米粒的形态表征
本研究制备的Kudinoside D 纳米粒冻干粉末呈白色,溶液为乳白色透明液体。透射电镜结果显示(图6),Kudinoside D 纳米粒呈现规整的圆球形,大小较均一,分布均匀,无明显的团聚现象,根据粒径分布图可判断(图7),Kudinoside D 纳米粒平均半径为(75±25)nm,分散系数为0.18,Zeta 电势为33.7,表明所得纳米粒大小理想,分布较集中,带有较强正电荷,稳定性较好。

图6 Kudinoside D 纳米粒的透射电镜图Fig.6 The TEM imge of Kudinoside D nanoparticles

图7 Kudinoside D 纳米粒的粒径分布图Fig.7 Particle size distribution of Kudinoside D nanoparticles
2.5 Kudinoside D 纳米粒的体外缓释效果考察
由图8 可知,与Kudinoside D 纳米粒相比,游离Kudinoside D 在3 h 时就已释放了50%,在10 h时已经完全释放,而Kudinoside D 纳米粒较游离Kudinoside D 无明显突释现象,药物在10 h 时才释放到达50%,之后释放趋于平缓。体外缓释实验表明Kudinoside D的纳米粒具有缓释特点,这说明Kudinoside D 纳米粒能增加血药浓度作用的时间。
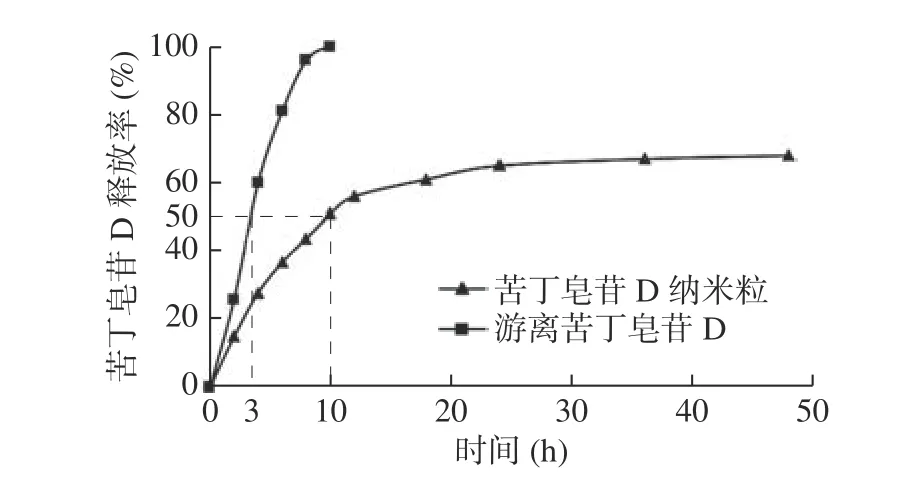
图8 Kudinoside D 纳米粒的缓释曲线Fig.8 Sustained release curve of Kudinoside D nanoparticles
3 结论
本研究以γ-PGA-PAE 为载体,采用沉淀法和透析法制备Kudinoside D 纳米粒,结果显示透析法制备纳米粒的包封率为65.46%,载药量为13.24%;沉淀法制备纳米粒的包封率为44.14%,为载药量2.99%,说明所得纳米粒包封率较高,载体对药物有很好的相容性。高包裹率的纳米粒能显著提高Kudinoside D的稳定性,故对包封率和载药量更高的透析法制备的Kudinoside D 纳米粒进行表征和体外缓释效果考察。结果显示所得Kudinoside D 纳米粒粒径均一,平均粒径为(75±25)nm,分散度良好,同时Kudinoside D 纳米粒与单纯Kudinoside D 药物相比具备了更好的缓释效果。Kudinoside D 纳米粒的缓释特性能使血药浓度维持平稳,可避免药物的快速降解,减少给药次数,增加药物作用时间。此外,Kudinoside D 纳米粒具有良好的纳米尺寸,对其进行修饰可制备脑内药物递送系统。本研究对Kudinoside D 纳米粒进行了体外表征,其体外生物活性还需要进一步验证。虽然纳米药物制剂发展前景广阔,但目前大多处于实验室研究的阶段,尤其是靶向纳米药物制剂,体内生物实验经验积累更少。制备纳米药物制剂过程中使用的辅料的毒性问题及载药纳米粒进入机体后是否会沉积等问题仍需研究。再者,目前纳米药物制剂的制备主要是在实验室制备,同时对所生产的纳米药物制剂尚未有完善的质量标准评价体系,对其进行质量的把控。总而言之,纳米药物制剂在药物制剂乃至临床医药领域都有很高的研究价值,值得深入探究。
