乳腺癌耐药蛋白对急性髓系白血病耐药性的临床研究
2021-10-28石张镇杨永净刁建东白元松卢振霞
周 迪,石张镇,杨永净,刁建东,白元松*,卢振霞*
(1.吉林大学中日联谊医院 血液肿瘤科,吉林 长春130033;2.吉林省肿瘤医院 放疗一科,吉林 长春130012)
多药耐药(MDR)是急性髓系白血病(AML)患者化疗失败、肿瘤复发、生存期缩短的重要原因之一,对MDR机制的探索成为目前的研究热点[1]。ATP结合盒(ABC)膜转运蛋白超家族在其发生机制中的角色被逐渐认识,乳腺癌耐药蛋白(BCRP)作为ABC家族重要成员之一,是一种依赖ATP酶的药物排除泵,近年来被发现可能与包括米托蒽醌、柔红霉素等在内的多种抗肿瘤药物的交叉耐药有关[2]。研究发现,AML患者中多药耐药基因(MDR1)和BCRP共表达与临床耐药、较低的完全缓解率、较差的总生存率相关[3],BCRP可能是AML的耐药机制之一。为了探讨BCRP对AML患者耐药性的相关性,本文对AML患者骨髓细胞的BCRP基因表达量、蛋白表达量进行检测,并对不同浓度的DNR作用下AML骨髓细胞的药物敏感性进行了研究。
1 材料与方法
1.1 临床资料
吉林大学第三医院收治的AML患者20例,其中男性8例,女性12例,年龄范围为21-55岁。根据标准的FAB诊断分型为M1 型1例、M2 型4例、M3 型6例、M4 型3例、M5 型6例。
具体分组:本研究中的20例AML患者中,结合患者的治疗史,有12例为首次接受治疗,为初治组,8例为既往接受治疗并缓解后再次出现复发,为复发组。AML患者根据在院期间对治疗的反应,分为敏感组和耐药组,其中有9例为敏感组,11例为耐药组。具体分组情况见表1。

表1 AML患者具体分组情况
1.2 方法
1.2.1单个核细胞分离 所有患者均进行骨髓穿刺术,吸取新鲜骨髓,稀释2倍后,加入Ficoll淋巴细胞分离液,1 500 rpm离心30 min,分离出单个核细胞,计数备用。
1.2.2药物干预及MTT法检测细胞活性 根据柔红霉素的血浆峰值浓度(PPC),对96孔板中的单个核细胞给予不同浓度的柔红霉素干预,包括2倍PPC、1倍PPC、0.5倍PPC、0.25倍PPC、0.125倍PPC,即40、20、10、5和2.5 μg/ml,各浓度分别设置4次重复。
在适宜条件下培养后,向细胞培养体系中加入MTT溶液20 μl(浓度为5 mg/ml),于4 h后取出96孔板,将液体吸出并弃去,立即加入150 μl二甲基亚砜,于37℃孵箱摇床震荡10 min后终止。酶联免疫检测仪测定各孔490 nm波长处的吸光度(OD)。
PPC=20D(D为临床化疗计量单位mg·kg-1·d-1);肿瘤细胞生长抑制率=(1-试验孔OD值/对照孔OD值)×100%。化疗药物高度敏感:生长抑制率>50%;化疗药物中度敏感:生长抑制率30%-50%;化疗药物低度敏感:生长抑制率<30%。
1.2.3流式细胞术法检测BRCP蛋白 单个核细胞(106个)离心并应用冷PBS洗涤后,应用细胞固定液作用30-40 min,应用冷PBS洗涤两次,并向细胞中加入BCRP抗体,冰上避光静置30 min。利用流式细胞分析检测仪对细胞的荧光强度进行定量记录,每份样本共计数104个细胞,以荧光染色阳性细胞百分率>10%作为阳性标准。
1.2.4RNA提取 取106数量级的单个核细胞,加入1 ml的RNA提取液TRIzol,震荡并静置,后加入异丙醇沉淀分离后,分别用70%和100%的冷乙醇洗涤及干燥,每份RNA样本充分溶解于50 μl的去除RNA酶的三蒸水中,部分采取酶标仪测定吸光度并计算RNA浓度及含量;部分应用琼脂糖RNA电泳检测样本纯度;部分用于后续逆转录实验。
1.2.5cDNA合成 通过RNA样本浓度测定及计算,将2 μg的RNA样本于提前冰浴的灭菌灭酶离心管中与oligo(dT)混合,使用dd水将RNA定容至13.5 μl,并在70℃金属浴锅中反应5 min,迅速置于冰上静置2 min,轻柔震荡并离心,根据cDNA试剂盒说明书向反应体系中加入Buffer、DTT、Rnasin及逆转录酶,并于42℃金属浴锅中反应50 min,最后在95℃金属浴锅中反应5 min。
1.2.6PCR反应检测BCRP基因表达 于离心管中分别加入cDNA样本2 μl,前序及后序引物各1 μl,2×Master Mix 12.5 μl,应用三蒸水定容至25 μl。将上述混合体系在94℃下反应5 min。每个PCR循环包括94℃ 45 s、55℃ 45 s,72℃ 60 s,72℃ 7 min。在BCRP(32循环)及β-actin(28循环)PCR反应结束后,取10 μl PCR产物进行琼脂糖电泳,并应用EB染色,应用凝胶成像分析系统对电泳产物进行扫描、影像学分析、计算定量。以β-actin为内参基因,检测BCRP基因的相对表达量,与β-actin比例≥0.34即为BCRP阳性,PCR引物序列如表2。

表2 引物序列
1.2.7统计学处理 应用SPSS13.0软件进行分析,计量资料两两比较时应用t检验,两个及以上率或构成比的比较应用卡方检验,P<0.05代表差异有统计学意义。
2 结果
2.1 BCRP基因表达与AML临床表型的关系
2.1.1AML患者BCRP基因表达情况-质控 对AML患者骨髓有核细胞的RT-PCR产物进行琼脂糖电泳,EB染色后进行凝胶成像,部分样本组织的结果呈现如图1所示。可见泳道内未见明显的降解弥散区,无其他核酸物质污染,提示样本质量完好无污染,可进行后续BCRP基因相对表达量的计算,并对BCRP基因表达是否阳性进行鉴定。

BCRP:乳腺癌耐药蛋白;M:marker;10:空白对照;1-9:AML患者骨髓有核细胞
2.1.2BCRP基因表达情况-mRNA表达量 20名AML患者骨髓中提取出的单个核细胞,应用RT-PCR方法检测到BRCP的mRNA相对表达量,由低到高进行梯度排序,可见BCRP基因在不同个体中的表达差异较大,具体结果见图2。

BCRP:乳腺癌耐药蛋白;1-20:AML标本
2.1.3BCRP基因表达与AML临床表型的关系-耐药率 AML患者中,敏感组(n=9)BCRP阳性者为2例,治疗耐药组(n=11)中BCRP阳性5例,结果显示治疗耐药组的BCRP阳性率较敏感组有增高趋势但没有统计学差异(45.4% vs 22.2%,P=0.2785)。见表3。对本研究临床资料及数据的分析显示,BCRP在个体中表达量差异较大、mRNA的相对表达水平高低不同,但对RNA表达量的排序图中发现可能的趋势,即敏感组中BCRP表达较低,而耐药组较高,提示BCRP可能与临床耐药有关,统计学没有差异是与样本例数较少有关。

表3 AML患者不同组BCRP阳性率
2.2 细胞存活率检测
2.2.1不同浓度柔红霉素对AML细胞存活率的影响 通过MTT法检测细胞存活率,并计算柔红霉素对AML患者骨髓单个核细胞的抑制率。结果显示,柔红霉素对AML患者的单个核细胞抑制率存在个体差异,但总体上药物对细胞的抑制存在浓度依赖性,高浓度的药物对细胞抑制率高于低浓度,其中2倍PPC柔红霉素作用下抑制率为(33.87±16.36)%,0.125倍PPC柔红霉素作用下抑制率为(16.36±18.37)%,差异有统计学意义(P=0.0029)。见图3。
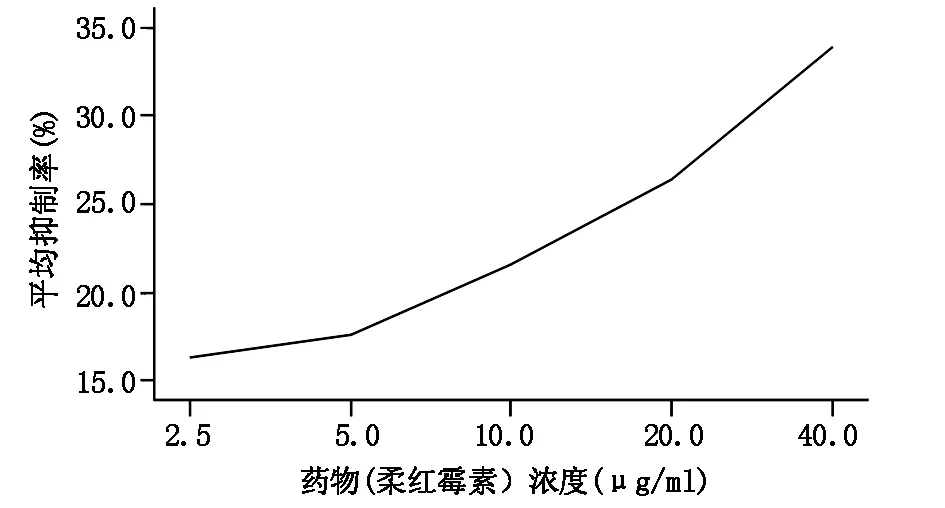
图3 不同药物浓度下的平均抑制率
2.2.2BCRP表达与细胞抑制率的比较 对BCRP表型不同的AML患者骨髓细胞的抑制率进行分析,结果显示在0.125倍PPC柔红霉素作用下,BCRP阴性组的细胞抑制率显著高于BCRP阳性组的细胞抑制率[(24.09±18.68)% vs (1.99±0.80)%,P=0.001)]。在2倍PPC柔红霉素作用下,BCRP阴性组的抑制率也显著高于BCRP阳性组的抑制率[(39.26±15.25)% vs (20.58±3.67)%,P=0.002)],如表4。上述结果提示,AML患者BCRP阳性表达,会使肿瘤具有对抗肿瘤药物有耐药的趋势,且此趋势与抗肿瘤药物浓度无关。

表4 不同BCRP表达与细胞抑制率的比较
3 讨论
急性髓系白血病是一种侵袭性克隆性疾病,是一种基因杂合性疾病,临床治疗中部分AML患者会因为多重耐药而导致肿瘤耐药、复发、预后不良。MDR是指恶性肿瘤细胞接触一种抗癌药后,对多种结构不同、作用机制各异的其他抗癌药产生耐药性。MDR目前的具体病理生理学机制尚未被完全阐明,当前被发现的可能机理包括多药耐药基因扩增及其蛋白产物P-糖蛋白过表达(P-gp),并且可能与B淋巴细胞瘤2(Bcl-2)通路、多药耐药相关蛋白(MRP)以及肺耐药相关蛋白(LRP)等诸多因素相关[4]。
Doyle等[5]在人乳腺癌细胞株MCF-7/Adrvp细胞中首次发现了一段2.4kb mRNA,翻译出具有665个氨基酸残基的跨膜蛋白,并将其命名为BCRP。BCRP本质上是半转运蛋白,是ATP结合盒G2转运蛋白(ABCG2),其功能单位是同型二聚体或可能更大的寡聚体。近些年的研究发现BCRP在肿瘤细胞发生MDR中起到了重要作用,该基因的高表达与甲氨蝶呤、9-氨基喜树碱、拓扑替康、伊立替康和SN-38耐药相关[6],是一个独立的危险因素[7]。一项针对新诊断急性白血病患者的研究中显示,BCRP基因阴性表达患者的完全缓解率明显高于BCRP 基因阳性表达患者的完全缓解率(79.3% vs 31.6%)[8]。在一项针对AML患者膜排出通道的研究发现,352例初发AML中有64例白血病细胞具有特殊的膜排出通道,伴有BCRP高表达,提示BCRP所介导的ATP依赖性的药物细胞外转运增加是这类患者发生耐药的可能机制[9]。
研究显示33%的AML细胞会高表达BCRP,与患者的预后及总生存相关,然而BCRP表达与AML发生率相关性暂无报道[10]。在急性淋巴细胞白血病中,不同研究中对BCRP表达和药物治疗反应相关性的结论不一致,可能与不同研究中BCRP检测方法、样本大小或患者是否有合并症相关。目前认为BCRP基因高表达是AML不良预后的预测因素,与白血病细胞的MDR密切相关[11]。
本研究纳入了20例AML患者,根据治疗是否敏感、对抗肿瘤药物是否耐药、是否复发等临床表型对AML患者进行分组,应用RT-PCR及流式细胞术检测骨髓细胞中BCRP的基因及蛋白表达,应用MTT检测细胞抑制率。结果发现,BCRP基因及蛋白的表达与耐药有相关性,且BCRP阳性与AML患者细胞抑制率降低有关。
既往一项研究对不同亚型AML患者的BCRP基因表达水平进行研究,发现AML各亚型间BCRP基因表达水平无统计学差异[12]。本研究结果与前述结果一致,在不同AML分型中,M2型BCRP平均表达水平最低,M5 型BCRP平均表达水平最高,各个亚型之间BCRP基因表达无显著差异,这也可能与该研究纳入的病例数量较少相关。
综上,本研究结果提示了BCRP高表达可能与AML耐药及预后不良有关,尽管BCRP这种作用的具体信号途径及机制尚有待探讨,但BCRP通路抑制仍被认为是提高药效的药理学策略。对BCRP的进一步研究有助于揭示肿瘤耐药的内在机理,深入研究BCRP通路以及通过抑制BCRP通路减少药物细胞外转运、增加细胞内药物浓度,值得不断挖掘开发与探索。
