下一代测序鉴定新等位基因HLA-DQB1*04:74和HLA-DRB1* 07:01:23序列及家系调查
2021-10-28武君华王满妮王天菊王小芳尚利侠
武君华,王满妮,王天菊,王小芳,尚利侠,陈 乐,房 婕,齐 珺
(西安市中心血站,陕西 西安710061)
人类对主要组织相容性复合物(MHC)的研究起源于同种异体组织器官移植和移植物的急性排斥反应。人类的MHC称为白细胞抗原(HLA)系统。HLA主要的遗传特征是共显性、多基因性和极度丰富的多态性。1958年第一个HLA抗原被检出,经过数十年的发展,相关工作者一直努力应对 HLA不断扩大的等位基因数量。截至2020年4月更新的国际免疫遗传IMGT/HLA数据库3.40.0版(http//:www.ebi.ac.uk/imgt/hla/stats.html)显示,共计发现HLA-A座位等位基因6082种,B座位等位基因7255种,C座位等位基因5842种,DRB1座位等位基因2706种,DQB1座位等位基因1826种。本中心在2018-2019年对移植医院造血干细胞供受者进行HLA移植配型实验中,发现2例供受者携带疑似新等位基因。经确证实验验证后将序列上传至世界基因库(http:www.ncbi.nlm.nih.gov/Genbank Bankit)比对核准,在向世界卫生组织(WHO)提交一系列信息后,均被确认为新等位基因,现报道如下。
1 材料和方法
1.1 研究对象
2018-2019年来西安市中心血站高分确认实验室进行造血干细胞移植(HSC)前HLA高分辨分型检测过程中,分别发现 2例供受者携带疑似新等位基因。第1例先证者为患者,56岁,女性,临床诊断为骨髓纤维化;第2例先证者为另一名患者的同胞哥哥,63岁,男性。在进行HLA-A、B、C、DRB1、DQB1位点基因分型时,发现第1例先证者的HLA-DRB1位点、第2例先证者的HLA-DQB1位点分型结果异常,遂行进一步确认。
1.2 主要仪器
核酸自动提取仪(台湾Magcore HF16);GeneQuant pro核酸检测仪(美国GE公司 Biochrom);PCR扩增仪(德国SENSO公司 Sensoquest LabcycLer;美国MJ Research 公司 PCR-225;美国ABI公司 ABI9700);流式微磁珠分析仪(美国Luminex公司 Luminex 200);全自动基因测序分析仪(美国ABI公司 ABI-3730xl);ION S5TM测序仪(美国One Lambda公司)
1.3 主要试剂

1.4 方法
1.4.1标本采集和基因组DNA提取 采集2例先证者外周静脉抗凝血5 ml×2管。在发现2例先证者结果异常后,分别对先证者血样重新采集抽提DNA并进行确认:一管血样采用手工DNA提取试剂盒,按照试剂操作说明提取基因组DNA;另一管血样用核酸自动提取仪,严格按照仪器操作说明提取基因组DNA。
1.4.2聚合酶链式反应-序列特异性寡核苷酸探针(PCR-SSO)方法检测 PCR-SSO采用LABTypeTMRSSOH 1A/1B/1C/2B1/2Q试剂盒,严格按照说明书对2例样本的HLA-A、B、C、DRB1、DQB1位点进行基因分型。即经PCR扩增,扩增产物与包被在微珠上的有荧光的特异性探针杂交结合后,通过Luminex IS-200流式微磁珠分析仪进行读板,应用 Fusion4.1软件进行判读。

1.4.4高通量测序(NGS)(ION S5TM测序平台) 采用NXTypeTMNGS试剂盒,严格按照说明书分别对第1例样本的I1-5’UTR全长序列和第2例样本的3’UTR-5’UTR全长序列进行特异性扩增、定量、文库构建、乳化PCR产物等,最后上ION S5TM测序仪进行测序,将所得序列用TypeStream VisualTMNGS Analysis Software软件进行数据处理和分析。
1.4.5单链测序方法 根据PCR-SBT结果,针对需要做的位点选择相应的单链扩增引物进行扩增并测序,严格按照说明书分别对第1例样本的HLA-DRB1*07位点、第2例样本的HLA-DQB1*03和HLA-DQB1*04位点进行单链测序反应,并对结果进行分析。
2 结果
2.1 常规PCR-SSO/SBT分型结果第1例先证者PCR-SSO分型结果无异常探针反应。PCR-SBT分型结果分别为HLA-A*02:01,30:01;B*13:02,15:02;C*06:02,08:01;B1*02:02,03:01;DRB1位点相对于DRB1*07:01,12:02序列在第2外显子237位有1个碱基不匹配,由碱基G>R(A+G),二次复核无改变。结果见图1。第2例先证者PCR-SSO分型结果无异常探针反应。PCR-SBT分型结果分别为HLA-A*11:01,24:02;B*13:01,15:01;C*03:04,04:01;DRB1*04:05,04:06。DQB1位点相对于DQB1*03:02,04:01的基因序列,在第2外显子256位有1个碱基不匹配,由碱基G>R(A+G),经两次复核无改变。结果见图2。
2.2 NGS及单链测序确证结果分别应用NGS及单链测序方法对第1例先证者的HLA I1-5’UTR全长序列、DRB1*07单链进行测序,两种方法均证实DRB1*07序列在第2外显子237位发生了G>A碱基突变,结果见图3(NGS)、图1。分别应用NGS及单链测序方法对第2例先证者的HLA3’UTR-5’UTR全长序列、DQB1* 04单链进行测序,两种方法均证实DQB1*04序列在第2外显子256位发生了G>A碱基突变,结果见图4(NGS)、图2。
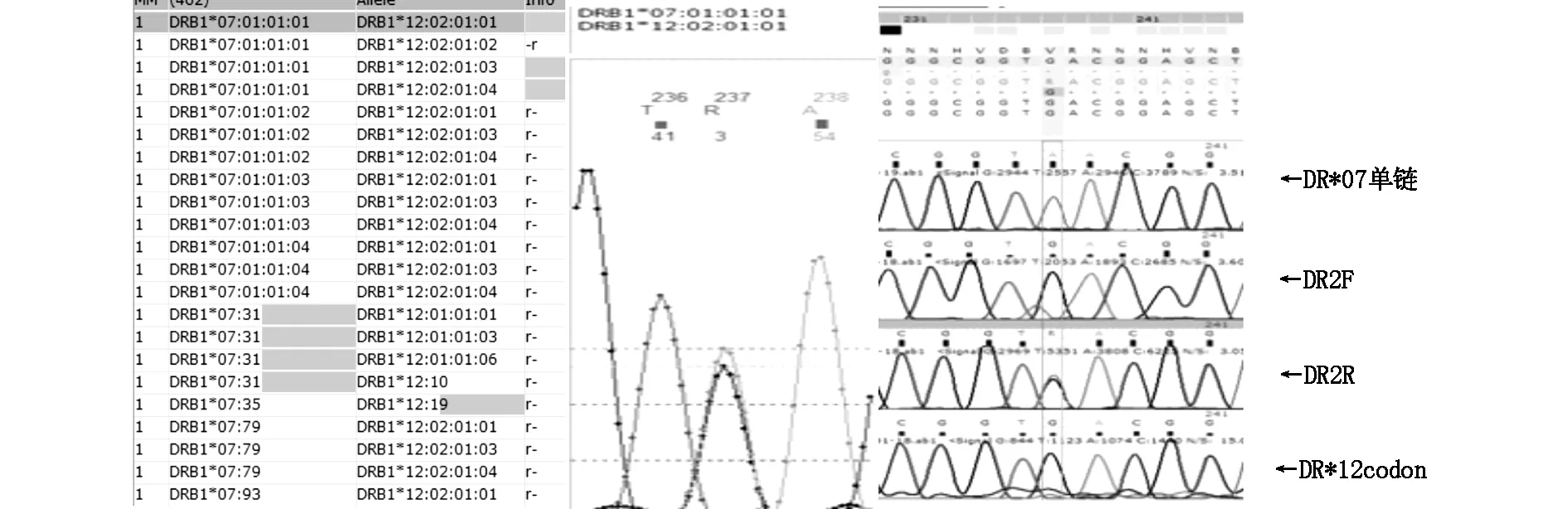
图1 第1例先证者DRB1位点测序结果
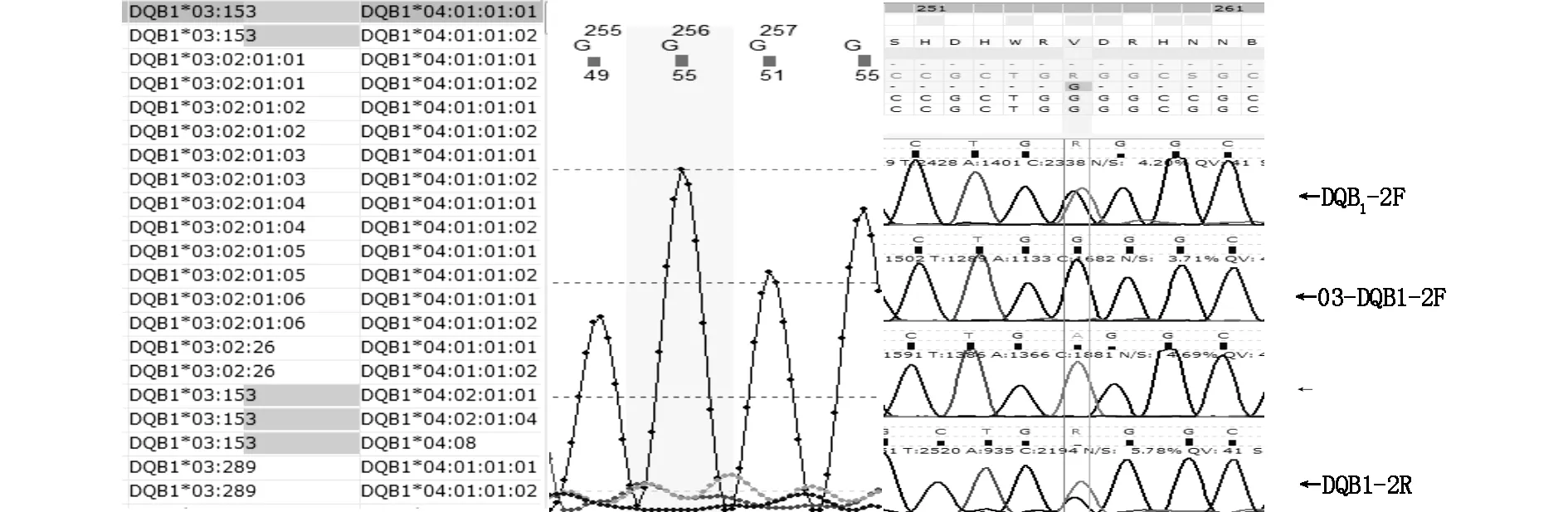
图2 第2例先证者DQB1位点测序结果

图3 第1例先证者NGS测序结果
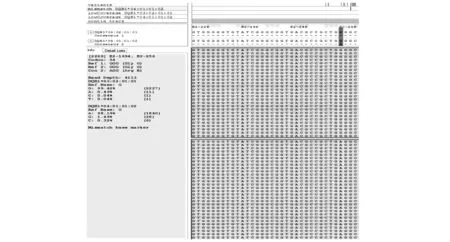
图4 第2例先证者NGS结果
2.3 家系调查分析根据基因测序分型结果,在征得本人知情同意后,对与第1例先证者有姐妹关系的两位供者及其女儿进行HLA-DRB1位点测序分析,结果显示两位姐妹的HLA-DRB1结果均为04:03,12:02;其女儿的HLA-DRB1结果为12:02,14:04,可以判定先证者的HLA-DRB1*12:02遗传于父母,但由于无法获取先证者父母血样,所以HLA-DRB1*07的突变是直接来自于父母遗传还是自身突变有待考证;其女儿的HLA-DRB1* 12:02遗传自先证者,突变未遗传给其女儿。先证者4位家庭成员的分型结果见图5。第2例先证者因个人原因只有先证者及其同胞患者兄妹两人进行HLA分型实验,且其同胞患者分型结果与之全不相合,未能进行家系遗传情况分析。

注:黑色为先证者
2.4 新等位基因与同源性最高的等位基因序列比对及命名经BLAST比对,发现第1例先证者的未知基因序列与其同源性最高的DRB1*07:01:01相比,第2外显子第79位密码子由GTG>GTA,编码的氨基酸由缬氨酸Val(v)>缬氨酸Val(v),为同义突变。新基因与DRB1*07:01:01的核苷酸及氨基酸比对见图6。第2例先证者的未知基因序列与同源性最高的等位基因DQB1* 04:01:01相比,未知基因第2外显子第86位密码子由GGG>AGG,编码的氨基酸由甘氨酸Gly(G)>精氨酸Arg(R),为非同义突变。新基因与DQB1*04:01:01的核苷酸及氨基酸比对见图7。将2例先证者所检测序列上传至Genbank后分别获得的Bankit ID(MN295058)和(MN295056)及相关数据提交给WHO HLA因子命名委员会,被正式命名为HLA-DRB1* 07:01:23(HWS10056299)和HLA-DQB1* 04:74(HWS10056295)。

图6 HLA-DRB1*07:01:23与HLA-DRB1*07:01:01:01的核苷酸(部分)及氨基酸序列比对图

图7 HLA-DQB1*04:74与HLA-DQB1*04:01:01:01的核苷酸(部分)及氨基酸序列比对图
3 讨论
人类HLA基因位于人类第6号染色体的短臂(6p21.31),DNA片段长度约为3 600 kb,占人基因组的1/3000。一般按HLA复合体在染色体上的排列分为HLA-Ⅰ类、HLA-Ⅱ类和HLA-Ⅲ类3个区。经典的HLA基因位于HLA复合体的HLA-Ⅰ类区和HLA-Ⅱ类区内,与移植排斥反应和合成蛋白质抗原功能有密切关系。为HLA-Ⅰ类分子α链编码的Ⅰ类基因和为HLA-Ⅱ类分子的β链编码的B基因是目前已知的多态性最为丰富的HLA基因。
随着聚合酶链反应(PCR)扩增技术和测序技术的应用,HLA分型实验已经由开始的血清学、细胞学阶段提升到更为精确的分子生物学阶段。目前,应用于HLA检测的主要技术有PCR-SSP、PCR-SSO、DNA测序、基因芯片等[1]。PCR-SSO技术具有灵敏度高、特异性强、所需样本量少等特点,适合大批样本的 HLA分型初筛。但其无法直接反映基因序列,如果在阴性和阳性磁珠上的探针荧光强度处于临界值,则可能出现结果误判[2-5]。基于测序的SBT检测方法能够直接从碱基水平得到HLA的等位基因序列,原始数据的准确率高达99%[6],是目前HLA分型检测公认的金标准,具有高通量、高分辨率的特点[7-8]。但是由于HLA基因的多态性、等位基因的同源性和实际测序区域的限制性(两个或多个等位基因在所检测区域序列一致、该测定区域存在多种等位基因组合或者两者差异在所检测区域之外等)等,HLA每个位点等位基因的数量逐年增多,模棱两可结果的比例也随之增高。当出现罕见等位基因或无完全匹配结果时,在排除实验原因后,可能提示疑似新等位基因,尤其出现不可修改的单峰变双峰或杂合峰 A 变杂合峰 B情况时,应高度怀疑新等位基因。此类结果的解决方案一般包括换用其他方法(如高分辨PCR-SSP方法进行精确分型)、组特异性引物单链扩增、特异性引物测序、增加外显子测序范围、NGS等[9]。NGS能够在短时间内同时对上百亿碱基进行测序[10],等位基因漏失现象变的不太可能,也避免了PCR-SBT中的模棱两可,使得罕见型和新等位基因的鉴定相对容易。其测序成本相对较低,耗时相对较短,在工作量大、时间紧迫时相对于传统的一代测序分型有明显优势[11]。然而 NGS 测序仪器及配套产品需要进口,价格昂贵,各实验室需要结合自身的实际情况选择适合的测序方法。随着NGS成本的降低和准确度的提高,其分型技术正逐渐成为基因诊断领域的主导技术[12]。
本文中2例先证者样本在PCR-SSO检测基因分型时探针反应格局均正常,无异常探针反应,提示该方法针对已知等位基因设计的探针存在漏检新等位基因的风险。SBT是对DNA双链的双向测序,无法确定突变位于哪条DNA链上。为准确区分突变位置,进一步对第1例先证者的HLA-DRB1*07和第2例先证者的HLA-DQB1*03,-DQB1*04进行组特异性单链测序,并应用NGS进行测序确证。最终分别确定了新等位基因HLA-DRB1*07:01:23和HLA-DQB1*04:74的碱基序列,而新等位基因来源于家系遗传、个体突变或与疾病有关尚待研究。
目前国际上已检出HLA-DRB1*07位点136种,其中3种被列入中国CWD表(2.4版);已检出HLA-DQB1*04位点110种,其中4种被列入中国CWD表(2.4版)。DRB1*07、DQB1*04与疾病的相关性研究已有诸多报道。在多项对慢性乙型病毒性肝炎、乙型肝炎病毒后肝硬化、肝癌等的研究中,JiangYG[13]等报道提示HLA-DRB1*07可能为机体感染乙型肝炎病毒后慢性化持续性感染过程的危险因素;El-Chennawi等[14]研究发现,HLA-DRB1*07、DRB1*04为埃及肝癌发生的危险因子,而DRB1*15为其保护性因子。Lin等[15]进行的Meta分析证实DRB1*07、12是所有人群原发性肝癌的易感基因,而DRB1*15等位基因可能是亚洲人群肝癌的易感基因。另有研究提示,伊朗人中肺结核病与DRB1*07基因型密切相关[16]。一项对广西壮族女性HPV16感染和宫颈癌易感性的关联研究中发现HLA-DQB1*04等位基因是广西壮族女性宫颈癌发生的易感基因,而HLA-DQB1* 06/09则相反,是其保护基因[17]。中国人Ⅰ型糖尿病(DM1)的易感性单倍型是DQB1*0401,DQB1*0405也可能与DM1发病相关[18];DQB1*0402是摩洛哥人DM1的易感基因,而在牙买加人中,DQB1*0402 则与DM1疾病的保护有关[19]。以上文献均证实,HLA基因型与多种疾病的密切相关性,准确的HLA分型是研究和临床应用的基础。
随着NGS技术在HLA分型实验中的应用,使得新等位基因被有效识别并快速鉴定,其被发现的数量也必将大幅提升。新等位基因的发现丰富了世界基因库,增加了HLA系统多态性,为人类群体遗传和进化分析提供了宝贵的数据资料,并对临床移植配型、法医学亲子鉴定、个体识别、输血医学及相关性疾病研究提供了基本数据,具有重要意义。
