白杨黄素通过调控氧化应激反应保护脂多糖介导的炎症环境中人牙周膜干细胞成骨分化能力
2021-10-28夏冰洪滔
夏 冰 洪 滔
根尖周炎是一类发生于根尖周组织的炎症性疾病,主要是由于病原菌及相关代谢产物与宿主免疫系统相互作用而导致[1-2]。人牙周膜干细胞(hPDLSCs)是一组来源于牙周膜的间充质干细胞,具有分化为成骨细胞、成纤维细胞和牙齿成牙骨质细胞的多能性[3-4]。根尖周炎时,牙周优势菌脂多糖(LPS)对根尖周软硬组织造成不同程度的破坏,降低hPDLSCs 的成骨分化能力[5],然而其相关机制有待进一步研究。同时,研究发现活性氧(ROS)与骨代谢紊乱性疾病密切相关[6]。黄酮类小分子白杨黄素,化学名为5,7-二羟基黄酮,具有显著的抗病毒、抗过敏、抗肿瘤的作用[7]。研究证实,白杨黄素能够促进成骨细胞系MC3T3-E1 成骨分化相关基因的表达[8]。然而关于白杨黄素对炎症微环境下牙周膜干细胞的成骨分化的影响鲜有报道。P.g LPS 是革兰阴性细菌牙龈卟啉单胞菌细胞壁中具有特殊结构的脂质成分,为牙周病重要毒力因子,使牙周膜干细胞成骨能力降低[9]。本实验采用P.g LPS 模拟hPDLSCs 炎症氧化应激环境,通过检测ROS、抗氧化及成骨因子mRNA 表达水平,探讨白杨黄素对炎症环境状态下hPDLSCs 成骨分化能力的影响。
1 材料与方法
1.1 临床根尖周炎组织样本 选择2017 年8 月—2017 年12 月就诊于浙江省中西医结合医院牙体牙髓门诊的患者,其无全身系统性疾病,3 个月内未服用抗生素及抗氧化剂,反复进行完善的根管治疗后病变未愈合,且牙周探诊深度<3mm,无牙根纵裂,欲行根尖手术的单根牙20 颗。
1.2 主要试剂仪器 牙龈卟啉单胞菌脂多糖(P.g LPS,批号SMB00610,Sigma,美国);α-MEM 培养基(批号12492-013,Gbico 公司,美国);Ⅰ型胶原酶(批号17100-017,Invitrogen 公司,美国)、Dispase 酶(批号354235,HyClone 公司,美国);白杨黄素(纯度:≥98%,批号480-40-01,上海西格生物科技有限公司)、MTT 试剂盒(ALP,批号CGD-1,Sigma 公司,美国);碱性磷酸酶活性测试试剂盒(批号A059-2,南京建成生物工程研究所);Trizol(批号15596-026,Invitrogen 公司,美国);PrimeScriptTM RT 试剂盒(批号RR036A,TaKaRa,日本);SYBR-Green Real time PCR MIX(批号RR820A,TaKaRa,日本);酶标分析仪(1681130A,Bio-Rad,美国);倒置显微镜(IX73 荧光,Olympus 公司,日本);实时荧光定量PCR 仪(QuantStudio 7 Flex,赛默飞,美国)。
1.3 分离和培养hPDLSCs 征得患者知情同意,取根中1/3 牙周膜组织,加入3g/L 的Ⅰ型胶原酶和4g/L的Dispase 酶,37℃消化1h。终止消化,将分离的细胞平铺于6 孔板中,加入含10%胎牛血清的α-MEM培养液2mL,37℃、体积分数5%CO2孵箱中,静置培养。每3 天换液1 次,弃去未贴壁的细胞。待细胞铺满6 孔板底80%后,传代,实验均取第4~7 代细胞进行后续实验。
1.4 成脂诱导 将1×105个hPDLSCs 接种在6 孔培养皿中,次日换成脂诱导液(100nmol/L 地塞米松、10mg/L 胰岛素、0.5mmol/L 3-异丁基-1-甲基黄嘌呤、50mmol/L 吲哚美辛、α-MEM 培养基)进行诱导,每3 天换液1 次。21 天后进行油红染色,倒置显微镜下观察是否有脂滴形成。
1.5 成骨诱导 将1×105个hPDLSCs 以成骨诱导液(含50mg/L 抗坏血酸、1μmol/L 地塞米松、3mmol/L β甘油磷酸钠)培养。每3 天换液1 次。连续诱导21 天后进行茜素红染色,观察矿化结节形成。
1.6 流式细胞术鉴定hPDLSCs 表面标记物 取第4代hPDLSCs,细胞密度调至2×109/L;将细胞分装于EP 管中,加入相应的抗体2μL,室温避光孵育1h,离心弃上清后冷PBS 洗3 次,用500μL 含10%胎牛血清的PBS 重悬,4℃避光保存。用流式细胞仪检测Stro-1、CD146、CD29、CD105、CD34、CD45 表面标记物的表达情况。
1.7 MTT 检测不同浓度P.g LPS 及白杨黄素对hPDLSCs 增殖活力的影响 将第4 代hPDLSCs,以3×103个/孔接种于96 孔板,常规培养条件下培养24h 后,对照组细胞用α-MEM 培养基培养,P.g LPS组分别加入1、10、100、1000ng/mL P.g LPS 的α-MEM 培养基继续培养24、48、72、96h。此外,白杨黄素对hPDLSCs 增殖活力的影响,细胞以3×103个/孔的密度接种于96 孔板24h 后,用白杨黄素(0.1、0.4、1.6、6.25、25、50、100μmol/L)分别作用细胞48、96h。各组到达实验时间节点后,加入MTT,孵育4h 后加入DMSO 溶解结晶,并室温下振荡15min,于酶标仪检测OD 值,取5 孔平均值进行分析。
1.8 白杨黄素对P.g LPS 介导hPDLSCs 的ROS 及抗氧化应激因子表达的影响 将第4 代细胞按1×105个/孔接种于6 孔板常规培养至贴壁。贴壁后,将常规培养液置换为成骨诱导液,将细胞分为成骨诱导组及1000ng/mL P.g LPS+成骨诱导组。诱导培养24、48、72、96h 后,取细胞培养液按ROS 检测试剂盒的使用说明检测ROS 的含量。收集细胞,提取RNA,q-PCR 检测锰超氧化物歧化酶(MnSOD),铜锌超氧化物歧化酶(Cu/ZnSOD)和过氧化氢酶(CAT)mRNA表达。在此研究基础上,将第4 代细胞按1×105个/孔接种于6 孔板常规培养至贴壁。将常规培养液更换为成骨诱导液,将细胞分为成骨诱导组:10% FBS 的成骨诱导液普通条件培养;P.g LPS+成骨诱导液组:1000ng/mL P.g LPS 的10% FBS 的成骨诱导液培养组;白杨黄素+成骨诱导液+P.g LPS 组:25μmol/L 白杨黄素+1000ng/mL P.g LPS 的10% FBS 的成骨诱导液培养液,作用72h 后,再次检测白杨黄素对P.g LPS 介导hPDLSCs 的ROS 及抗氧化应激因子表达。
1.9 白杨黄素对P.g LPS 介导hPDLSCs 的ALP 活性及成骨分化因子表达的影响 将第4 代细胞按1×105个/孔接种于6 孔板常规培养至贴壁。将细胞分为三组,分别为常规10% FBS 的α-MEM 培养液培养组;10% FBS 的成骨诱导液培养组;1000ng/mL P.g LPS 的10% FBS 的成骨诱导液培养组。分别于第3、7、14 天按ALP 活性检测试剂盒的使用说明检测ALP 活性。收集细胞,提取细胞总RNA,q-PCR 检测细胞Runt 相关转录因子2(RUNX2)、锋指结构转录因子(OSX)、ALP 和骨钙素(OCN mRNA)表达。在此研究基础上,将第4 代细胞按1×105个/孔接种于6孔板常规培养至贴壁。将常规培养液更换为成骨诱导液,将细胞分为成骨诱导组:10% FBS 的成骨诱导液普通条件培养;P.g LPS+成骨诱导液组:1000ng/mL P.g LPS 的10% FBS 的成骨诱导液培养组;白杨黄素+成骨诱导液+P.g LPS 组:25μmol/L 白杨黄素+1000ng/mL P.g LPS 的10% FBS 的成骨诱导液培养液,作用72h 后,再次检测白杨黄素对P.g LPS介导hPDLSCs 的ALP 活性及成骨分化因子表达。
1.10 q-PCR 以Trizol 试剂提取P.g LPS 或白杨黄素处理细胞总RNA,按照反转录试剂盒说明书将RNA 反转录成互补脱氧核糖核酸(complementary DNA,cDNA),然后按试剂说明书进行PCR 扩增,反应在实时荧光定量PCR 仪上进行。PCR 反应条件为预变性95℃,0.5min,1 个循环;变性95℃,0.05s,退火60℃,34s,延伸95℃,0.15s,共40 个循环,终延伸60℃,1min。之后采用2-ΔΔCt法计算目的基因MnSOD、Cu/ZnSOD、CAT、RUNX2、OSX、ALP、OCN 相 对 表 达量,各基因引物序列由生工生物工程(上海)股份有限公司合成,见表1。

表1 实时荧光定量PCR 引物序列
1.11 统计学方法 应用SPSS 22.0 软件对所得数据进行统计分析,数据采用均数±标准差(±s)表示。两组间比较采用两个独立样本的LSD-t 检验,多组间样本比较应用单因素方差分析(One-way ANOVA)进行统计分析;P<0.05 认为差异有统计学意义。
2 结果
2.1 流式细胞术检测hPDLSCs 采用酶解组织消化培养的原代细胞,3~7 天即有细胞由组织周围爬出。进一步以有限稀释法获得较为纯化的hPDLSCs。该细胞呈纺锤型,旋涡状生长。成脂诱导21 天,发现红色脂滴(见图1A)。成骨诱导21 天后,茜素红染色hPDLSCs 形成红色矿化结节(见图1B)。流式细胞仪结果显示,第4 代hPDLSCs 表面抗原Stro-1、CD146、CD29、CD105 均为阳性,CD34、CD45 均为阴性(见图1C)。

图1 分离和鉴定牙周膜干细胞
2.2 P.g LPS 对hPDLSCs 增殖能力的影响 MTT 结果显示,与对照组比较,1000ng/mL P.g LPS 在作用72、96h 后,hPDLSCs 增殖能力随之减弱(P 均<0.05)。因此,本研究选用1000ng/mL P.g LPS 作用hPDLSCs 进行后续实验。见表2。
表2 P.g LPS 对hPDLSCs 增殖能力的影响(OD 值,±s)
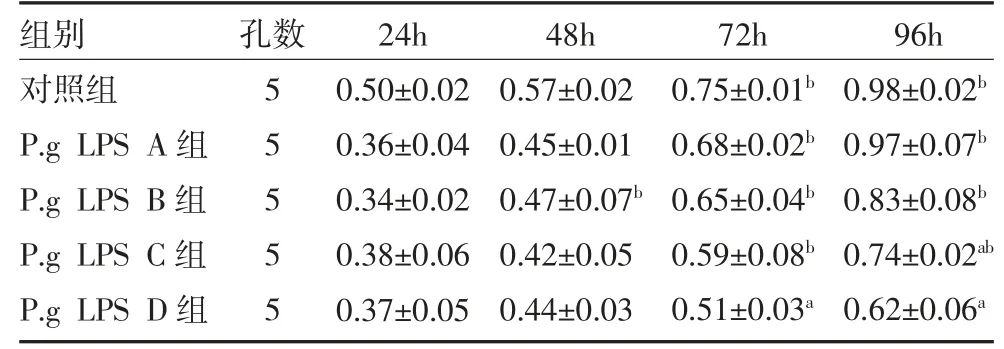
表2 P.g LPS 对hPDLSCs 增殖能力的影响(OD 值,±s)
注:对照组为PBS 处理24h;P.g LPS A 组为1ng/mL P.g LPS 分别处理24、48、72、96h;P.g LPS B 组为10ng/mL P.g LPS 分别处理24、48、72、96h;P.g LPS C 组为100ng/mL P.g LPS 分别处理24、48、72、96h;P.g LPS D 组为1000ng/mL P.g LPS 分别处理24、48、72、96h;P.g LPS为牙龈卟啉单胞菌脂多糖;hPDLSCs 为人牙周膜干细胞;OD 为光密度;与对照组同期比较,aP<0.05;与同组作用24h 时比较,bP<0.05
2.3 白杨黄素对hPDLSCs 活力的影响 与白杨黄素对照组比较,50 和100μmol/L 的白杨黄素处理hPDLSCs 48、96h 后显著降低hPDLSCs 增殖活性(P均<0.05);因此,本研究选用25μmol/L 的白杨黄素处理hPDLSCs 进行后续实验,见表3。
表3 白杨黄素对hPDLSCs 细胞活力的影响(%,±s)
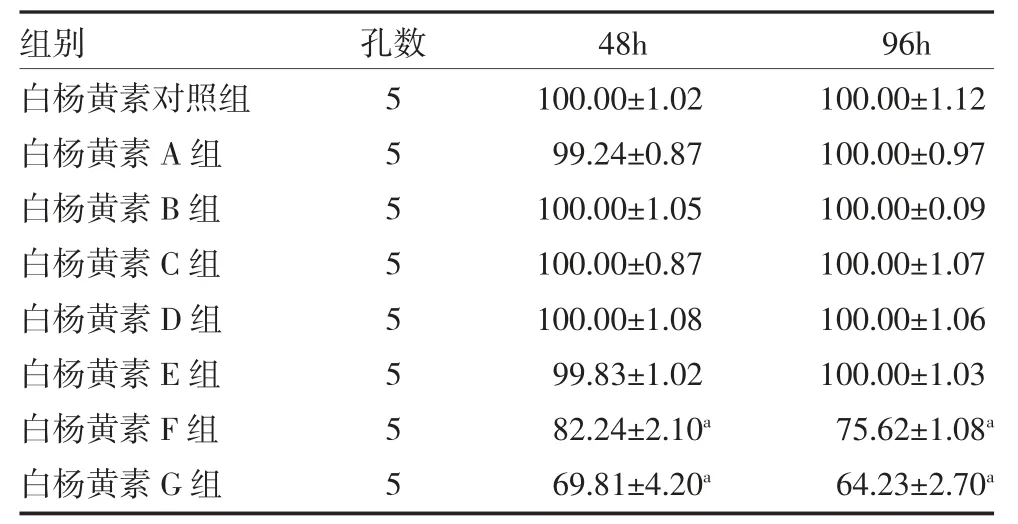
表3 白杨黄素对hPDLSCs 细胞活力的影响(%,±s)
注:白杨黄素对照组为PBS 分别处理48、96h;白杨黄素A 组为0.1μmol/L 白杨黄素分别处理48、96h;白杨黄素B 组为0.4μmol/L白杨黄素分别处理48、96h;白杨黄素C 组为1.6μmol/L 白杨黄素分别处理48、96h;白杨黄素D 组为6.25μmol/L 白杨黄素分别处理48、96h;白杨黄素E 组为25μmol/L 白杨黄素分别处理48、96h;白杨黄素F 组为50μmol/L 白杨黄素分别处理48、96h;白杨黄素G 组为100μmol/L 白杨黄素分别处理48、96h;与白杨黄素对照组比较,aP<0.05
2.4 白杨黄素对P.g LPS 介导hPDLSCs 氧化应激的影响 ROS 含量检测结果显示,与成骨诱导液培养细胞比较,P.g LPS 作用的细胞ROS 含量显著升高,差异有统计学意义(P<0.05);MnSOD、Cu/ZnSOD和CAT mRNA 表达水平在72、96h 明显降低(P<0.05),见表4。
表4 P.g LPS 介导hPDLSCs 的ROS、MnSOD、Cu/ZnSOD 和CAT mRNA 表达的影响(±s)
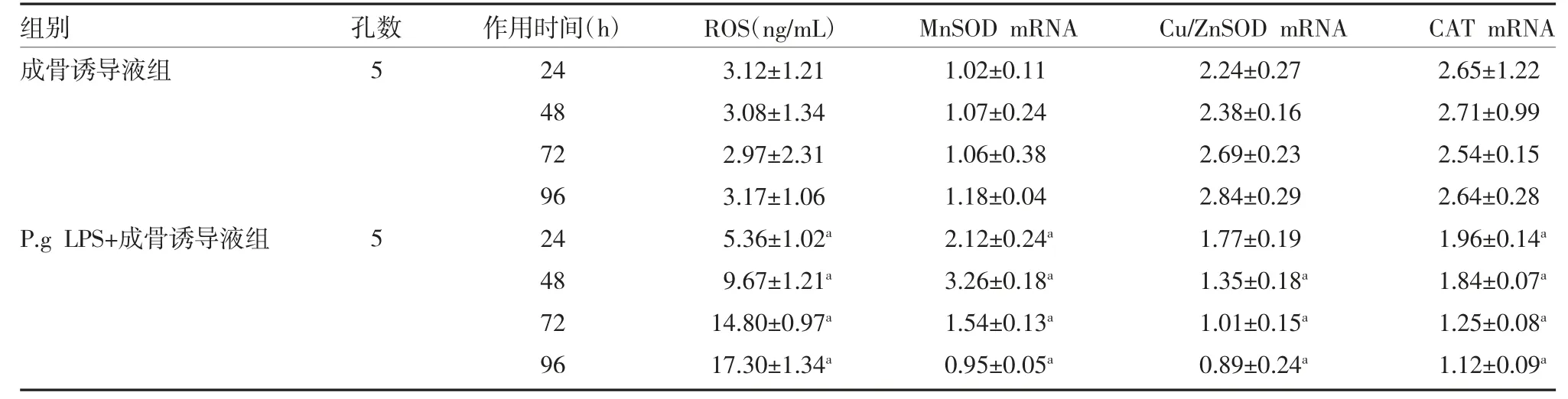
表4 P.g LPS 介导hPDLSCs 的ROS、MnSOD、Cu/ZnSOD 和CAT mRNA 表达的影响(±s)
注:ROS 为活性氧;MnSOD 为锰超氧化物歧化酶;Cu/ZnSOD 为铜锌超氧化物歧化酶;CAT 为过氧化氢酶;与成骨诱导液组同期比较,aP<0.05
此外,P.g LPS+成骨诱导液+白杨黄素组与P.g LPS+成骨诱导液组比较,白杨黄素显著逆转氧化应激因子的表达(P 均<0.05)。见表5。
表5 白杨黄素对P.g LPS 介导hPDLSCs 的ROS、MnSOD、Cu/ZnSOD 和CAT 表达的影响(±s)

表5 白杨黄素对P.g LPS 介导hPDLSCs 的ROS、MnSOD、Cu/ZnSOD 和CAT 表达的影响(±s)
注:ROS 为活性氧;MnSOD 为锰超氧化物歧化酶;Cu/ZnSOD 为铜锌超氧化物歧化酶;CAT 为过氧化氢酶;与成骨诱导液组比较,aP<0.05;与P.g LPS+成骨诱导液组比较,bP<0.05
2.5 白杨黄素对P.g LPS 介导的hPDLSCs 成骨分化的影响 在成骨诱导液作用hPDLSCs 第7、14 天,ALP mRNA 检测结果显示,成骨诱导液组ALP 含量显著高于α-MEM 培养液组(P<0.05);与成骨诱导液组比较,P.g LPS+成骨诱导液组ALP mRNA 显著降低(P<0.05)。PCR 结果显示,与α-MEM 培养液组比较,3、7、14 天成骨诱导液组RUNX2、OSX、OCN 和ALP 活性表达水平显著升高(P 均<0.05);P.g LPS+成骨诱导液组RUNX2、OSX、OCN 和ALP 活性表达水平显著低于成骨诱导液组(P 均<0.05)。见表6。
表6 P.g LPS 介导hPDLSCs 对成骨分化基因表达水平的影响(±s)
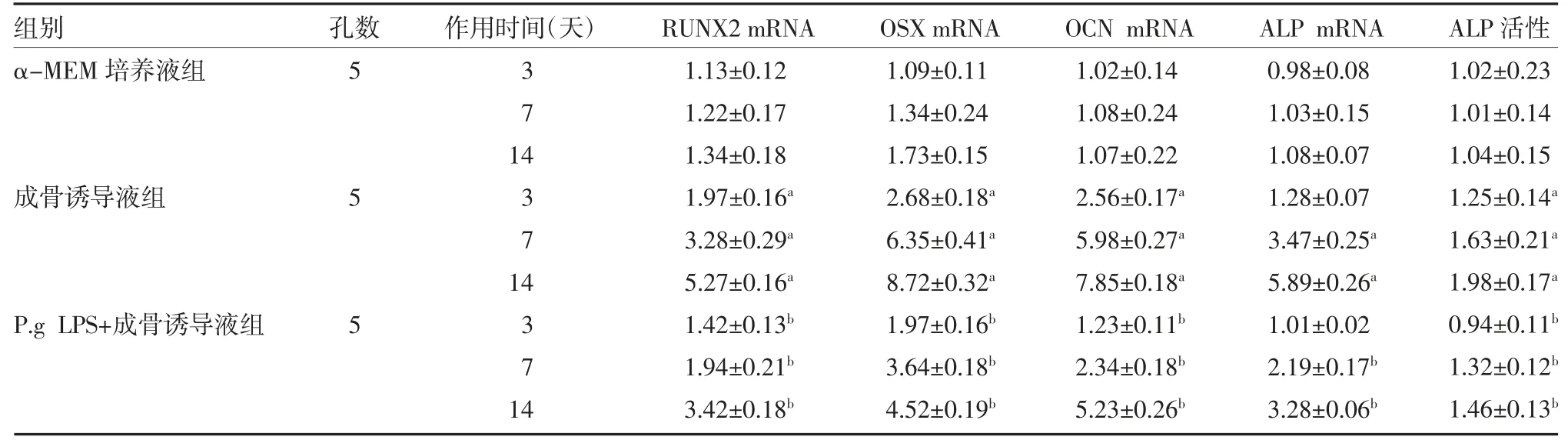
表6 P.g LPS 介导hPDLSCs 对成骨分化基因表达水平的影响(±s)
注:RUNX2 为Runt 相关转录因子2;OSX 为锌指结构转录因子;ALP 为碱性磷酸酯酶;OCN 为骨钙素;与α-MEM 培养液组比较,aP<0.05;与成骨诱导液组比较,bP<0.05
与P.g LPS+成骨诱导液组比较,P.g LPS+成骨诱导液+白杨黄素组RUNX2 和OSX mRNA 表达显著升高(P 均<0.05),OCN 和ALP mRNA 表达水平,虽呈现一定的升高趋势但差异无统计学意义(P>0.05)。见表7。
表7 白杨黄素对P.g LPS 介导的hPDLSCs 细胞RUNX2、OSX、OCN、ALP mRNA 表达水平的影响(±s)

表7 白杨黄素对P.g LPS 介导的hPDLSCs 细胞RUNX2、OSX、OCN、ALP mRNA 表达水平的影响(±s)
注:RUNX2 为Runt 相关转录因子2;OSX 为锌指结构转录因子;ALP 为碱性磷酸酯酶;OCN 为骨钙素;与成骨诱导液组比较,aP<0.05;与P.g LPS+成骨诱导液组比较,bP<0.05
3 讨论
根尖周炎是口腔中常见的炎症性骨疾病。研究显示,根尖周炎发病过程中牙槽骨的损伤程度与ROS 水平密切相关[10]。ROS 是细胞呼吸代谢过程中产生的一类含有超氧离子化学物的总称,化学性质活泼。在细菌感染过程中,宿主细胞会产生大量ROS,在机体细胞信号传导、组织代谢以及炎症性疾病的组织损伤过程中发挥着关键作用[11]。一方面O2-、H2O2和NO 等超氧离子的产生能够调控宿主体内的免疫细胞识别、消灭病原菌,成为宿主抵抗病原菌感染的关键分子;另一方面它们通过直接氧化病损区正常组织细胞内的蛋白质、DNA、RNA 及细胞膜内的脂质成分从而破坏细胞结构、抑制线粒体功能等途径间接激活细胞内的凋亡信号通路,导致细胞凋亡,从而造成病损区的组织氧化损伤[12]。随着根尖周炎病程的发展,效应细胞内线粒体功能出现紊乱,导致机体应激性地上调效应细胞内ROS 的水平,对牙周软硬组织造成严重破坏[13-14]。研究表明,患者通过牙周基础治疗有效改善牙周状况的同时,患者血浆中ROS 水平将会显著下降[15],进一步提示ROS 与根尖周炎病损区的骨组织损伤密切相关。因此,我们推测在根尖周炎疾病的发生发展过程中ROS 是重要的炎症介质,有效清除过量的ROS 在根尖周炎的损伤修复中可能发挥了重要作用。
hPDLSCs 为牙周组织中的成体干细胞,其在外界刺激或疾病状态下,通过不断增殖分化维护牙周组织稳态及骨再生修复。在本研究中,应用P.g LPS处理hPDLSCs,发现1000ng/mL 的P.g LPS 作用hPDLSCs 72 和96h 后均显著降低细胞增殖活性;另一方面,随着作用时间增长,P.g LPS 显著增加hPDLSCs 的ROS 含量水平,及显著地降低MnSOD、Cu/ZnSOD、CAT、RUNX2、OSX、OCN 和ALP mRNA表达水平。此外,MnSOD、Cu/ZnSOD 和CAT 被认为是机体清除ROS 的重要调节酶[16]。RUNX2 是骨形成的核心基因,是间充质干细胞成骨分化的重要指标[17]。OSX 与成骨细胞分化和骨形成相关的特异性转录因子,只在发育的骨组织中特异性表达[18]。OCN 为存在于骨组织中丰富的非胶原蛋白,是骨代谢及骨细胞活性的特异性指标,其表达量反映骨形成的速率[19]。ALP 是参与骨等矿化组织代谢以及再生的特异性酶[19]。上述结果表明P.g LPS 作用hPDLSCs 引起ROS的增加,可能是导致hPDLSCs 成骨分化能力降低,促进骨组织损伤的重要原因之一。
笔者前期研究发现,白杨黄素能够显著促进成骨细胞系MC3T3-E1 细胞的成骨向分化过程[8]。此外,本实验结果表明,白杨黄素显著降低P.g LPS 介导的hPDLSCs 细胞ROS 含量,并增强MnSOD、Cu/ZnSOD 和CAT mRNA 表达水平。同时,白杨黄素对成骨基因RUNX2、OSX、OCN 和ALP 表达具有明显的促进作用,说明白杨黄素可能通过干预ROS 的产生促进hPDLSCs 的成骨分化潜能,但白杨黄素具体作用机制尚有待进一步实验验证。
综上所述,白杨黄素对P.g LPS 介导hPDLSCs的ROS 产生具有一定的抑制作用,并且促进hPDLSCs 的成骨分化因子表达水平,从而改善根尖周炎病情。提示白杨黄素可能作为根尖周炎的治疗用药;然而,在炎症环境下,其增强hPDLSCs 成骨分化能力具体的分子机制仍有待进一步阐明。
