单菌与混合菌固态生物转化大黄素的比较研究*
2020-04-06李姝梅赵荣华
兰 慧,阳 敬**,李姝梅,赵荣华
(1. 红河卫生职业学院药学院 蒙自 661199;2. 云南中医药大学中药学院 昆明 650500)
大黄素(Emodin)是一种重要的天然药物成分,化学名为1,3,8-三羟基-6-甲基蒽醌(1,3,8-trihydroxy-6-methylanthra quinone)属蒽醌类成分[1],大黄素又称朱砂莲甲素[2],主要来源于蓼科的大黄、何首乌、虎杖以及豆科的决明等植物中,是大黄、何首乌药材的质量控制成分。大黄素在多种植物中含量高,提取精制容易,具有抗菌、抑制免疫、解痉、止咳和抗癌等药理作用[2]。为了进一步提高大黄素生物活性,发现新用途,近年来,国内外以大黄素作为前体药进行化学结构修饰,设计合成了许多活性较好的大黄素衍生物。
近年来,生物转化方法具有选择性强、副产物少,反应条件温和,污染环境小等特点,已成为结构修饰的重要手段。微生物转化技术与化学转化相比,无论在转化速度还是转化质量等方面均表现出了显著优势,被广泛应用于天然药物成分的合成转化和代谢机理研究[3],生物转化也称发酵。目前,中药成分的微生物发酵转化技术是人类获得结构新颖、独特、低成本、低毒性和高活性药物的重要途径之一[4]。发酵应用于中药,能利用微生物分解转化能力,改变中药原有性能,增强或产生新的功效,扩大用药品种,使得中药更适应于临床用药的需要[5]。
中药微生物发酵主要有2 种方式:固体发酵和深层发酵(液体发酵)。固体发酵是指利用微生物在潮湿的没有自由流动水的固体基质上生长代谢的技术[6-7]。固体发酵历史悠久,是一种比较成熟的发酵方式,操作和所需设备简单[8]。如以玉米为底物,采用Shiraia sp.SUPER-H168进行固体发酵,能够大量产生竹红菌素A[9]。秦俊哲等[10]用中药渣代替传统原料进行灵芝固体发酵,发现其固体菌丝中多糖含量和氨基酸含量都大大提高,不仅提高了药效,而且节约了药用资源。国外固态发酵在酶的生产[11-13]等方面己显示了良好的应用前景。近年来,对固态发酵原理和应用的研究使得清洁、节能的固态发酵已然成为发酵工业的关注热点[14]。固态发酵已引起很大的重视,因为这种生物过程可有效地转换廉价的农工业废渣、植物和各种各样有价值的化合物[15]。由于药物具有不同的特性,因此,研究人员能够根据药物之间的差异性进行有目的的组合,采用单一或混合菌种来进行微生物的定向发酵,或定向改变药物的性能[16]。
我国早在4000 多年前就开始将真菌转化食品和中药炮制等。中国传统的中药,如六神曲、淡豆豉、半夏曲、红曲、豆黄等,均是通过利用自然界的微生物(如霉菌、酵母等)固态转化后而形成的药物。我国是世界上最早直接利用真菌防病治病的国家,早在东汉年间的《神农本草经》中就有灵芝、茯苓、猪苓、雷丸等药用真菌分别列项论述,至今沿用不衰。真菌具有分解纤维素、淀粉、蛋白质、脂类等营养物质的强大酶类,对天然培养基有较强的分解利用能力[17]。目前,单株菌应用于中药比较多见,如游松等[18]采用多个菌株对白藜芦醇苷进行发酵转化研究,筛选后获得一株丝状真菌Syncephalastrum racemosum3.264,该菌能将白藜芦醇苷高效转化为白藜芦醇,纯化后白藜芦醇纯度高达98%。董悦生等[19]利用哈茨木霉CGMCC 2979直接转化药材,将栀子中的京尼平苷转化为京尼平,48 h京尼平苷的转化率为97.8%。马超等[20]用酵母转化大黄结合型蒽醌得到游离型蒽醌,从而减轻大黄的峻烈泻下作用。杜晨晖等[21]用米根霉生物转化何首乌及大黄素得到化合物大黄素-6-O-β-D-吡喃葡萄糖苷,并发现后者抑菌效果比前者好。朱培芳等[22]运用从生长何首乌的土壤中分离的一株镰孢霉属(Fusarium)菌株转化何首乌及大黄素得到化合物ω-羟基大黄素。
混合菌广泛存在于大自然中,是一类重要的微生物,对药物的生物转化作用强大,且生物转化作用机理比单株菌复杂,是多环节对多成分的作用,越来越受到人们的关注。目前,单株菌应用于中药及化学成分比较多见,而混合菌应用于中药及化学成分的研究相对较少。许多化学过程通过单酶(细胞)一步生物催化反应往往无法实现,因而目前生物催化已从先前单酶(细胞)催化体系向着多酶(细胞)耦合催化体系的方向发展,构建和利用这种体系,在同一反应器中自由组合不同的生物反应过程将是下一代工业生物催化技术发展所面临的挑战之一。
混合菌用于纤维素发酵已取得一定的研究成果。谢琼霞等[23]利用多种分解纤维素的菌种进行混合发酵甜高粱秸秆可使其降解率最高,糖化率达到3.19 mg·mL-1。张建强等[24]用混合菌发酵可提高纤维素的降解能力,从土壤样品中分离、筛选出一组对纤维素具有高效降解作用的混合菌,初步鉴定为毛霉菌(Mucor sp.)和曲霉菌(Aspergillus sp.)。魏培莲[25]运用土曲霉和红曲霉混合固态发酵,提高固态基质中的生物量和洛伐他汀的产量。混合菌用于中药发酵已有相关报道,石鸿辉等[7]以黑曲霉、产朊假丝酵母、枯草芽孢杆菌为发酵菌种进行固态好氧发酵,在相同条件下比较单一菌种或混菌组合对辣木茎叶粉的营养成分、抗营养成分及抗氧化活性的影响。结果表明,混菌发酵的效果优于单一菌种。此外,还有一些专利如中药多菌种混合发酵口服液的配制及其生产工艺,中药多菌种混合固态发酵技术及其应用。
目前,对单菌与混合菌生物转化大黄素的比较研究鲜有报道,本研究将单菌与混合菌固态生物转化大黄素进行比较研究,为提高中药材中大黄素微生物转化产率提供一种选择,为大黄素单菌与混合菌转化奠定一定的数据支持与理论基础,为大黄素及中药材中大黄素微生物转化提供一种新的思路。
1 实验材料和方法
1.1 菌种
菌种58 株,26 组混合菌(由云南大学微生物研究所提供44 株,由成都微生物研究所提供1 株,由本实验室提供8 株,由自行分离提供5 株,本实验室保存的菌株)。活化后接种到PDA 斜面培养基,0℃-4℃保存。
1.2 试剂与仪器
大黄素标准品(批号0756-200110,中国药品生物制品检定所);大黄素(批号为060803,纯度为98.07%,西安中鑫生物技术有限公司);ω-羟基大黄素(实验室分离,纯度达到95%);麸皮(市售)。高效液相色谱仪(Dionex Ultimate 3000 系列,USA):Dionex P680 四元梯度泵、Dionex ASI-100 自动进样系统、Dionex PDA-100 二极管阵列检测器、Dionex LPG-3400 真空在线脱气机、Dionex TCC-100 柱温箱、Chromeleon 6.8色谱工作站;岛津十万分之一电子天平(Auw220D,岛津国际贸易(上海)有限公司);SK7210HP 超声振荡器(上海科导超声仪器有限公司);Agilent TC-C18(4.6 × 250 mm,5 μm,USA)。
1.3 培养基
1.3.1 斜面培养基
斜面培养基:马铃薯20%,葡萄糖2.0%,琼脂1.5%,pH自然。
1.3.2 发酵种子培养基
发酵种子培养基:马铃薯20%,葡萄糖2.0%,pH自然。
1.3.3 发酵培养基
发酵培养基:大黄素0.25%,麸皮99.75%,pH自然。
1.4 大黄素和大黄素发酵物中大黄素、ω-羟基大黄素含量测定[22]
1.4.1 大黄素对照品及ω-羟基大黄素对照品标准曲线的制作
分别精密称取大黄素对照品,ω-羟基大黄素对照品,加适量甲醇溶解,定容后作为对照品溶液。大黄素、ω-羟基大黄素对照品溶液的浓度分别为0.28 mg·mL-1、0.342 mg·mL-1。根据 2015 年版《中华人民共和国药典》HPLC 测定大黄素的方法,并建立HPLC 测定大黄素及ω-羟基大黄素的方法学考察,大黄素对照品的标准曲线为Y = 57670X-2.6751,相关系数为0.9999,线性范围(mg)为2.8 × 10-3-8.4 × 10-3;ω-羟基大黄素对照品的标准曲线为Y = 61316X + 1.0387,相关系数为0.9999,线性范围(mg)为1.71×10-5-3.42×10-3。
1.4.2 大黄素和大黄素发酵物中大黄素、ω-羟基大黄素含量测定方法
样品处理:称取上述大黄素转化产物1.0 g 加入10 mL 甲醇,称重,超声振荡30 min,甲醇补足重量,摇匀,滤纸过滤,弃去初滤液,取续滤液,以0.45 μm 滤膜滤过,取过滤液作为测定大黄素固态转化样品的供试品溶液。按上述方法,同时制备不加入大黄素的阴性空白对照品溶液。
大黄素、ω-羟基大黄素含量测定:利用Dionex Ultimate 3000自动进样器的自动吸液-混合-进样功能(Draw-Mix-Inject),吸取样品液,然后吸取纯甲醇液适量,按色谱条件流动相:A:甲醇,B:0.1%磷酸溶液,流速:1 mL·min-1,柱温:30℃,检测波长:254 nm,记录时间:25 min 测定,使进样量保持在20 μL,各个成分制备6 个浓度点(n=6),每个浓度进样两次。以峰面积(Area)为纵坐标,进样量(mg)为横坐标,回归计算各个标准品的标准方程及其相关系数,计算大黄素、ω-羟基大黄素含量。
1.5 发酵培养方法
挑取一环新鲜斜面菌种,接种于已经高压灭菌的装有100 mL 种子培养基的250 mL 三角瓶中,其中28℃,110 rpm 摇床培养96 h 作为种子;按10%的种子液(单菌加入10%的种子液,混合菌中两株菌各加入5%),接种量将种子培养液接入装有已经高压灭菌的大黄素25 mg、麸皮10 g,的500 mL 三角瓶中,于无菌操作条件下加入8 mL 水,用无菌钢铲充分搅拌均匀。同时,按上述方法制备不接菌的大黄素培养基作为空白对照,按上述方法制备接菌不加大黄素培养基作为菌株阴性空白对照,将待转化样品、空白对照品及菌株阴性空白对照放入生化培养箱或恒温培养箱中,在28℃条件下培养至转化物由棕黄色变棕红色,菌丝布满整个转化物表面及瓶底时,将三角烧瓶从恒温培养箱中取出,培养时间为120 h。
1.6 薄层层析
将大黄素发酵提取物、标准品大黄素、ω-羟基大黄素点样于硅胶板上,分别以大黄素转化产物展开剂乙酸乙酯:甲醇:甲酸(15∶1∶0.5),氯仿:甲醇:甲酸(9∶1∶0.5),环己烷:甲醇:甲酸(1∶1∶0.5)为展开剂展开,在365 nm紫外灯下检视[26]。
2 结果与分析
2.1 大黄素转化产物中大黄素、ω-羟基大黄素的含量测定。
按上述色谱条件进样,测得不同固态转化的各样品ω-羟基大黄素、大黄素的含量。计算公式[27]为大黄素投料量的折算值=大黄素投料量×(空白不加菌对照品的测得量/空白不加菌对照品的投料量);ω-羟基大黄素的生成率=ω-羟基大黄素的量/大黄素投料量的折算值× 100%;大黄素的转化率=(总大黄素量-剩余大黄素量)/大黄素投料量的折算值×100%。
用58 株菌对大黄素进行固态转化,有57 株已转化大黄素,39 株能转化生成ω-羟基大黄素,所以只对已转化的产物进行分析。34 株转化产物ω-羟基大黄素生成率越大,大黄素转化率也越大,5 株菌YIM39335、YIM3088、YIM3210、YIM3015 和 YZ3.62例外。
2.2 大黄素转化率最高的7组混合菌与组成这7组混合菌的单菌比较
本实验是为了寻找大黄素转化率高的菌株组合,并考察组合混合菌的各单菌之间是否存在协同作用,所以只对转化率高的混合菌与组合混合菌的各单菌比较(表1、图1)。
在29组混合菌固态转化产物中,转化产物的大黄素转化率最高的7 组混合菌分别为YIM321801:YIM3088、YIM321801:YIM3058、YZ3.41:YIM321812、YIM3234: YZ3.9015、YZ3.41: YZ3.72、8-66: YZ3.42、YIM3234: 8-66,其 转 化 率 依 次 为 60.1%、34.7%、26.6%、22.7%、21.5%、20.3%、20.2%(表1)。
可以看出,菌株YIM321801 与菌株YIM3088 合用 ,菌株 YIM321801 与菌 株YIM3058 合用,菌株YZ3.41 与菌株 YIM321812 合用,菌株 YIM3234 与菌株YZ3.9015 合用,菌株 YZ3.41 与菌株 YZ3.72 合用,菌株YIM3234 与菌株8-66 合用,均能使大黄素转化率增高,其中菌株YIM321801 与菌株YIM3088 合用效果最为显著,大黄素转化率达到60.1%,而单菌YIM321801大黄素转化率仅为30.7%,单菌YIM3088 大黄素转化率仅为21.1%。菌株YZ3.41 与菌株YZ3.72 合用效果较为显著,大黄素转化率达到21.5%,而单菌YZ3.41大黄素转化率仅为9.1%,单菌YZ3.72 大黄素转化率仅为8.2%。菌株YZ3.41 与菌株YIM321812 合用效果也较为显著,大黄素转化率达到26.6%,而单菌YZ3.41大黄素转化率仅为9.1%,单菌YIM321812大黄素转化率仅为19.1%。
2.3 ω-羟基大黄素生成率最高的8 组混合菌与组成这8组混合菌的单菌比较
为了寻找ω-羟基大黄素生成率高的菌株组合,并考察组合混合菌的各单菌之间是否存在协同作用,所以只对高ω-羟基大黄素生成率的混合菌与组合混合菌的各单菌比较,8 组混合菌与单菌固态转化产物的ω-羟基大黄素生成率(表2、图2)。
在29 组混合菌固态转化产物中,转化产物的ω-羟基大黄素生成率最高的8 组混合菌分别为YIM321801:YIM3088、YIM321801:YIM3058、YZ3.41:YIM321812、YIM3234: YZ3.9015、YZ3.42: YZ3.9015、YIM3001:YIM39321、米根霉:YZ3.72、YZ3.41:YIM39321,其ω-羟基大黄素生成率依次为32.9%、22.4%、13.7%、12%、9.6%、9.2%、8.9%、8.5%(表2)。
可以看出,菌株YIM321801 与菌株YIM3088 合用 ,菌 株 YZ3.41 与 菌 株YIM321812 合 用 ,菌 株YIM3234 与菌株 YZ3.9015 合用,菌株 YIM3001 与菌株YIM39321 合用,菌株 YZ3.41 与菌株 YIM39321 合用,均能使ω-羟基大黄素生成率增高,其中菌株YIM321801 与菌株YIM3088 合用效果最为显著,ω-羟基大黄素生成率达到32.9%。而单菌YIM321801ω-羟基大黄素生成率仅为22.8%,单菌YIM3088 大黄素转化率仅为0.8%。菌株YIM3001与菌株YIM39321合用效果较为显著,ω-羟基大黄素生成率达到9.2%,而单菌YIM3001ω-羟基大黄素生成率仅为1.1%,单菌YIM39321ω-羟基大黄素生成率仅为3.0%。菌株YZ3.41与菌株YIM321812合用效果较为显著,ω-羟基大黄素生成率达到13.7%,而单菌YZ3.41ω-羟基大黄素生成率仅为7.1%,单菌YIM321812ω-羟基大黄素生成率仅为10.7%。
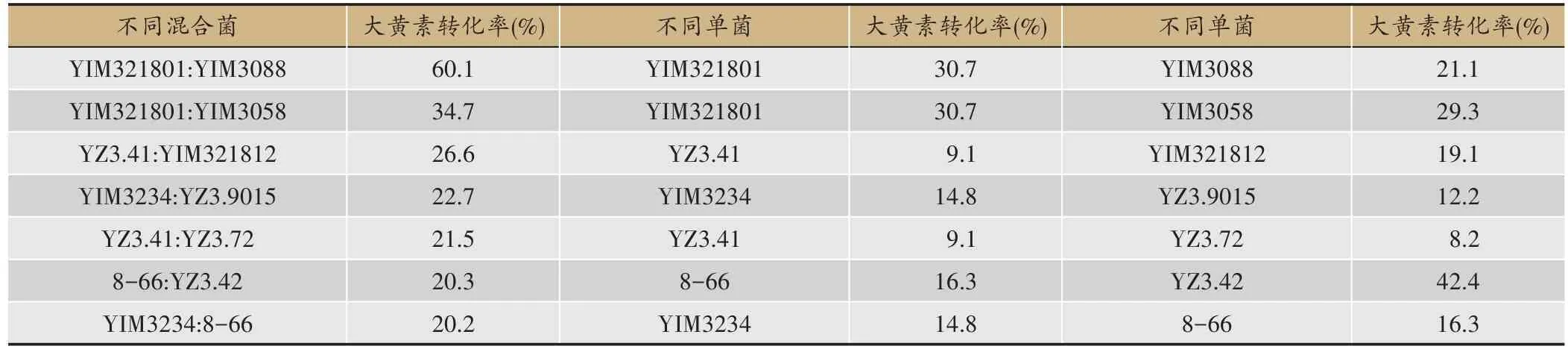
表1 7组混合菌与单菌固态转化产物的大黄素转化率
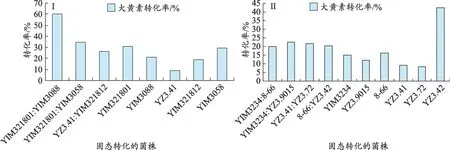
图1 (Ⅰ、Ⅱ)混合菌与单菌固态转化产物的大黄素转化率比较

表2 8组混合菌与单菌固态转化产物的ω-羟基大黄素生成率
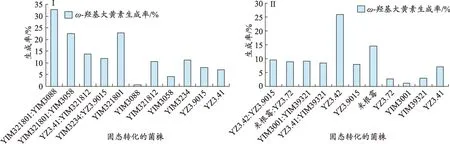
图2 (Ⅰ、Ⅱ)混合菌与单菌固态转化产物的ω-羟基大黄素生成率比较
2.4 混合菌转化产物中ω-羟基大黄素生成率及大黄素转化率最高的HPLC图谱
2.5 菌株固态转化产物的其他情况
产生成分种类最多的菌株分别是8-66,共有8 种未知成分(除ω-羟基大黄素外)。58 株菌中具有转化能力的菌株有57 株,能转化成ω-羟基大黄素的有39株。其中专一性较强(只产生1 种成分)的有YZ3.9022、YZ3.9024、YZ3.9021、YZ3.9023、YIM39439、YZ3.9032、YZ3.9034、YIM39409 共 8 株菌,其中菌株YIM39439 转化产物产生ω-羟基大黄素,生成率为0.4%,其余7 株转化产物均没有产生ω-羟基大黄素,其大黄素转化率依次为5.5%、0.6%、2.5%、0.4%、0.6%、2.3%、1.0%、1.2%。
3 结论
本研究分别用单菌与混合菌固态转化大黄素,并对大黄素的转化率和ω-羟基大黄素的生成率进行比较研究,实验结果表明,一些混合菌能提高ω-羟基大黄素生成率和大黄素转化率。即组成混合菌的两单菌间存在协同作用。研究发现3组协同作用非常显著的混合菌YIM321801(青霉属Penicillium):YIM3088(台湾根霉Rhizopus formosensis)、YIM321801(青霉属Penicillium):YIM3058(土 曲 霉 Aspergillus terreus)、YZ3.41(茄腐皮镰刀 Fusarium solani):YIM321812(毛霉属Mucor),转化率依次为60.1%、34.7%、26.6%。其中最显著的是YIM321801(青霉属 Penicillium):YIM3088(台湾根霉Rhizopus formosensis),大黄素转化率达到60.1%。转化产物的ω-羟基大黄素的生成率最高的3 组混合菌分别为YIM321801:YIM3088,YIM321801:YIM3058 及 YZ3.41:YIM321812,其生成率依次为32.9%、22.4%、13.7%。
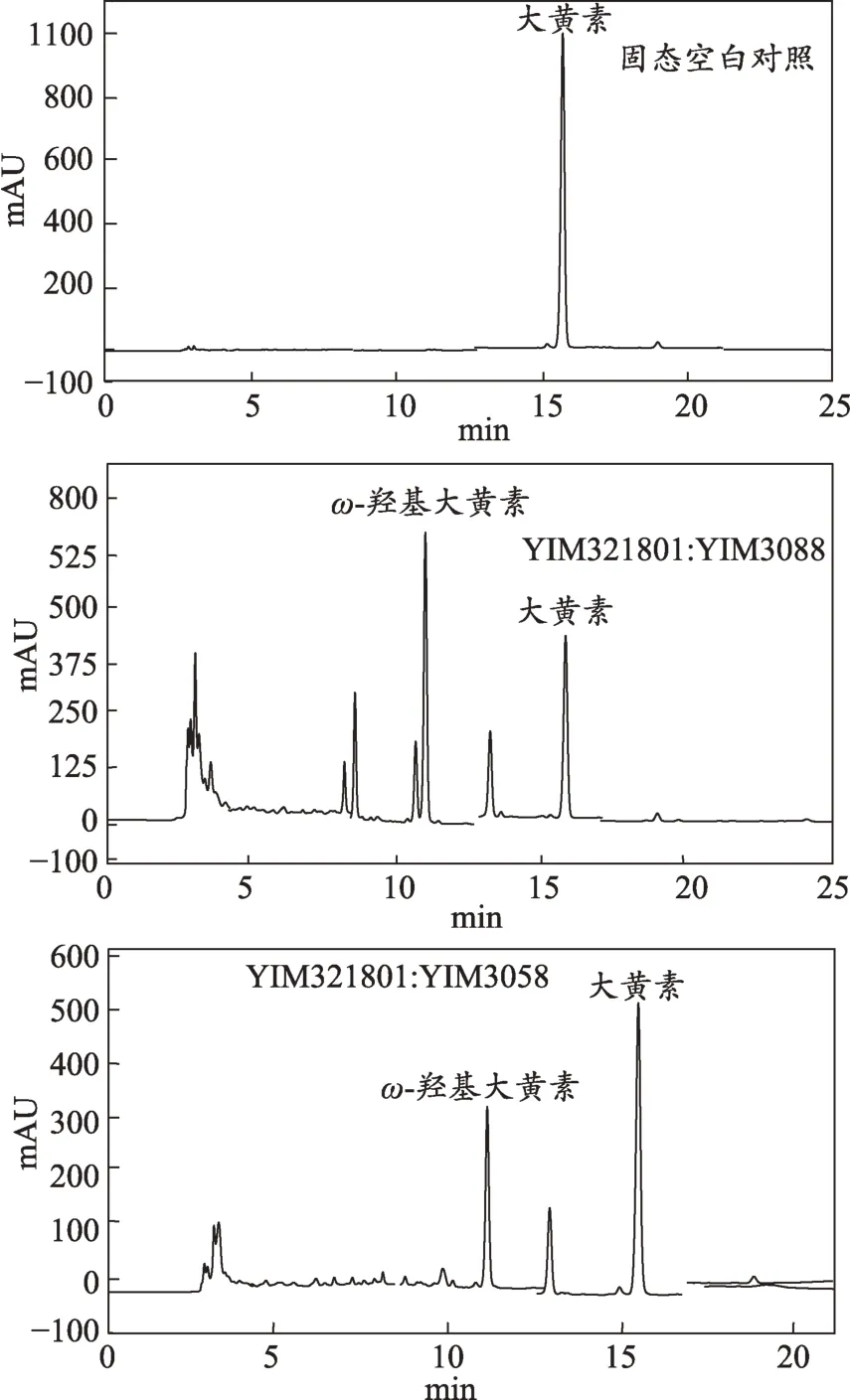
图3 混合菌转化产物中ω-羟基大黄素生成率及大黄素转化率最高的HPLC图谱
生物转化过程十分复杂,受多种因素的影响,实验中绝大多数混合菌比单菌大黄素转化率和ω-羟基大黄素生成率高,即混合菌比单菌生物转化大黄素强,各种菌株组合成的混合菌起到了协同作用。特别是功能弱的菌株组合后功能增强,起到协同作用。这可能是因为单菌发酵时微生物的代谢产物大量积累阻碍相关酶类的合成,而混合菌发酵中各菌株大多可以起到生长代谢协调作用,某些微生物如真菌能够利用这些代谢产物,从而解除这种阻碍作用,促进相关酶类的合成,使得实验中混合菌比单菌生物转化大黄素具有明显的优势。
新型的固态发酵方式有利于条件的控制及扩大规模生物转化,转化条件简单,为以后的生产及生物转化提供了可行性。一些混合菌生物转化大黄素作用显著,即组成的这些混合菌的单菌之间存在一定的协同作用,混合菌转化大黄素使得大黄素得到了进一步开发利用,为提高中药材中大黄素微生物转化产率提供一种选择,为大黄素单菌与混合菌转化奠定一定的数据支持与理论基础,为大黄素及中药材如大黄、何首乌、虎杖的炮制、生物代谢等微生物转化提供了一种新的思路。
