百里醌预处理对大鼠肝脏缺血再灌注损伤的作用及机制
2021-10-28申俊杰李爱萍申铭马国瑞
申俊杰,李爱萍,申铭,马国瑞
1.内蒙古医科大学附属医院普外科,内蒙古 呼和浩特 010050;2.华中科技大学同济医学院附属同济医院胆胰外科,湖北 武汉430030
肝脏缺血再灌注损伤(hepatic ischemia reperfusion injury,HIRI)是肝脏手术、创伤及失血性休克后发生肝衰竭的重要原因。目前研究认为HIRI的发生与钙超载、细胞凋亡、内皮素及补体系统、代谢性酸中毒等多种因素相关[1],因而探索新的保护HIRI的药物至关重要。百里醌(thymoquinone,TQ)是一种具有抗氧化、抗炎症作用的天然化合物,对糖尿病、动脉粥样硬化的防治具有较好的效果。而且,百里醌对人正常胰腺导管上皮细胞、前列腺上皮细胞、小肠细胞等正常细胞无毒性损害[2]。前期研究发现,百里醌能预防HIRI,但其具体机制不明。因此,本研究将进一步探讨百里醌通过抑制凋亡、抗氧化应激等改善HIRI的具体分子机制。
材料与方法
一、实验动物
选用200~250 g重量SPF级健康雄性SD大鼠,均购自武汉大学动物实验中心。完成该实验所有动物操作均符合动物试验伦理要求。
二、材料和试剂
百里醌(Sigma公司,美国)用无菌无水乙醇配制成10 mmol/L的储存液,-20 ℃保存。Bax、Bcl-2、裂解的胱天蛋白酶(Cleaved-caspases)-3、Cleaved-caspases-9、β-actin抗体购自圣克鲁斯生物技术公司。LKB1、磷酸化(p)-LKB1(Ser428)、AMPK、p-AMPK[酪氨酸(Thr)172]多克隆抗体购自美国Novus公司。丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)酶联免疫吸附试验(ELISA)试剂盒均购自武汉华美生物有限公司。大鼠丙二醛(MDA)、谷胱甘肽过氧化物酶(GPX)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)ELISA试剂盒购自美国R&D公司。肝脏细胞凋亡采用原位末端标记(TUNEL)凋亡检测试剂盒(碧云天生物科技公司)。
三、HIRI模型
用1%戊巴比妥钠40 mg/kg腹腔注射麻醉实验鼠,参照Kohli等[3]的方法,分离肝血管和胆管,以血管夹临时性夹闭肝左叶、肝中叶的血管,45 min后去掉血管夹,恢复肝脏血液供应,最终导致70%肝脏组织缺血再灌注损伤,缺血再灌注期间不阻断右肝及尾状叶血流。
四、实验分组
将SD大鼠依照体质量编号,并采用随机数字表法随机分组。假手术组(Sham组,n=10):解剖供应左肝和中肝的肝蒂,但不阻断血流;缺血再灌注组(IRI组,n=10):手术中血管夹封闭包含肝左叶、中叶血管的肝蒂,阻断45 min后再灌注,缝合切口,正常饮食喂养24 h。百里醌预处理+肝缺血再灌注组(TQ+IRI组,各亚组n=10):术前1周分别给予不同浓度百里醌(5、10、25、50、100 mg/kg)灌胃给药,手术中血管夹封闭包含肝左叶、中叶血管的肝蒂,阻断45 min后再灌注,缝合切口,正常饮食喂养24 h,同时继续给予以上不同浓度百里醌灌胃。术后24 h抽取其中5只大鼠血样,并处死实验鼠,新鲜肝脏组织生理盐水洗净后液氮冻存,以备后续实验分析;剩余5只实验鼠继续正常喂养1周后,处死并提取肝脏组织进行免疫组织化学分析。
五、ELISA检测
术后24 h抽取实验鼠血液,经3 000 r/min 离心10 min,分离血清,ALT、AST水平采用大鼠ALT、AST ELISA试剂盒进行测定;术后24 h处死实验鼠,提取新鲜肝脏组织,参考GPX、GSH、SOD、MDA ELISA试剂盒操作说明书进行检测操作与结果测定。
六、蛋白印迹法(Western blotting)
术后24 h提取实验鼠肝脏组织,裂解液匀浆并提取组织总蛋白,BCA法测定蛋白浓度,40 g总蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,后电转至PVDF膜,5%脱脂奶粉封闭非特异性位点。一抗4 ℃孵育过夜,再经辣根过氧化物酶(HRP)标记的二抗孵育1 h,采用电化学发光(ECL)法显色,凝胶成像系统采集图片。以β-actin蛋白为内参对照,实验均独立重复3次。
七、组织病理学研究
取适量新鲜实验鼠肝脏组织,预冷生理盐水洗净血液,于4%多聚甲醛溶液中固定48 h,石蜡包埋、切片、HE染色,显微镜下观察肝脏组织的受损情况(坏死、炎性浸润等),采用Suzuki评分标准进行肝损伤的组织学评估。
八、Ki67免疫组织化学
大鼠在手术干预后继续饲养1周,提取肝脏组织行石蜡包埋、切片并经过脱蜡、水化、抗原修复后行Ki67抗体免疫组织化学染色。以细胞核呈现明显的棕黄色染色为阳性信号。每张切片在5个随机高倍视野(×400)中进行肝细胞计数,统计平均阳性率,以百分数表示。
九、TUNEL染色
大鼠肝组织石蜡切片经过脱蜡、蛋白酶K及过氧化氢灭活、生物素标记及3,3′-二氨基联苯胺(DAB)显色。每张切片在5个随机高倍视野(×400)中进行肝细胞计数,统计平均阳性率,以百分数表示。
十、统计学方法
结 果
一、百里醌预处理对预防HIRI的效果
不同浓度梯度百里醌对SD大鼠HIRI的保护作用随浓度增加而效果增加,在50 mg/kg浓度为最佳,其后增加百里醌浓度并无明显肝保护效果累积,后续选取百里醌50 mg/kg为试验浓度(图1A、1B)。IRI组与Sham组比较,大鼠血清ALT[(171.7±11.6) U/L比(21.5±3.51) U/L,P<0.05)]、AST[(194.7±13.5) U/L比(26.4±3.97) U/L,P<0.05)]水平明显上升,表面肝细胞受损明显。百里醌预处理后,与Sham组比较肝脏缺血再灌注仍存在较明显的肝细胞损伤,ALT和AST水平较Sham组有上升(P<0.05),但TQ+IRI组与IRI组比较,ALT[(67.3 ±5.8) U/L比(171.7±11.6) U/L,P<0.05]、AST[(57.9±6.1) U/L比(194.7±13.5) U/L,P<0.05]水平明显下调,结果初步判定百里醌能够减轻HIRI,有效保护肝细胞(图1A、1B)。

注:aP<0.05;与IRI组比较,bP<0.05,cP<0.01,NS.P>0.05。图1 百里醌(TQ)预处理预防肝脏缺血再灌注损伤(IRI) A.血清丙氨酸转氨酶(ALT)水平改变;B.天冬氨酸转氨酶(AST)水平改变
二、各组大鼠肝组织病理学染色观察结果
如图2所示,在Sham组大鼠肝脏组织中,我们可以观察到清晰的肝小叶结构,未见明显的炎性细胞浸润,无肝细胞坏死。而IRI组大鼠肝脏组织中,可见不同程度的肝细胞肿胀、坏死、炎性细胞浸润,中央静脉的淤血伴随肝小叶结构模糊,出现了明显的肝损伤表现。而TQ+IRI组大鼠肝脏中肝小叶结构尚清晰,炎性细胞浸润明显少于IRI组,肝脏细胞变性肿胀程度较轻,点状坏死灶明显减少。

图2 各组大鼠肝脏组织的HE染色及病理学结果 A.假手术组(Sham组);B.缺血再灌注组(IRI组);C.百里醌预处理+肝缺血再灌注组(TQ+IRI组)
TUNEL染色评估大鼠肝脏细胞坏死程度,IRI组在术后24 h、7 d的TUNEL染色后凋亡指数均明显高于TQ+IRI组(图3,P<0.01),7 d后相对Sham组也有显著增高。结果表明IRI导致明显急性慢性肝细胞坏死,百里醌预处理减少了肝脏急性损害。
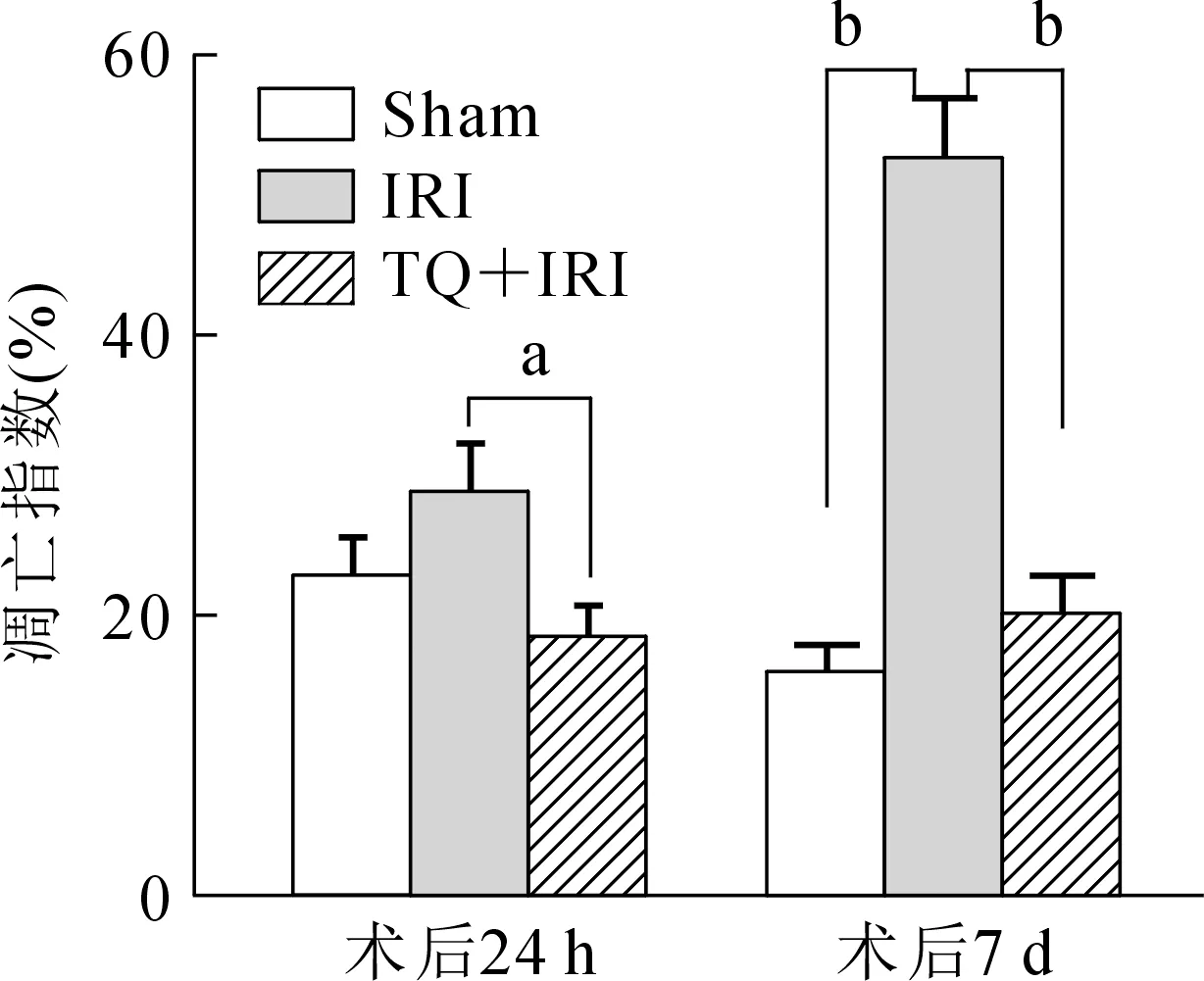
注:Sham.假手术组;IRI.缺血再灌注组;TQ+IRI.百里醌预处理+肝缺血再灌注组;aP<0.05;bP<0.01。图3 术后24 h、7 d各组大鼠肝脏组织细胞凋亡指数比较
本研究进一步采用Ki67染色来评估大鼠肝脏组织在缺血再灌注损伤后的炎性反应及肝脏细胞再生能力(Ki67可以反应细胞增殖),如图4所示,各组大鼠在干预24 h后提取肝脏组织并行Ki67染色,发现组间Ki67指数差异有统计学意义(P<0.01)。而IRI组术后7 d的大鼠肝脏组织中Ki67阳性肝细胞百分数明显高于Sham组大鼠,说明肝脏中存在较多的肝细胞再生,而TQ+IRI组Ki67阳性细胞数高于IRI组,表明百里醌预处理能够明显促进肝脏细胞的再生。
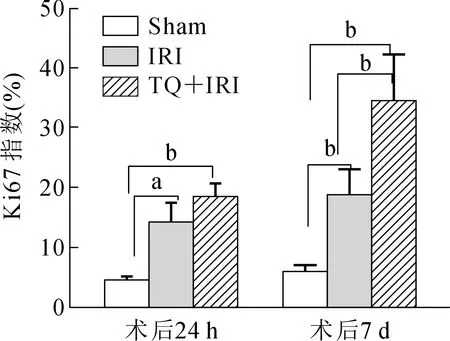
注:Sham.假手术组;IRI.缺血再灌注组;TQ+IRI.百里醌预处理+肝缺血再灌注组;aP<0.05;bP<0.01。图4 术后24 h、7 d各组大鼠肝脏组织Ki67染色分析
三、百里醌对HIRI中细胞氧化应激水平的影响
与Sham组比较,IRI组大鼠肝脏中GPX、SOD含量均显著下调(图5A~C,P<0.05),表明缺血再灌注导致肝脏组织抗氧化应激能力下降[HIRI激活肝细胞氧化应激损伤,而氧化应激损伤是由活性氧家族(ROS)造成的,GPX、SOD是机体清除ROS的重要酶系]。TQ+IRI组大鼠肝脏组织中GPX、SOD水平较IRI组明显上调(图5A~C,P<0.05),表明百里醌预处理增强肝脏细胞的抗氧化应激损伤能力。IRI组与Sham组比较,MDA含量明显增加,百里醌预处理能显著抑制缺血再灌注导致的肝脏组织MDA含量上升,且差异有统计学意义(图5D,P<0.05)。

注:Sham.假手术组;IRI.缺血再灌注组;TQ+IRI.百里醌预处理+肝缺血再灌注组;aP<0.05。图5 缺血再灌注损伤(IRI)后大鼠肝组织的抗氧化酶活性变化 A.谷胱甘肽过氧化物酶(GPX)活性;B.谷胱甘肽(GSH)水平;C.超氧化物歧化酶(SOD)活性;D.丙二醛(MDA)水平
四、百里醌预处理、缺血再灌注对肝细胞凋亡的影响
如图6所示,与Sham组相比,缺血再灌注后肝脏组织中大鼠促凋亡蛋白Bax的表达显著上调、凋亡抑制蛋白Bcl-2明显下调。TQ+IRI组大鼠肝细胞与Sham组比较,凋亡相关Cleaved-caspase-3、Cleaved-caspase-9、细胞色素C蛋白表达有不同程度上调,但较IRI组显著下降。

注:缺血再灌注组(IRI)与假手术组(Sham)比较,aP<0.05;百里醌预处理(TQ)+肝IRI组与IRI组比较,bP<0.05。图6 蛋白印迹法分析百里醌预处理抑制肝脏缺血再灌注细胞凋亡相关蛋白变化(n=3) A.蛋白印迹法分析蛋白表达;B.蛋白表达量的相对灰度值比较分析
五、百里醌激活LKB1、AMPK信号通路抑制HIRI
如图7所示,IRI组大鼠与Sham组比较,LKB1、AMPK蛋白表达总量无明显改变,p-LKB1(Ser428)、p-AMPK(Thr172)水平明显下调(P<0.05)。通过给予百里醌预处理后与IRI组及Sham组比较,肝脏组织的p-LKB1(Ser428)、p-AMPK(Thr172)蛋白磷酸化水平明显上调,LKB1、AMPK激活明显(TQ+IRI组比IRI组,P<0.05)。

注:Sham.假手术组;IRI.缺血再灌注组;TQ+IRI. 百里醌预处理+肝缺血再灌注组;与Sham组比较,aP<0.05;与IRI组比较,bP<0.05。图7 蛋白印迹法分析各组大鼠肝脏组织中LKB1、p-LKB1(Ser428)、p-AMPK(Thr172)蛋白的表达(n=3) A.蛋白印迹法分析蛋白表达;B.蛋白表达量的相对灰度值比较分析
讨 论
HIRI发生在肝移植、复杂的肝切除、失血性休克中,肝脏损伤程度主要归因于长时间肝缺血和再灌注后肝损伤[4]。HIRI可分为热缺血再灌注损伤与冷缺血再灌注损伤,热缺血再灌注损伤多见于肝叶切除、失血性休克、静脉闭塞性疾病等,这在临床中更为常见和棘手。HIRI涉及众多机制,其中肝细胞凋亡[5]、氧化应激损伤[5]、炎性反应[6-7]、肝窦Kupffer细胞代谢障碍[8]等,本研究主要评估在热缺血再灌注损伤后肝细胞凋亡、氧化应激损伤情况。
热缺血再灌注损伤中,肝脏ROS的大量生成和ROS清除障碍产生的氧化应激是加重肝脏损伤的重要因素,其中细胞内抗氧化酶的消耗、合成降低是主要原因。在正常生理状态下,肝脏超氧化物可以被肝细胞各种线粒体ROS清除机制不断消减,这些清除机制包括SOD、GSH、GPX等[9]。本研究中,我们发现百里醌预处理能调控SOD、GSH、GPX的消除过程,进而保障细胞内ROS清除效率,从而增强肝细胞的自我保护与自我修复能力。此外,脂质过氧化是引起ROS介导的HIRI的重要机制,所谓脂质过氧化,是肝细胞ROS损害细胞膜及各种酶的不饱和脂肪酸侧链,引发脂质过氧化反应,生成大量脂质过氧化产物,从而导致细胞膜通透性增加,肝细胞结构、功能发生严重破坏[10]。MDA系脂质过氧化终产物,它的含量水平能间接反应组织氧化应激损伤程度。本研究中,百里醌能够促进MDA的生成,阻断脂质过氧化反应,减少脂质过氧化产物产量以减轻HIRI。
前期非酒精性脂肪肝大鼠模型中我们发现百里醌能够激活AMPK信号。本研究通过给予百里醌预处理后肝脏组织的p-LKB1(Ser428)、p-AMPK(Thr172)蛋白磷酸化水平明显上调,LKB1、AMPK激活明显,这表明LKB1/AMPK的激活在百里醌预处理后的肝脏保护中发挥重要作用。目前有关HIRI的保护研究发现,除外类似在一项离体HIRI模型的研究中,发现敲除Bax基因,可明显减轻肝细胞损伤的研究[11],大部分集中在肝脏缺血预处理[12]、亚低温处理[13]、硫化氢气体或氢气处理[14]、药物的干预研究。而又以药物的研究最为深入,主要涉及钙离子通道的阻滞、炎性介质及蛋白酶异常释放的控制、氧化应激损伤的保护、微循环的改善及中草药提取物的研究。本研究发现,百里醌预处理能有效阻断IRI的促凋亡,伴随Bax蛋白下调、Bcl-2蛋白表达增强,有效减轻肝脏细胞凋亡。本研究还发现,TQ+IRI组大鼠肝细胞与Sham组比较,凋亡相关Cleaved-caspase-3、Cleaved-caspase-9、细胞色素C蛋白表达有不同程度上调,但较IRI组则显著下降,这表明百里醌预处理能在一定程度上有效阻断缺血再灌注诱导的干细胞凋亡。
百里醌是从黑种草植物中提取的一种活性物质[2],众多研究已表明百里醌具有抗炎、抗氧化、抗肿瘤、肝脏保护、抗高血压、降血糖、解除气道痉挛等作用[15-18]。且百里醌安全性高,在健康小鼠中口服喂养百里醌,其半数致死量(LD50)高于2 400 mg/kg[19]。在毒性肝损伤模型研究中,百里醌多是通过抗氧化、抗炎、抗肝纤维化、抗肝细胞凋亡等发挥护肝作用[20]。现阶段,关于百里醌对HIRI的研究较少,在本研究中,我们证实了百里醌预处理能够有效预防缺血再灌注对大鼠肝脏组织的损伤,而这有可能是通过百里醌阻断缺血再灌注诱导的肝细胞凋亡、氧化应激损伤来实现的,这对临床中缺血再灌注损伤导致的肝脏、心脏、脑、肾脏等损害研究均有启迪意义。
