LINC01296/miR-1255b-5p促进非小细胞肺癌进展的研究
2021-10-27夏道韫许琳枫柴彬淑孙强玲李艳利
夏道韫,许琳枫,柴彬淑,郭 静,孙强玲,李艳利
肺癌是世界上最常见的恶性肿瘤之一[1]。最新的癌症数据分析显示,肺癌的发病率在男性中仅次于前列腺癌,在女性中仅次于乳腺癌[2]。肺癌可以分为两种,分别是小细胞肺癌(small cell lung can-cer,SCLC)和非小细胞肺癌(non‑small cell lung cancer,NSCLC),NSCLC 约占肺癌总数 85%[3]。而NSCLC 又可以分为肺腺癌、肺鳞癌和大细胞癌[4]。NSCLC的早期症状不明显,目前的诊断手段也不成熟,导致大多数患者确诊时已是晚期。此外,NSCLC的复发率较高,患者5 年生存率低于15%[2]。因此,对NSCLC诊断以及治疗靶点的研究迫在眉睫。
长链非编码 RNA(long non‑coding RNA,lncRNA)是一种转录本长度超过200个核苷酸非编码RNA,。lncRNA具有多种生物学功能,如基因表达、表观遗传以及染色体装配等[5-7]。随着对lncRNA 在细胞生物学中功能的深入研究,大量临床观察和实验结果显示,许多lncRNA表现出在特异性细胞及组织中存在差异表达,这些表达及功能异常的lncRNA可以通过多种途径调节DNA 甲基化、组蛋白修饰、染色质重塑和作为miRNA的前体,从而导致多种疾病的发生,并且主要体现在多种肿瘤疾病上,在肿瘤的发生和发展中发挥着重要作用[8-10]。通过生物信息学分析显示,发现了14个差异表达的lncRNAs,其中LINC01296 差异表达较为显著[11]。因此,本研究旨在分析LINC01296 在体内和体外对NSCLC 的作用及与miR‑1255b‑5p的关系。
1 材料与方法
1.1 实验材料
1.1.1 患者样本 选取上海交通大学附属上海胸科医院的肺癌患者样本,样本采集于2018 年,样本数为40 例,冻存于‑80 ℃保存备用。本研究经院伦理委员会审核批准,所有患者均对本次研究知情并签署知情同意书(伦理号:IS2112)。
1.1.2 细胞系 本研究所用到的细胞系包括6 种NSCLC 细胞系(H1299、A549、PC‑9、HCC827、H1975和95‑D),人胚肾细胞系(HEK‑293T)和人肺上皮细胞系(BEAS‑2B)。其中H1299 购自美国模式培养物集存库,其他的细胞系购自中国科学院上海生命科学院生物化学与细胞生物学研究所。
1.2 实验方法
1.2.1 NSCLC细胞培养 按照ATCC提供的细胞培养的标准:A549、PC‑9、HEK‑293T 和 BEAS‑2B 细胞使用DMEM 培养基(Gibco公司,美国)进行培养;而H1299、HCC827、H1975 和 95‑D 细胞则使用 RPMI培养基(Gibco公司,美国),并在培养基中添加10%胎牛血清(Gibco 公司,美国)。细胞放置在环境为37 ℃,5%CO2的培养箱中进行培养。
1.2.2 qRT‑PCR 检测 LINC01296 的表达 本实验使用Trizol 试剂,并参照试剂说明书的标准方法提取NSCLC细胞以及患者样本RNA,并使用PrimeScript™RT reagent Kit with gDNA Eraser 的试剂盒(TaKaRa公司,日本)进行lncRNA逆转录合成cDNA。取2µL cDNA作为模板,SYBR®PrimeScriptTMⅡ试剂盒产品进行实时荧光定量聚合酶链反应(quantitative real time‑polymerase chain reaction,qRT ‑ PCR)检 测LINC01296 的表达水平,共 10 µL qRT‑PCR 反应体系,反应程序为95 ℃、10 min,95 ℃、5 s,60 ℃、30 s,72 ℃、30 s,扩增40个循环,采用2‑ΔΔCT相对定量法进行分析与比较。
1.2.3 shRNA 载体构建 首先在网站上设计shRNA 序列,每一对包含正义和反义寡核苷酸链互补序列。配制shRNA反应体系,以获得退火产物。之后利用T4 DNA 连接酶催化退火产物连接到pLKO.1 载体(实验室储存质粒)上,4 ℃过夜连接。取2 μL 连接产物和25 μL DH5α 进行转化,以获得大量目的质粒。
1.2.4 稳转细胞株的构建 本实验所用的稳转细胞株包括稳定敲低LINC01296 基因的细胞株。培养293T 细胞并使其保持良好的生长状态,采用psPAX2 和pMD2G 共转染的方法获得病毒溶液。在转染的24、48、72 h 后分别收集细胞培养基即病毒液,收集的病毒液放在4 ℃离心机中4 000 r 离心10 min。用0.45 μm滤器过滤得到病毒液。将病毒液与培养基等比例混合,加入到密度为70%左右的细胞中进行感染,同时加入10 μg 聚凝胺(polybrene)促进感染。最后通过加药筛选或流式细胞分选得到成功稳转的细胞。
1.2.5 细胞表型实验
1.2.5.1 CCK‑8比色法检测细胞增殖 取NSCLC 细胞,在96 孔细胞培养板中每孔接种1 500 个细胞,设置4 个复孔,在细胞周围的孔中加入适量磷酸盐缓冲液(phosphate buffer solution,PBS)以防培养基蒸发。在37 ℃5% CO2培养箱中培养6 h 后细胞贴壁,此时每孔加入100 μL 的5%细胞计数试剂盒‑8(cell counting kit‑8,CCK‑8)试剂(由无血清培养基配制),孵育 2 h 后吸取 95 μL 液体放入 96 孔酶标板中,在450 nm 波长处测OD 值,由于此时细胞尚未分裂,此时细胞密度可作为原始密度。此后继续检测 24、48、72、96 h时的 OD 值。
1.2.5.2 细胞克隆形成实验 取NSCLC细胞,6孔板中每孔铺板300~600个细胞,在37 ℃,5%CO2浓度的培养箱中培养10 d后,细胞形成菌落。加入200µL无水甲醇固定细胞15 min。吸去无水甲醇,加入200µL草酸铵结晶紫溶液,静置染色15 min。吸除染液,用蒸馏水洗涤至无紫色为止,之后拍照计数,处理数据。
1.2.5.3 划痕试验 取NSCLC 细胞,铺30%~40%密度的细胞于12 孔板中,每个样品2 个复孔,置于细胞培养箱培养。细胞长满培养板底部时便可实施划痕实验。划痕之后,用PBS清洗细胞,确保悬浮的细胞被冲洗干净。用封口膜包裹好培养板,拍照(0 h位置),24 h 后第2次拍照。对比两次拍照的划痕大小处理数据,按公式细胞迁移率=(0 h 时划痕宽度-24 h时划痕宽度)/0 h 时划痕宽度进行计算。
1.2.5.4 FITC‑Annexin‑V 试剂盒检测细胞凋亡 取NSCLC细胞,12孔板中铺细胞培养,密度达到80%~90%时,用超净台紫外光照诱导处理细胞2 h。用无EDTA的胰酶消化收集细胞,每个样品加入50µL结合缓冲液(Binding Buffer),分配好空白和单染对照(用以调整荧光补偿),剩余的全部加入2.5µL Annexin V‑FITC 和 2.5 µL PI,室温避光孵育 15 min 以上,200目滤膜过滤后,将样品装入流式细胞仪检测凋亡细胞的百分率。
1.3 动物实验 裸鼠10 只(BALB/c‑Nude裸鼠,6 周龄雌性)购自上海斯莱克实验动物有限公司。在特定的无病原环境中饲养7 d后,随机分为两组,每组5 只,分别为对照组和实验组。在对照组中,每只小鼠右腹部皮下和小鼠尾部静脉注射A549‑pLKO.1(低表达 LINC01296 的A549)细胞个数分别为5×106个,2.5×106个。实验组小鼠用同样的方式注射 A549‑shLINC01296‑2 细胞。使用游标卡尺每周测量一次皮下肿瘤的长和宽,计算瘤体的大小,8 周后处死小鼠。计算皮下肿瘤体积、重量以及肺结节数。动物实验遵循上海大学动物保护和使用委员会的规定。
1.4 双荧光素酶报告基因实验 本实验采用pRL和pGL3 两种质粒。将含有miR‑1255b‑5p结合位点的LINC01296 序列 插入 pGL3 载 体(pGL3 ‑LINC01296 WT)的Xba I/EcoR I位点,构建pGL3‑LINC01296 WT报告载体。另外构建突变体LINC01296 (pGL3‑LINC01296 Mut)。将pGL3‑LINC01296 WT或pGL3‑LINC01296 Mut 报告载体、海肾萤光素酶报告载体(pRL)和miR‑1255b‑5p模拟物共转染到293T细胞中。使用Invitrogen 的Lipofectamine 2 000进行细胞转染。48 h 后用 Promega 公司的 Dual‑Luciferase Reporter Assay System 进行双荧光检测。
1.5 统计学处理 应用GraphPad Prism 5.0软件,完成数据分析和绘制统计图表,计量资料以均数±标准差()表示,组间比较采用双t检验,为了保证实验数据的真实和准确,每个实验均有3 次独立的生物学重复,P<0.05为差异有统计学意义。
2 结果
2.1 LINC01296 在NSCLC 中的表达 本研究首先通过在线数据库(http://gepia2.cancer-pku.cn/#degenes)分析LINC01296的表达水平,发现相比于正常组织,LINC01296在NSCLC中的表达显著上调(上调约为 5 倍)。进一步通过 qRT‑PCR 检测LINC01296 在 6 种 NSCLC 细胞系(H1299、A549、HCC827、H1975、PC‑9 和95‑D)和正常人肺上皮细胞BEAS‑2B 中的表达水平(图 1a)。与 BEAS‑2B 相比,LINC01296 在 6 种 NSCLC 细胞系中的表达水平均是上调的。 为了进一步验证实验结论,选取了患者样本,对样本中的LINC01296的表达水平进行检测(图1b)。结果显示,与正常组织相比,LINC01296在癌症组织中显著高表达。
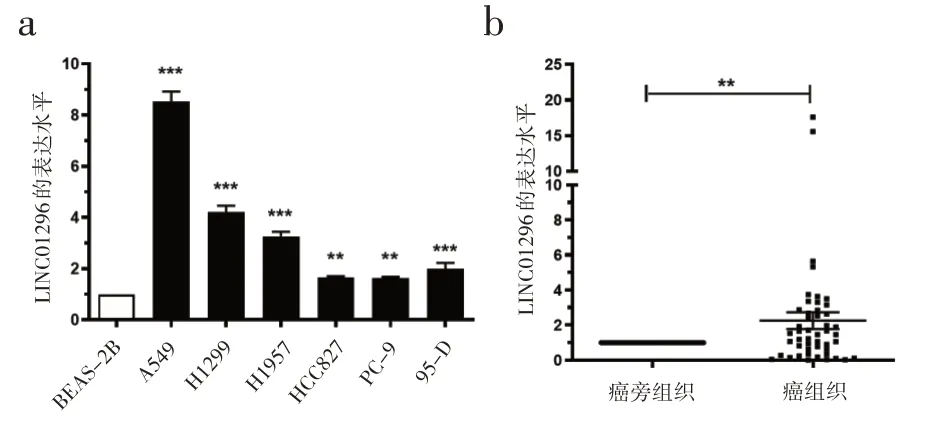
图1 LINC01296在癌细胞以及肿瘤组织中表达
2.2 敲低LINC01296对NSCLC细胞生长、迁移的影响 用CCK‑8法和克隆形成实验研究LINC01296基因敲低对NSCLC 细胞系体外增殖的影响。结果表明,与对照组细胞A549‑pLKO.1和H1299‑pLKO.1比较,A549‑shLINC01296‑2 和 H1299‑shLINC01296‑2的细胞增殖和克隆形成能力均受到显著抑制(图2)。
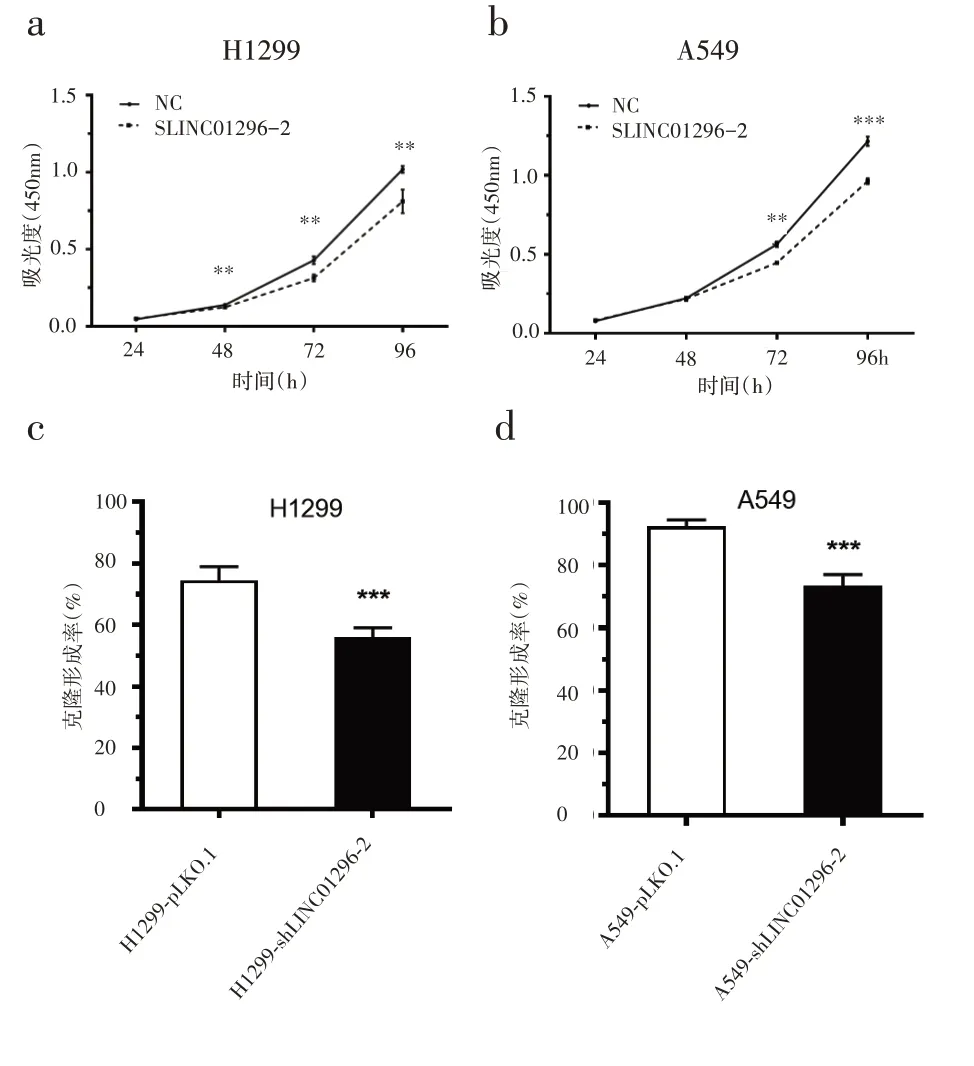
图2 敲低LINC01296基因对抑制NSCLC细胞生长的影响a~b:CCK‑8 法检测敲低 LINC01296 基因,与未敲低相比,H1299 和A549 细胞增殖受到抑制;c~d:克隆形成实验敲低LINC01296基因,与未敲低相比,H1299和A549细胞增殖能力显著下降,*P<0.05,**P<0.01,***P<0.001
进一步采用划痕实验研究两种NSCLC 稳转细胞系的迁移能力。与对照组细胞A549‑pLKO.1 和H1299‑pLKO.1 比较 LINC01296 敲低的稳转细胞A549‑shLINC01296‑2 和 H1299 ‑shLINC01296‑2 的迁移能力显著降低(图3)。
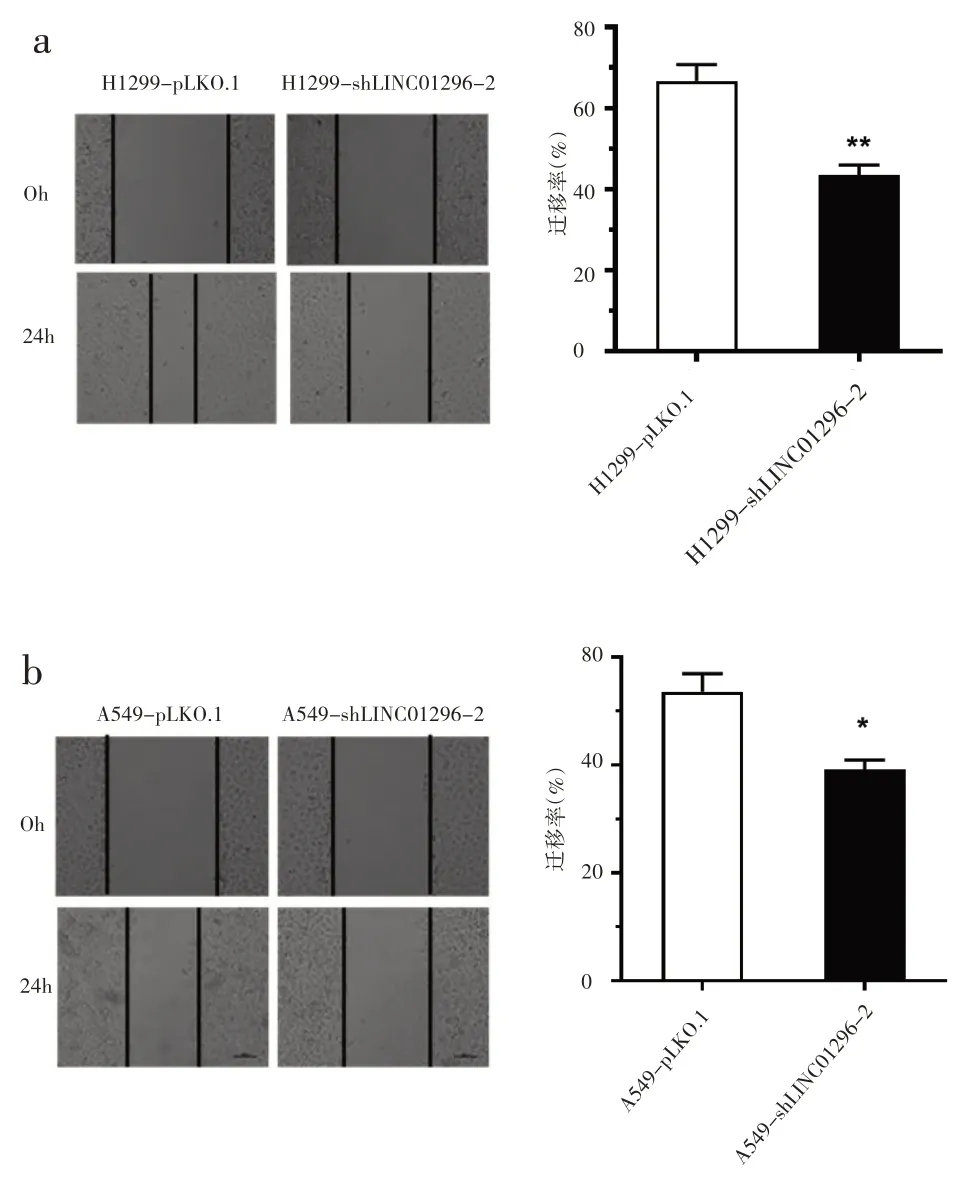
图3 敲低LINC01296基因对NSCLC细胞迁移的影响
2.3 敲低LINC01296 对体内瘤体生长和转移的影响 以上的体外实验均证明LINC01296影响NSCLC的发生发展。为证明本研究的结论,进行了动物实验。为符合动物保护伦理,将其中2 只裸鼠安乐死,对其余3 只进行分析处理。每周测量皮下肿瘤大小(图4a),并计算最终皮下肿瘤的重量(图4c),图b 是8 周后小鼠瘤体图像。与对照组相比,实验组的肿瘤大小和重量增加得更慢(图4a、c)
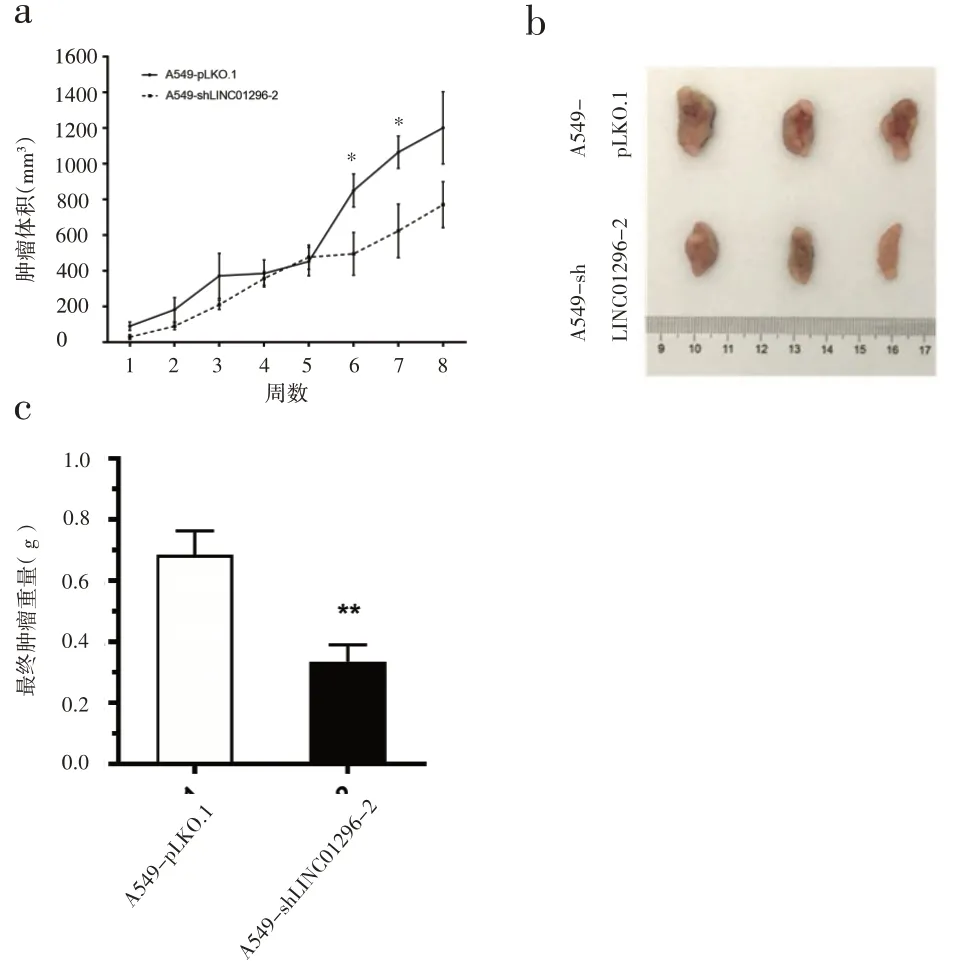
图4 LINC01296水平的减少对体内肿瘤生长和转移的影响
2.4 LINC01296 通过 miR‑1255b‑5p 海绵吸附作用对肺癌的影响 为了进一步研究LINC01296 对NSCLC 调控的分子机制,首先通过StarBase(starbase.sysu.edu.cn/)、TargetScan (targetscan.org/vert72)以及miRanda (microrna. org) 预测网站预测LINC01296 靶向结合的microRNA,然后取交集,最终 筛 选 出 miR‑1255b‑5p。 miR‑1255b‑5p 与LINC01296 上的靶序列互补配对的模式图(图5a)。实验结果表明,miR‑1255b‑5p 直接靶向LINC01296的种子序列对LINC01296 发挥抑制作用。为了验证 LINC01296 直 接 靶 向 miR‑1255b‑5p,先 将LINC01296野生型(LINC01296‑WT)的结合位点连接到携带pGL3载体的荧光素酶开放阅读框的下游,形成pGL3‑LINC01296 ‑ WT。 pGL3‑LINC01296 ‑ WT 和miR‑1255b‑5p mimic共转染后,与对照组相比,293T细胞中的荧光素酶活性显著降低,而在突变体组中观察到相反的结果(图 5a)。此外,qRT‑PCR 结果显示,LINC01296敲除的稳定细胞中miR‑1255b‑5p 的表达显著上调(图 5b‑c)。综上,说明 LINC01296 能起miR‑1255b‑5p海绵作用。
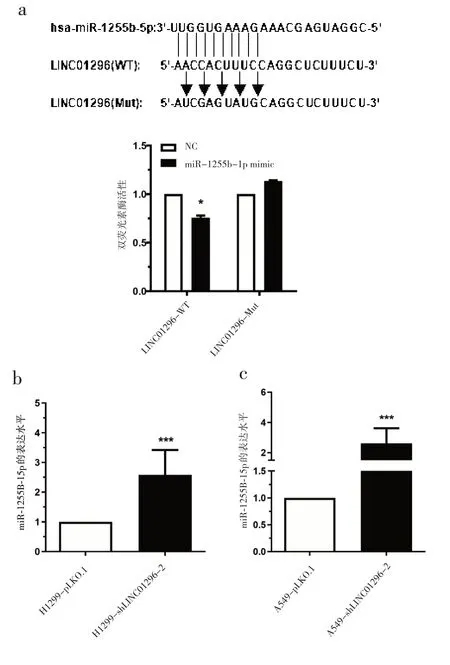
图5 LINC01296吸附miR‑1255b‑5p对其表达的影响
2.5 LINC01296 与 miR‑1255b‑5p 的表达关系 为了进一步研究 LINC01296 与 miR‑1255b‑5p 的相关性,采用 qRT‑PCR 检测 NSCLC 组织中 miR‑1255b‑5p 的表达水平(图6a)。与邻近组织相比,miR‑1255b‑5p 的表达下调,而 LINC01296 在癌症样本中显著高表达(图1b)。结果表明,miR‑1255b‑5p 随着肿瘤的发展而降低,其表达趋势与LINC01296呈负相关(图 6b)。

图6 LINC01296与miR‑1255b‑5p的表达关系
3 讨论
本研究旨在探讨LINC01296在NSCLC中的作用机制。实验结果显示LINC01296 在NSCLC 中高表达。并且,敲低LINC0129会抑制NSCLC细胞生长、迁移。小鼠体内实验也发现LINC01296低表达对肿瘤生长和转移有明显的抑制作用。此外,LINC01296通过miR‑1255b‑5p海绵吸附作用,促进了肺癌的发生发展,二者的表达水平也呈负相关。
近年来,LINC01296 在结直肠癌、膀胱癌、前列腺癌、卵巢癌、胆管癌(CCA)和骨肉瘤中的作用已被研究[11,13-15]。生物信息学分析结果和生存曲线显示,LINC01296 的高表达与预后不良相关[12]。最新研究发现,LINC01296 在胶质瘤中表达下调,并通过靶向CARD11 基因和NF‑κB 途径来抑制胶质瘤细胞的增殖和迁移[15]。LINC01296可能靶向细胞周期蛋白D1,进而促进骨肉瘤的细胞增殖、转移和细胞周期进展[16]。此外,在膀胱癌中转染siLINC01296后,膀胱癌细胞的增殖和转移减少[16]。另外,研究还发 现 microRNA‑5095 在 NSCLC 和 CCA 中 与LINC01296 结合的能力很强[13,17]。此外,在 CCA 中,高水平的LINC01296使MYCN的表达被上调。
LINC01296在NSCLC 中的作用机制尚不清楚,其在基因表达中的调控机制也有待进一步研究。另外,miR‑1255b‑5p 具有抗肿瘤作用,并参与调节hTERT 介导的上皮‑间质转化[18]。在糖尿病肾病患者中,miR‑1255b‑5p 表达显著上调,有望成为诊断糖尿病肾病的生物标志物[19]。同时,还有研究发现一些microRNA,如miR‑221 的表达受到一些lncRNA 的调控,并且这些lncRNA 已经被证实与NSCLC的发生与发展有着重要关系[20]。
本实验结果为LINC01296 可作为NSCLC 的促癌分子,其作用机制是通过抑制miR‑1255b‑5p的表达水平,促进了NSCLC 的发展。后续将继续研究LINC01296/miR‑1255b‑5p在NSCLC中的作用机理,如 LINC01296/miR‑1255b‑5p 的信号通路、miR‑1255b‑5p 作用的靶基因、LINC01296 表达的调控因子等。这些机制的阐明将为NSCLC 的诊断和药物开发的应用提供光明的前景。
