CEP170在肝癌中的表达及对肝癌细胞增殖的影响
2021-10-27牛亚楠孙力超
刘 静,牛亚楠,孙力超
肝癌是严重危害我国人民健康的常见恶性肿瘤,全球每年约50%新发肝癌病例来自中国[1]。最新统计数据显示,目前我国肝癌已跃居癌症发病率第 5 位,死亡率第 2 位[2]。在过去的 20 年中,与肝癌相关的死亡率仍在继续增加。肝细胞肝癌(hepatocellular carcinoma,HCC)是最常见的肝脏恶性肿瘤,占肝癌的90%以上。肝癌具有恶性程度高,病情进展快,生存期短等特点。伴门静脉癌栓的肝癌患者发生率为44.0% ~62.2% ,肿瘤细胞从门静脉的二级分支生长到一级分支平均仅需8.5 d,而从一级分支蔓延至主干平均仅需11.5 d,并可引起门静脉高压、黄疸、腹水等严重并发症[3-4]。基于肝癌不良预后及现状,急需探索新的治疗靶点。
中心体相关蛋白(centrosomal protein,CEP)调节细胞有丝分裂的起始并调控细胞周期的进程,其家族成员表达异常与肿瘤发生发展密切相关。中心体错误组装,染色体组不稳定,会导致有丝分裂紊乱,进而促进肿瘤发生[5]。研究者对中心体家族蛋白质组信息进行了系统分析,揭示其家族成员在细胞分裂中的重要作用[6]。CEP表达异常与肝癌密切相关,前期研究提示,CEP 家族成员CEP55 通过PI3K/Akt/mTOR 信号通路促进肝癌细胞增殖,CEP350 的低表达也与肝癌患者不良预后密切相关[7-8]。CEP 家族分子参与调控肝癌细胞增殖的分子机制尚待进一步阐明。
CEP170 由 Giulia 等[9]在 2004 年发现,该基因定位于染色体1q43,包含23 个外显子,编码170 kDa大小的蛋白。大多数已知的CEP 都含有大量盘绕线圈区域,相比之下CEP170 仅包含短线圈。在其N 末端还包含一个特定的 FHA(forkhead‑associated)结构域。这种结构域通常与磷酸化肽段相识别,并参与 DNA 损伤修复途径[10-12]。CEP170 在细胞间期与中心体结合,分裂期与纺锤体相结合,在细胞的有丝分裂中发挥着重要作用,而有丝分裂正是决定细胞增殖的关键点。目前,关于CEP170 与肝癌的关系尚无报道,本研究将分析CEP170 在肝癌组织中的表达及其对肝癌细胞增殖的影响。
1 材料与方法
1.1 实验材料 免疫组化试剂盒购自北京中杉金桥生物技术有限公司(货号:SP‑9000),CEP170 抗体购自亚科因(武汉)生物技术有限公司(货号:ABP50950)。人肝癌细胞Huh‑7 由中国医学科学院肿瘤医院细胞生物与分子生物学实验室常规保存,DMEM 培养基购自北京细工生物科技有限公司。Lipofectamine 2000 购于赛默飞世尔科技(中国)有限公司(货号:11668019),CCK‑8 试剂盒购自日本同仁化学(货号:CK‑04)。细胞周期检测试剂盒购自南京凯基生物科技发展有限公司(货号:KGA512)。特异性 siRNA(CEP170 siRNA1:5′‑GGCGCTTTCCTACTGATTATG‑3′,CEP170 siRNA2:5′‑GCTCTGCTTCAGTAAATTCAA‑3′)购自苏州吉码制药技术有限公司。
1.2 生物信息学分析
1.2.1 表达差异分析 蛋白质组数据来自临床蛋白质组学肿瘤分析联合会(clinical proteomic tumor analysis consortium,CPTAC )数据库(https://proteomics.cancer.gov/programs/cptac)中收录的研究队列,其中包括159例中国HCC 患者肿瘤组织及配对正常组织的蛋白质组数据和临床信息,有临床预后信息的病例150例[13]。Human Protein Atlas蛋白表达图 谱 数 据 库(http://www. proteinatlas. org/) 观 察CEP170在HCC中的表达。转录组数据和临床样本信息来源于TCGA 数据库(https://www.cancer.gov/about‑nci/organization/ccg/research/structural‑genomics/tcga),其中正常组织50例,癌组织371例。在线数据库网站cBioPortal(http://www.cbioportal.org/)分析CEP170在350例肝癌组织中的DNA拷贝数变异情况,利用R包limma进行基因表达差异分析。
1.2.2 预后分析 以基因表达值中位数为临界值将患者分为CEP170 高表达组和低表达组。应用Kaplan‑Meier 统计分析法,survival 包进行生存分析。timeROC 包绘制ROC 曲线进行生存预测。结合与肝癌相关的风险因素进行单因素及多因素COX 回归分析,探究CEP170 是否为影响患者生存的独立预测因素。
1.3 免疫组织化学检测 在72 ℃条件下将人肝癌石蜡组织切片脱蜡1 h,二甲苯浸泡,酒精水化,EDTA修复抗原,一抗孵育过夜。在37 ℃下使用中杉金桥通用型二抗孵育30 min,DAB 显色,苏木素染色,温水返蓝,酒精浸泡,二甲苯脱水,中性树脂封片后烘干,扫描拍照。
1.4 细胞活力检测 人肝癌细胞系Huh‑7用含10%胎牛血清的DMEM 培养基于37 ℃,5%CO2条件下培养。待细胞生长至对数期时接种于六孔板,Lipofectamine 2000 转染 siRNA。转染 24 h 后,胰蛋白酶消化计数,按照2×103个/孔接种细胞,设6 个平行孔,接种5 块96 孔板。每隔24 h 检测一块96 孔板的450 nm (OD450)吸光值,绘制细胞生长曲线。按照500 个/孔接种六孔板培养两周,冰甲醇固定,结晶紫染色,计数细胞数在50个以上的克隆。
1.5 细胞周期检测 细胞转染48 h后胰酶消化,吹打成单细胞悬液。将细胞悬液逐滴加入到70%预冷无水乙醇中,4 ℃固定3 h以上。离心去固定液,加入配置好的RNAse A:PI工作液染色。30 min后流式细胞仪检测。
1.6 统计学处理 应用SPSS17.0 软件,两组间比较采用t检验。Kaplan‑Meier 统计分析方法预测蛋白表达与患者预后生存关系。单因素及多因素Cox回归分析不同因素与患者生存期的影响,P<0.05为差异有统计学意义。
2 结果
2.1 CEP170 在HCC 组织中蛋白表达与预后关系通过limma 包对CPTAC 蛋白质组数据分析显示HCC组织中CEP170蛋白表达量较正常组织显著升高(P<0.001,图1A)。从Human Protein Atlas 数据库中的IHC 结果可见CEP170 在HCC 中表达量升高(图1B)。Kaplan‑Meier 生存分析发现CEP170 高表达与患者预后不良正相关(P=0.002,图1C),ROC曲线分析CEP170 对患者生存的预测效应,曲线下面积AUC值均大于0.7(图1D),说明CEP170表达对患者生存预测准确性高。COX 单因素及多因素回归分析结果显示,CEP170 高表达为HCC 患者预后不良的独立风险因素(图2A、2B,P<0.001),从而可作为HCC患者生存风险预测潜在的分子标志物。

图1 CEP170在HCC中的表达与患者预后情况

图2 HCC不良预后的独立风险因素
2.2 CEP170 在 HCC 组织中 mRNA 表达及预后影响 通过UALCAN 网站在线分析TCGA 数据库中HCC 转录组数据结果显示,HCC 组织中CEP170 mRNA 转录水平较正常组织显著升高(P<0.001,图3A),HCC 组织中mRNA 的转录水平升高与患者预后不良正相关(P<0.001,图3B)。通过ciBioPotal数据库在线分析CEP170 在HCC 组织中DNA 拷贝数变异情况,发现其扩增频率为6%(21/350),突变频率为1.43%(5/350),图3C。结果提示DNA 拷贝数扩增是CEP170基因转录水平升高的可能原因。

图3 CEP170在HCC组织中mRNA表达及预后影响
2.3 敲降CEP170 表达对肝癌细胞增殖的影响通过IHC 实验进行组织验证,可见癌组织中CEP170 表达量高于正常组织(图4A)。利用特异性 siRNA1 及 siRNA2 敲降肝癌细胞株 Huh‑7 中CEP170 表达(图4B),结果显示细胞增殖及克隆形成能力均显著降低(P<0.001,图4C、4D)。
2.4 敲降CEP170 表达后对肝癌细胞周期的影响为了探究CEP170是否影响肝癌细胞周期,本研究利用特异性siRNA转染肝癌细胞株Huh‑7 48 h后流式分析结果显示,敲降CEP170的表达Huh‑7细胞发生G0/G1周期阻滞,且具有显著差异(P<0.001,图5)。
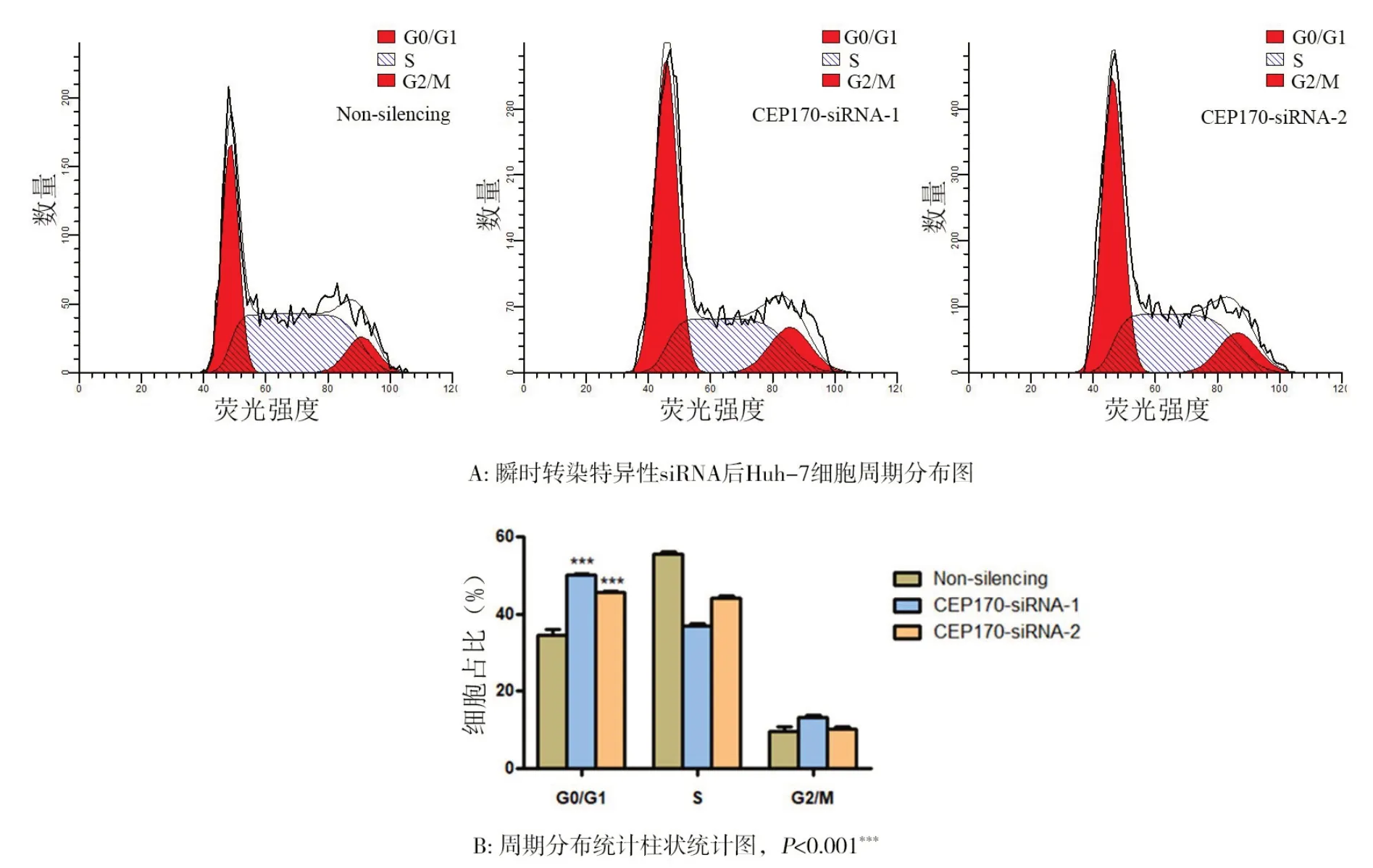
图5 敲降CEP170表达对细胞周期的影响
3 讨论
肝癌预后差、复发率高,病情进展迅速。2015年我国新发肝癌病例8.9 万余人,死亡7.8 万余人,肝癌死亡病例占全部癌症死亡的13.97%。探究其发病机理及相关影响因素,寻找更为有效的治疗方法仍亟待解决。目前,利用生物信息学手段,通过分析相关基因在临床上的表达及意义,为寻找相关治疗靶点提供了新途径[14-15]。
中心体是细胞中重要的无膜细胞器,参与细胞的有丝分裂,它的行为和调控由一系列执行细胞功能的蛋白质完成,保证遗传物质能够精确、有序和完整地传递到子代细胞中[16-17]。在前期的研究中发现CEP家族表达异常与肿瘤关系密切,在前期的研究中发现,CEP家族成员通过多种形式调控肿瘤的发生发展。CEP55 通过PI3K/Akt/mTOR 信号通路调节神经胶质瘤细胞的糖代谢、增殖和凋亡,同时CEP55 的过表达增强了FOXM1 和MMPs 的表达并过度激活NF‑κB途径,对神经胶质瘤及胰腺癌的发生产生促进作用[18-20]。通过二代测序技术检测121例前列腺癌患者的94 个与癌症易感性相关的基因,证实CEP57 与前列腺癌发病正相关[21-22];CEP135 蛋白失调促进了中心体的复制异常,并导致乳腺癌细胞中的染色体分离异常[23]。 既往关于CEP170的研究主要集中于其生物学结构及功能探索[24-26],与肿瘤的相关研究较少见,本研究针对这一新的目标分子,逐层开展研究。
CPTAC 数据库整合了蛋白组学的数据信息,为从蛋白质层面进行探究提供了丰富的临床数据资源。本研究的优势之处在于首先利用CPTAC 中HCC蛋白质组数据进行比对分析,从功能蛋白的表达入手,探索与临床数据相关的基因表达差异。进一步对CEP170 转录数据进行比对分析,与蛋白质组数据得到了一致的结论。接下来的研究中还发现,在基因组数据中肝癌组织CEP170 基因DNA 拷贝数发生了高频次的扩增,这种异常扩增是CEP170 mRNA 水平升高的可能原因。由此可以初步假设,由于CEP170 基因在HCC 中异常扩增导致CEP170 在HCC 中高表达,且这种高表达与患者预后不良相关。为此,本研究又进行了一系列的体外实验来进一步验证。组织验证中得到和数据分析中相同的结论,CEP170在肝癌组织中表达量升高。体外细胞实验结果表明,特异性敲降CEP170 表达能够显著降低肝癌细胞Huh‑7 的增殖能力,细胞周期发生G0/G1 期阻滞,验证了数据分析结果,该基因在DNA 扩增期发挥作用。本研究通过多组学数据分析结合体外实验验证对CEP170基因在肝癌中的作用进行了初步探究,研究发现CEP170 可能通过影响细胞周期促进肝癌细胞增殖,本研究结果为阐明CEP170促进肝癌发生发展分子机制提供了实验依据,为肝癌个体化诊疗提供候选分子靶点。同时,利用蛋白组学数据库进行研究得到的结果,较基因组研究提供了更加直接的证据。但对于CEP170 基因在HCC 中发生异常扩增的原因,以及CEP170蛋白异常表达如何影响预后生存等问题尚待解决。下一步可继续扩大组织的样本量进行验证,并针对CEP170下游效应分子、相关分子通路等内容继续开展研究。综上所述,CEP170 在肝癌组织中异常高表达,降低CEP170 表达抑制肝癌细胞增殖且细胞发生G0/G1 期阻滞,CEP170 可能是肝癌治疗的潜在靶点。
