α7nAChR通过调节miR-124对心肌梗死大鼠TNF-α转化酶、炎症反应及免疫功能的影响
2021-10-27刘道权
刘道权,宋 丹,鄢 华,苏 晞
急性心肌梗死(acute myocardial infarction,AMI)是一种由急性冠脉和持续性缺氧缺血引起的心肌缺血。AMI的病理进程中免疫失调以及炎症反应增加是其关键特征之一[1]。AMI大鼠中炎症细胞因子出现过表达,其中包括肿瘤坏死因子‑α((tumor necrosis factor‑α,TNF‑a)、白介素‑1β((interleukin‑1β,IL‑1β)、IL‑6[2]。此外,已证明TNF‑α在肥胖的人或小鼠的肌肉组织中过表达,且TNF‑α能够增加嗜中性粒细胞的吞噬能力,促进内皮细胞分泌IL‑1和IL‑6,增强嗜中性粒细胞和内皮细胞的粘附力,从而刺激局部炎症性扩张和对AMI 的反应[3-4]。多种信号均可有效调节炎症反应,如胆碱能抗炎信号通路[5],而尼古丁(烟碱型ACh受体的激动剂)可以减少缺血再灌注损伤动物体内促炎性细胞因子的产生[5]。因此,胆碱能抗炎途径不仅是重要的生理机制,而且是治疗干预AMI免疫炎症的潜在靶标。
烟碱型ACh 的跨膜受体α7nAChR 在脑中丰富表达,且在多种非神经元细胞中也表达,包括上皮细胞、血管内皮细胞、免疫细胞、癌细胞[6]。α7nAChR对于胆碱能抗炎作用至关重要。最新研究表明,敲除α7nAChR 加重心肌梗死并增加了系统炎症[7]。然而,在AMI 中连接α7nAChR 激活和调节促炎细胞因子的机制仍然不清楚。
微小RNA(miRNA)是18~25个核苷酸的非编码转录本,在大多数情况下,成熟的miRNA通过种子区域成熟的mRNA的3‑UTR序列结合,若种子区完全匹配,可引起mRNA降解,若部分匹配,则抑制mRNA的转录。研究表明miR‑124可被激活后的α7nAChR诱导表达[8],而且 miR‑124 可以抑制 TNF‑α 转化酶(TNF‑α converting enzyme,TACE)和信号转导与转录激活因子3(signal transduction and transcriptional activators 3, STAT3),这两种酶分别控制 TNF‑α、IL‑1、IL‑6 的表达[8]。基于以上研究推测,在 AMI中α7nAChR 也可能通过miR‑124 参与调节免疫炎症。本研究假设α7nAChR可能是AMI免疫失衡和炎症增加的潜在治疗靶点,本研究旨在讨论α7nAChR激活后调节miR‑124/TACE对心肌梗死大鼠炎症和免疫功能的影响。
1 材料和方法
1.1 试剂与耗材 GTS‑21(3‑[(2,4‑dimethoxy)benzylidene]‑anabaseinedihydrochloride,DMXBA)购于美国MedChemExpress 公司。70 只SD 大鼠购于武汉亚洲心脏病医院动物实验中心。裂解缓冲液和戊巴比妥钠均购于天根生物技术(北京)有限公司。1.5%的2,3,5-三苯基氯化四氮唑购于美国sigma 公司。肌酸激酶CK测定试剂盒购于南京建城生物工程 研 究 所 ;血 清 CK ‑MB(ARB10700)和 cTnT(ARB13662)的ELISA 试剂盒均购于美国Rapidbio公司。LDH 的活性检测试剂盒购于南京建城生物工程研究所。NF‑κB,TNF‑α,IL‑1β和IL‑6的ELISA试剂盒均购于武汉Uscn Life 科学有限公司。双辛可宁酸(BCA)蛋白测定试剂盒购于上海碧云天生物技术研究所。硝酸纤维素膜购于美国Millipore公司。Ecl化学发光系统购于南京诺唯赞生物科技有限公司。兔抗鼠的α7nAChR、TACE 和GAPDH抗体均购于美国Abcam公司。FITC偶联的抗CD3,PE‑A偶联的抗CD8和FITC‑A偶联的抗CD4的抗体均购于美国Abcam 公司。miR‑124 的拟似物(mimic)和mimic 阴性对照(NC)以及miR‑124 抑制剂(inhibitor)均购于上海吉玛公司。用TACE 3'UTR 野 生 型 序列(TACE‑3'‑UTR‑wt)和 突 变 的TACE 的 3'‑UTR 序列(TACE‑3'‑ UTR-mut)构建的荧光素酶报告载体均由上海碧云天公司构建。
1.2 动物模型 70只SD大鼠(8~10周,体质量250~300 g),在(23±1)℃,相对湿度50%,12 h明暗循环环境中饲养,自由饮水采食。实验大鼠在接受戊巴比妥钠(40 mg/kg)腹膜内麻醉后,在第3和第4肋间隙之间左胸骨边界开胸;除去心包,将左心室表面的心脏和血管分开。使用1~2 mm 5‑0 丝线将左冠状动脉前降支结扎在左心耳下方;然后注射青霉素和链霉素,以防止感染。通过结扎左冠状动脉前降支制备AMI 大鼠模型,60 只AMI 模型大鼠建立成功。10只大鼠进行了假手术,除未进行冠状动脉结扎,其余过程与AMI组一致[9]。
1.3 动物分组和药物注射 将GTS‑21(5、10 和20 mg/kg)溶于生理盐水中。将AMI 模型的60 只大鼠随机数字表法分为6 组,每组10 只大鼠:AMI 组即模型组。其余 5 组分别为 GTS‑21‑5、GTS‑21‑10、GTS‑21‑20、inhibitor+GTS‑21‑20 组、mimic+GTS‑21‑20 组,分别对应的是 5、10 和 20 mg/kg GTS‑21 静脉注射大鼠 1 周,1 次/d,以及 20 mg/kg GTS‑21 联合1.5 μmol/L 的 inhibitor 静脉注射大鼠 1 周,1 次/d 和20 mg/kg GTS‑21及联合 1.5 μmol/L 的mimic 静脉注射大鼠1 周,1 次/d。未进行冠状动脉结扎的为sham组。
1.4 梗死面积测量 注射水合氯醛麻醉大鼠,通过断头处死所有实验大鼠。将心脏通过主动脉插管,并用生理盐水洗涤。结扎冠状动脉6 h 后,将左心室在‑80℃下孵育5 min,然后切成2 mm 的切片。与2,3,5-三苯基氯化四氮唑共孵育后,无染色的心脏区域表示缺血性心肌,而染成红色的区域表示心肌正常。通过占左心室的百分比大小来测量sham组、AIM 组、GTS‑21‑5 组、GTS‑21‑10 组、GTS‑21‑20组的梗死区域面积。
1.5 检测 CK、CK‑MB、LDH、cTnT 冠状动脉结扎后6 h 从腔静脉采集大鼠血清样品。将样品以3 500×g 离心5 min,确定心肌特异性酶肌酸激酶(creatine kinase, CK)、CK 的MB 同工酶(creatine kinase‑isozyme MB, CK‑MB)、乳酸脱氢酶(lactic dehydrogenase, LDH)、心肌肌钙蛋白(cardiac troponin,cTnT)的水平。使用CK 试剂盒检测CK 的活性。CK‑MB、cTnT 的活性通过 CK‑MB 和 cTnT 的ELISA 试剂盒进行定量。根据制造商的说明使用比色法分析 sham 组、AIM 组、GTS‑21‑5 组、GTS‑21‑10组、GTS‑21‑20组的LDH的活性。
1.6 NF‑κB,TNF‑α,IL‑1β 和IL‑6 水平检测 在3 h的缺血期之后,将全血样品在血清分离管中凝结30 min。然后将血清样品以1 000×g 离心25 min,并保持在‑80°C下直至进一步使用。严格按照市售NF‑κB,TNF‑α,IL‑1β 和IL‑6 的 ELISA 试剂盒说明,检测血清中 sham 组、AIM 组、GTS‑21‑5 组、GTS‑21‑10 组、GTS‑21‑20 组、inhibitor+GTS‑21‑20 组的 NF‑κB,TNF‑α,IL‑1β和IL‑6的水平。
1.7 实时定量PCR(Real‑time quantitative PCR,RT‑qPCR) 使用TRIzol一步法从心肌细胞和心肌组织中提取总RNA。通过测定总RNA 的质量,并相调节RNA浓度。采用两步法对提取的RNA进行反转录。使用以下反应条件:70 ℃、10 min,冰浴2 min,42 ℃、60 min和70 ℃、10 min。将反转录的cDNA暂时置于‑80 ℃,并用 RT‑qPCR 对 cDNA 进行定量。RT‑qPCR 的反应条件如下:在95 ℃下预变性30 s的一个循环,随后在95 ℃下进行40 个循环的10 s 变性,在60 ℃下退火10 s。并在70 ℃下延伸10 s。U6用于miR-124的内参基因,使用相对定量方法。采用2‑ΔΔCt计算每个靶基因的相对表达倍数。
1.8 荧光素酶报告基因实验 利用生物信息学预测网站 microRNA.org 预测 miR‑124 靶基因,并精确预测miRNA 可识别得潜在靶位点。利用含有miR‑124结合位点的TACE 3'UTR野生型序列(TACE‑3'‑UTR‑wt)和突变的 TACE 的 3'‑UTR 序列(TACE‑3'‑UTR‑mut)构建荧光素酶报告载体,并将其转染到H9C2大鼠心肌细胞中。使用荧光素酶报告基因测定试剂盒检测荧光素酶活性。
1.9 蛋白免疫印迹分析检测TACE蛋白表达 心脏样本中提取总蛋白,储存于‑80 ℃。心肌样本于冰冷的裂解缓冲液中匀浆。在4 ℃下以13 200×g 离心20 min 后,收集上清液,并使用双辛可宁酸(BCA)蛋白测定试剂盒对总蛋白水平进行定量。然后通过SDS‑PAGE 分离蛋白质样品(50~70 µg),并转移到硝酸纤维素膜上。将膜用含5%脱脂牛奶和 0.1%吐温‑20 的 10mM Tris‑HCl 封闭,在室温下静置 1~2 h,然后与抗 α7nAChR(1:800)、抗TACE(1:600)和抗GAPDH(1:1 000)共孵育,4℃过夜。用含TBST 溶液洗涤3 次后,将膜与辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(1:5 000)在室温下孵育2 h。使用增强的化学发光系统将结合的抗体显色,并用X 射线胶片曝光。GAPDH 用作相对定量的内参蛋白。使用Image‑Proplus 软件6.0分析每个样品的表达水平。
1.10 流式细胞术检测血液CD3+、CD4+和CD8+细胞亚群比例 使用的荧光染料偶联的单克隆抗体是FITC偶联的抗CD3,PE‑A偶联的抗CD8和FITC‑A 偶联的抗 CD4,在室温与 sham 组、AIM 组、GTS-21‑5组、GTS‑21‑10组、GTS‑21‑20组、inhibitor+GTS‑21‑20 组的血液单个核细胞分别孵育1 h。根据制造商的说明进行CD3,CD4 和CD8 的流式细胞仪分析。在BD FACSCalibur 上收集荧光数据,并使用FlowJo软件进行分析。
1.11 统计学处理 使用SPSS 21.0统计软件分析所有数据。具有正态分布的计量资料以均数±标准差()。单因素方差分析用于多个组之间的比较,Bonferroni 法两两比较校正P值。t检验分析用于荧光素酶报告实验结果中两组间的比较。P<0.05为差异有统计学意义。
2 结果
2.1 AMI 大鼠模型心肌损伤变化 AMI 组的梗死面积(42.15±2.11)%与sham 组(27.14±2.17)%比较,AMI 组梗死面积增加,差异有统计学意义(P<0.05)。使用α7nAChR 激动剂GTS‑21(5、10、20 mg/kg)治疗后,梗死面积减少至(34.86±1.61)%、(32.56±2.01)%和(31.94±1.79)%,差异有统计学意义(均P<0.05,n=10)。另外,GTS‑21 治疗后,原本被AMI 上调的心肌特异性酶(CK,CK‑MB,LDH和cTnT)活性均被GTS‑21下调,差异有统计学意义(均P<0.05)。图1、表1。

表1 AMI大鼠的心肌损伤标志物数值

图1 AMI大鼠心肌组织的三苯基氯化四氮唑染色
2.2 AMI 大鼠模型中NF‑κB、TNF‑α、IL‑1β、IL‑6 的活性 与sham 组(11.6±1.10)ng/mg比较,AMI组的NF‑κB 活性提高至(57.05±4.31)ng/mg(P<0.05)。用GTS‑21(5、10、20 mg/kg)处理后,NF‑κB活性降低至(38.21±2.29)ng/mg(P<0.05)、(32.25±2.89)ng/mg(P<0.05)、和(29.18±6.33)ng/mg(P<0.05)。差异均有统计学意义。与sham 组(66.87±6.32 pg/mg)比较,AMI 组的 TNF‑α 活性增加至(299.42±8.03)pg/mg,差异有统计学意义(P<0.05)。在GTS-21 治疗组(5、10、20 mg/kg)中,TNF‑α 活性降低至(202.13±9.11)pg/mg(P<0.05),(187.8±8.41)pg/mg(P<0.05),(175.32±6.32)pg/mg(P<0.05),差异有统计学意义。与 sham 组比较,AMI 载体组的 IL‑1β 和IL‑6 的活性提高,差异有统计学意义(均P<0.05)。在GTS‑21 治疗组(5、10、20 mg/kg)中,IL‑1β 和IL‑6的活性降低,差异均有统计学意义(P<0.05)。蛋白免疫印迹检测 TACE 的表达,与 sham 组比,AMI 组的TACE 表达上调,差异有统计学意义(P<0.05)。在GTS‑21 治疗组,TACE 的表达均下调。差异有统计学意义(P<0.05),图2。

图2 AMI大鼠模型中NF‑κB,TNF‑α,IL‑1β和IL‑6的活性
2.3 AMI 大鼠 CD3+、CD4+、CD8+细胞的百分率变化 与sham 组中的(56.23±2.66)%比较,AMI 组的CD3+百分率活性提高至(73.6±7.36)%,差异有统计学意义(P<0.05)。用GTS‑21(5、10、20 mg/kg)处理后,CD3+百分率降低至(68.21±5.33)%(P<0.05)、(64.25±7.89)%(P<0.05)、(59.44±3.92)%(P<0.05,n=10)。差异均有统计学意义。与sham组中CD4+:CD8+的比率(1.85±0.11)比较,AMI 组的CD4+:CD8+的比率降低为(1.32±0.02),差异有统计学意义(P<0.05)。用GTS‑21(5、10、20 mg/kg)处理后,CD4+:CD8+的比率升高为(1.49±0.17)(P<0.05)、(1.56 ± 0.08)(P<0.05)、(1.68 ± 0.35)(P<0.05)。差异均有统计学意义,图3A,3B。

图3 急性心肌梗死大鼠血液中的(A)CD3+细胞的百分率和(B)CD4+/CD8+的比率
2.4 激活 α7nAChR 对miR‑124 的影响 使用GTS‑21 治疗 AMI 大鼠后,心肌组织中的 α7nAChR 的蛋白表达增加,差异有统计学意义(P<0.05,图4A)。另外,本研究发现 GTS‑21‑20 治疗后,心肌组织中miR‑124 增加到近4 倍(图4B),差异有统计学意义(P<0.05)。

图4 急性心肌梗死大鼠模型中α7nAChR和miR‑124的表达
2.5 TACE 是 miR‑124 的靶基因 如图 5,TACE mRNA 3’‑UTR 区域和 miR‑124 的序列具有结合位点。使用荧光素酶报告基因法验证miR‑124 在预测的结合位点具有功能。图5 显示,mimic 对Mut‑TACE 的荧光素酶活性的影响差异无统计学意义(P>0.05),mimic 降低了 wt‑TACE 的荧光素酶活性强度,差异有统计学意义(P<0.05)。另外结果显示mimic 可以抑制TACE 的体外表达,差异有统计学意义(P<0.05),而 NC 组对 TACE 的表达并无影响(P>0.05)。
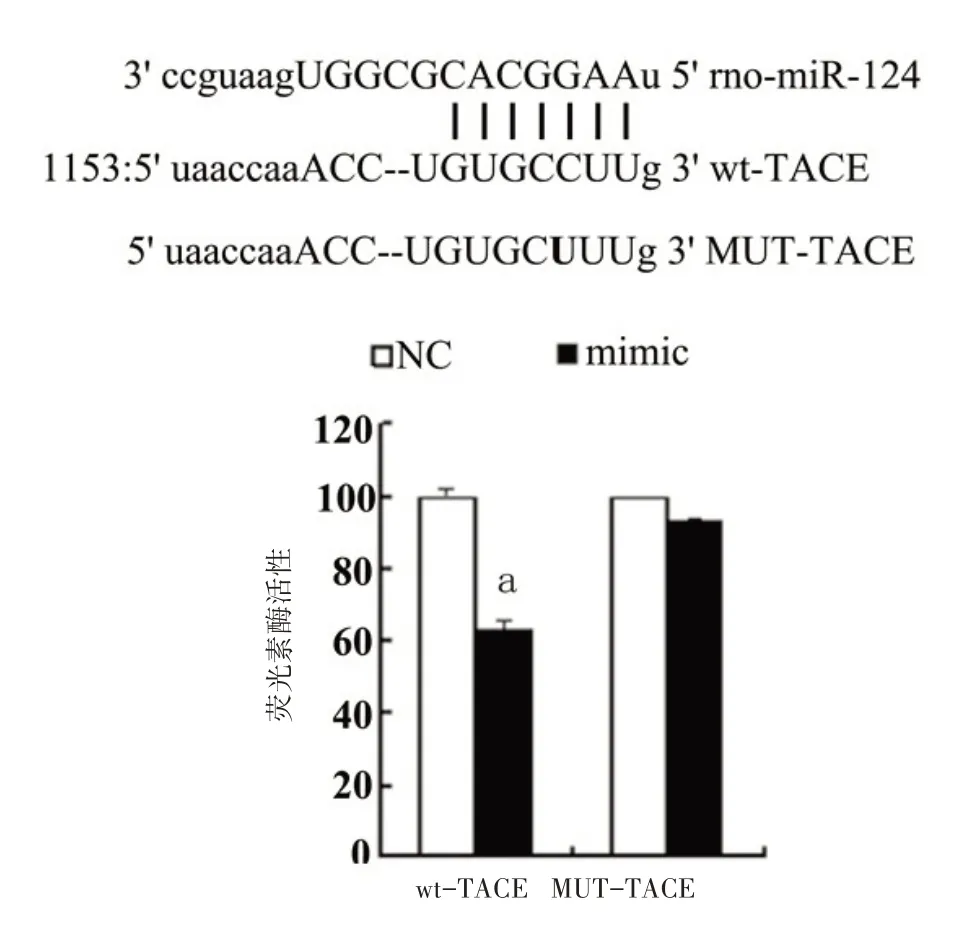
图5 荧光素酶基因报告实验检测大鼠心肌细胞中miR‑124和TACE‑3’UTR的结合作用
2.6 miR‑124 抑制剂阻断 GTS‑21 的治疗效果 由于 GTS‑21 心肌组织中 miR‑124 增加到近 4 倍,本研究使用miR-124 的抑制剂(inhibitor)后,与GTS‑21‑20组比较(29.18±6.33 ng/mg),inhibitor+GTS‑21‑20组的的NF‑κB活性(50.23±3.55 ng/mg)增高。差异均有统计学意义(P<0.05),但是仍低于AMI 组(57.05±4.31 ng/mg),差异均有统计学意义(P<0.05,n=10)。与GTS‑21‑20 组[(175.32±6.32 pg/mg)、(3.69±0.26 pg/mg)、(2.98±0.45 pg/mg)]比较,inhibitor+GTS‑21‑20 组的TNF‑α、IL‑1β、IL‑6 的活性分别增加至(229.48±7.88 pg/mg)、(5.19±0.33 pg/mg)、(3.34±0.52 pg/mg)差异均有统计学意义(P<0.05),而inhibitor+GTS‑21‑20 组 TNF‑α、IL‑1β、IL‑6 的活性均低于AMI 组[(299.42±8.03 pg/mg)、(6.89±0.43 pg/mg)、(5.46±0.29 pg/mg)],差异均有统计学意义(P<0.05,n=10)。另外,与GTS‑21‑20 组CD4+:CD8+的比率(1.58±0.12)比较,inhibitor+GTS‑21‑20 组的 CD4+:CD8+的比率降低为(1.45±0.08),差异有统计学意义(P<0.05),而且仍高于AMI组的CD4+:CD8+的比率(1.32±0.02),差异有统计学意义(P<0.05)。
最后,我们利用miR‑124的拟似物(mimic)降解TACE,与 GTS‑21‑20 组比较(1.00±0.09),mimic+GTS‑21‑20组的TACE 蛋白的相对表达水平(0.07±0.02)被显著抑制(P<0.05,n=10)(图6);与GTS‑21‑20组(29.18±6.33 ng/mg)比较,mimic+GTS‑21‑20组的NF‑κB 的活性(25.10±1.44)ng/mg 降低,差异均有统计学意义(P<0.05,n=10)。与 GTS‑21‑20 组[(175.32±6.32 pg/mg)、(3.69±0.26 pg/mg)、(2.98±0.45 pg/mg)]比较,mimic+GTS‑21‑20组的TNF‑α、IL‑1β、IL‑6的活性分别降低至(150.22±10.98 pg/mg)、(3.04±0.19 pg/mg)、(2.55±0.16 pg/mg),差异均有统计学意义(P<0.05),与GTS‑21‑20 组CD4+:CD8+的比率(1.58±0.12)比较,mimic+GTS‑21‑20 组的CD4+:CD8+的比率升高为(1.72±0.07),差异有统计学意义(P<0.05)。
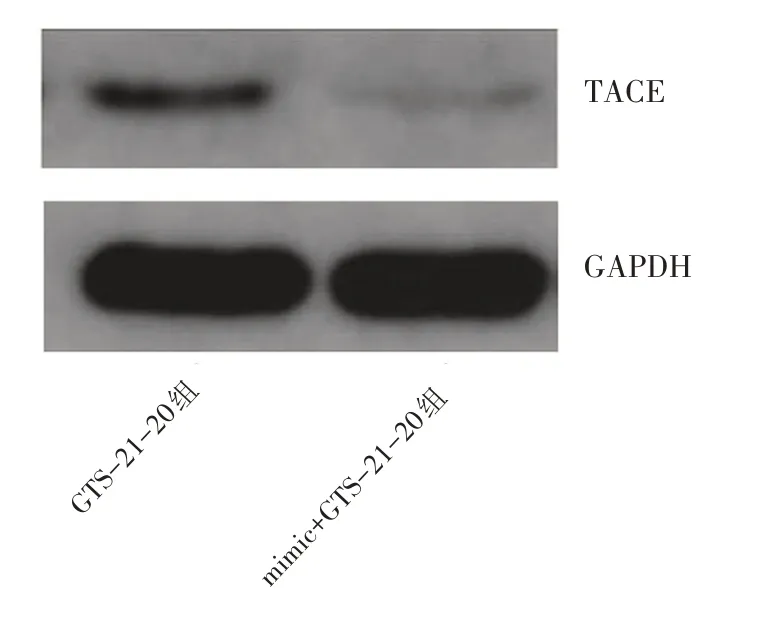
图6 Western blot检测急性心肌梗死大鼠模型中TACE的蛋白表达
3 讨论
目前,心肌梗死仍然是人类死亡的主要原因之一。多项研究表明,免疫炎症诱发的促炎性细胞因子分泌失调在心肌梗死发展中起关键作用[10]。同时免疫功能的异常对心肌缺血或心力衰竭的病理发展其关键作用。有研究显示,心肌缺血诱发免疫细胞因子增加,并对心肌造成进一步损害[11]。免疫细胞因子异常升高不仅抑制心肌细胞功能,而且也是导致心肌细胞损害、心脏重构等病理变化的重要原因[11]。本研究发现促炎性细胞因子TNF‑α 及其转化酶TACE 在AMI 中上调,但是我们激活α 7nAChR 后 TACE 可被 miR-124 特异性负调节,同时激活α7nAChR 可以明显改善AMI 的心肌梗死特征、免疫功能和炎症水平,表明α7nAChR 是心肌梗死免疫功能和炎症水平的关键调节因子。
机体免疫细胞平衡以及抗炎反应是体现机体免疫功能的关键指标。有研究发现,使用α7nAChR激动剂PNU282987处理后,可以修复糖尿病引起的伤口愈合并且明显改善机体内免疫失衡[12]。本研究同样表明GTS‑21 可以降低CD3+细胞数并恢复CD4+/CD8+的细胞比率。本研究还观察到,当联合GTS‑21 和 miR‑124 抑制剂处理后,CD4+/CD8+的细胞比率比 GTS‑21 组降低。表明 GTS‑21 激活 α 7nAChR后能通过改善AMI大鼠的免疫平衡从而保护AMI心肌损伤,激活α7nAChR导致miR‑124的表达增加是其关键作用机制之一。
最新的研究表明,炎症反应在缺血性心脏病的发展和进程中起着重要的作用。NF‑κB 是AMI 期间心脏组织中的炎性因子,是与各种生物学过程相关的转录因子[13]。NF‑κB‑p65是NF‑κB 的主要反式激活转录激活因子,在炎症过程中具有调节功能[14]。促炎细胞因子已被证明在AMI期间被上调,其中最重要的是TNF‑α,IL‑1β 和IL‑6[15]。且TNF‑α,IL‑1β和 IL‑6 的激活受 NF‑κB 调节[14]。已发现 α7nAChR的药理激动剂可改善缺血再灌注损伤[16]。然而,在心肌梗死中的作用仍鲜有研究。α7nAChR 的药理激动剂具有抗氧化,抗炎和抗凋亡的作用。先前的研究表明,α7nAChR 的激动剂PNU282987 可剂量依赖性减少炎症因子 TNF‑α 和 IL‑6 的分泌[17]。另一篇研究缺血后心肌组织的研究也证实,PNU282987 治疗后 TNF‑α、IL‑6、及 p‑NF‑κBp65(Ser536)在心肌组织中表达明显降低[18]。本研究结果与之一致,本研究使用另一种α7nAChR 激动剂GTS‑21 对AMI 大鼠注射后,其心肌组织中的 α7nAChR 表达明显增多,而且 TNF‑α、TACE、IL‑6、IL‑1β、NF‑κB 均明显降低。因此,结果表明,α7nAChR 激动剂有明显的抗AMI 炎性反应的作用,而且α7nAChR激动剂可能通过抗炎机制保护AMI心脏损伤。
α7nAChR 激动剂具有明显的心肌保护功能。AMI的梗死面积和心肌特异性酶(CK,CK‑MB,LDH和cTnT)的表达水平高低是评估AMI 引起的心脏损害的重要指标。CK,CK‑MB 和cTnT 广泛分布在心肌细胞的细胞质上,并且接受AMI的大鼠中CK,CK‑MB 和cTnT 的活性。我们的研究发现AMI组的梗死面积明显增多,但是GTS‑21 治疗后,梗死面积大幅度减少,而且心肌特异性酶(CK,CK‑MB,LDH和 cTnT)活性均被 GTS‑21 下调。Li 等[18]的研究支持我们的结果,使用α7nAChR 激动剂PNU282987处理后,血清cTnI 和CK‑MB 水平明显降低。本研究表明,α7nAChR 激动剂降低AMI 大鼠模型的心肌梗死面积以及CK,CK‑MB,LDH 和cTnT 活性,从而表明α7nAChR对AMI具有心脏保护作用。
研究表明,LPS 适度诱导的 miR‑124 高表达后可以靶向抑制 TACE 并影响 TNF‑α 分泌的能力[8]。而本研究中α7nAChR 激动剂诱导心肌组织中miR‑124的水平,而α7nAChR 激动剂同样可抑制心肌组织中的TACE 水平。并且,我们的荧光素酶基因报告实验证实TACE 是miR‑124 在心肌细胞中的靶基因,miR‑124 抑制TACE 的表达。我们观察到 α7nAChR 激动剂使 TNF‑α 的水平明显降低,而在联合使用α7nAChR 激动剂和miR-124 的抑制剂后,TNF‑α 的水平反而增高表明 α7nAChR 通过miR‑124 抑制 AMI 大鼠的TNF‑α 的水平。miR‑124抑制剂对 NF‑κB、IL‑6 和IL‑1β 的影响均有类似的效果。另外,研究同样证实miR‑124 可以对STAT3进行下调从而限制STAT3 对IL‑6 的正反馈,导致IL‑6 分泌降低[19]。这表明 α7nAChR 激动剂对 miR‑124 的正调节从而对 TNF‑α、IL‑6、IL‑1β 的表达均有抑制作用。因此以上研究表明,α7nAChR 激活后通过促进miR‑124 的表达,从而影响AMI 的免疫炎症和促炎因子的分泌。
总之,本研究表明α7nAChR 激活后能够减轻AMI 引起的免疫炎症失调。α7nAChR 激活的心脏保护作用可能与负调节miR‑124 介导炎症传导有关。因此α7nAChR 激动剂对AMI 的治疗具有潜在的应用价值。
