慢性失眠症患者认知功能与背外侧前额叶皮质代谢物磁共振波谱研究☆
2021-10-25仝太山孙宗琼蔡炜程灶火赵鹏
仝太山 孙宗琼 蔡炜 程灶火 赵鹏
近年来失眠与认知功能的关联研究受到重视[1],研究发现慢性失眠症(chronic insomnia disorder,CID)患者与正常睡眠者在认知领域的能力存在差异[2-5],失眠可能是认知功能损害的独立危险因素之一[6]。功能磁共振研究结果表明,前额叶功能状态可能是认知功能损害的敏感生物标志物[7]。另外氢质子波谱磁共振(proton magnetic resonance spectroscopy,1H-MRS)对轻度认知功能障碍相关的病理生理过程敏感[8],在疾病早期诊断和监测疾病进展中可用于检测脑代谢标志物浓度变化[9]。目前利用1H-MRS对CID认知功能损害的研究有限。本研究假设CID患者认知功能改变与背外侧前额叶皮质 (dorsolateral prefrontal cortex,DLPFC)代谢物水平有关,拟测量CID患者的认知功能损害情况及DLPFC代谢物浓度水平,并进行相关分析,探讨相关神经影像学机制。
1 对象与方法
1.1 研究对象CID患者来自江南大学附属医院2019年12月至2020年12月心理睡眠门诊。纳入标准:①符合《精神障碍诊断与统计手册第5版》慢性失眠症诊断标准,病程≥3个月;②年龄18~50岁;③小学以上文化,右利手;④未经药物或物理治疗;⑤慢性失眠症无认知损害组(non cognitive impairment,CID-NI)蒙特利尔认知评估(Montreal cognitive assessment,MoCA)得分≥26分;⑥慢性失眠伴轻度认知损害组 (mild cognitive impairment,CID-MCI)符合Petersen轻度认知损害诊断标准[10],MoCA得分≥20分且<26分。排除标准:①伴有脑器质病变;②伴有其他慢性疾病(甲状腺疾病、糖尿病等);③有精神障碍史;④17项汉密尔顿抑郁量表 (Hamilton depression scale,HAMD)>7分或14项汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)>7 分;⑤有烟草、酒精或其他精神活性物质滥用史;⑥倒班工作者。纳入CID-NI组共29例患者,CID-MCI组共27例患者。
同时期于体检中心招募健康対照(healthy control,HC)。纳入标准:①睡眠正常;②年龄 18~50岁;③小学以上文化,右利手;④年龄、性别与患者相匹配;⑤与患者无血缘关系。排除标准同CID患者。共纳入30名对照。
本研究方案得到本单位伦理委员会批准。所有受试者详细了解本研究,并签署知情同意书。
1.2 研究方法
1.2.1 认知功能评估 采用MoCA评价受试者认知功能状况。测试领域包括视空间与执行功能、命名能力、注意力、语言、抽象能力、延迟回忆、定向力。研究发现MoCA区分轻度认知障碍与痴呆较简易智力状态检查 (mini-mental state examination,MMSE)更为灵敏,且特异性高,筛查轻度认知功能损害截断值可选择26分[11]。本研究根据MoCA评分划分CID-MCI组(≥20分且<26分)与CID-NI组(≥26 分)。
1.2.2 睡眠质量评估 匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)为临床中常用的评价睡眠质量量表,用于评价所有受试者近1个月内睡眠情况,总分为0~2l分,≥7分提示有睡眠障碍,得分越高,提示睡眠质量越差[12]。
1.2.3 头部MRI检查 所有受试者行常规MR及多体素1H-MRS扫描。使用美国通用公司3.0 T磁共振检查,8通道头线圈。扫描序列包括常规头颅平扫及多体素波谱 (multi voxel spectroscopy,MVS)。平扫采用 T1WI、T2WI、液体衰减反转恢复序列(FLAIR)。MVS采用 2D点分辨波谱序列(point resolved spectroscopy,PRESS),T2WI为 MVS定位相,感兴趣区定位于DLPFC。在Linux系统下,利用LCModel联合SAGE 7.0软件进行后处理。分析代谢物绝对浓度,包括N-乙酰天冬氨酸(N-acetylaspartate,NAA)、含胆碱化合物(cholinecontaining compounds,Cho)、肌醇 (myo-inositol,MI)、谷氨酰胺+谷氨酸 (glutamine+glutamate,Glx)和肌酸复合物(total creatine,tCr)。
1.3 统计学方法采用SPSS 24.0分析数据。性别组间比较采用检验。年龄、受教育年限、各量表得分、脑代谢物浓度等数据呈正态分布,用±s描述,组间比较使用单因素方差分析,两两比较采用LSD法。以性别、年龄、受教育年限、HAMD、HAMA为协变量,采用偏相关分析CID患者认知功能与代谢物浓度水平的相关性。检验水准α=0.05,双侧检验。
2 结果
2.1 一般资料与认知功能3组研究对象性别、年龄、受教育年限无统计学差异(P>0.05)。3组间PSQI(F=178.74,P<0.01)、HAMD(F=9.81,P<0.01)、HAMA(F=6.12,P<0.01)评分有统计学差异,其中,CID-MCI组 PSQI评分高于 CID-NI组(P<0.05),2组CID患者PSQI、HAMD和HAMA评分均高于NC组(P<0.05)。3组MoCA评分有统计学差异(F=142.61,P<0.01),CID-MCI组较 CID-NI组和HC 组低(P<0.05)。见表 1。

表1 一般资料与认知功能评分
2.2 DLPFC代谢物绝对浓度左侧DLPFC:3组间 Cho 浓度 (F=8.86,P<0.01)、MI浓度 (F=13.29,P<0.01)有统计学差异,两两比较,均为 CID-MCI组与 CID-NI组较 HC 组高(P<0.05),CID-MCI组较CID-NI组高(P<0.05);NAA、Glx、tCr组间差异无统计学意义(P>0.05)。
右侧 DLPFC:3组间 Cho浓度 (F=4.47,P=0.01)、MI浓度(F=3.73,P=0.03)有统计学差异,两两比较,均为CID-MCI组均较CID-NI组、HC组高(P<0.05),CID-NI组与 HC 组间无统计学差异(P>0.05);NAA、Glx、tCr组间差异无统计学意义(P>0.05)。见表 2。
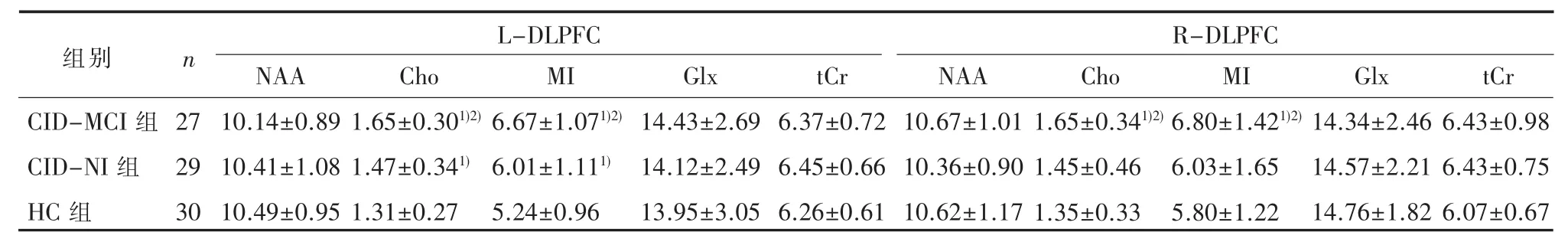
表2 DLPFC代谢物绝对浓度(mmol/L)
2.3 认知功能评分与代谢物绝对浓度的相关性在所有CID患者中,控制性别、年龄、受教育年限、HAMD、HAMA后的偏相关分析显示,左侧DLPFC区Cho浓度与MoCA评分呈负相关 (r=-0.35,P=0.01),右侧DLPFC区Cho浓度与MoCA评分呈负相关(r=-0.33,P=0.02)。
3 讨论
本研究利用认知功能评估和1H-MRS技术观察CID患者的认知功能特征及DLPFC区脑代谢物浓度,发现CID患者MoCA评分降低,并且该评分与双侧DLPFC区Cho浓度存在负相关。提示失眠与认知功能损害之间可能存在的神经影像学机制,DLPFC区在认知领域中起着关键作用,脑代谢物浓度改变可能作为评估失眠患者伴认知功能损害的神经影像标志物。
既往研究证实前额叶皮质区在认知功能中具有重要作用,失眠症患者在工作记忆任务中表现出额顶叶皮质激活减少[13],在语言流畅性任务中也存在前额叶低激活现象[14]。DLPFC区对失眠、压力及正常老化有明显的敏感性[15]。
本研究利用1H-MRS技术发现CID患者DLPFC区脑代谢物较HC出现变化,主要体现在MI和Cho浓度水平。MI升高与认知功能损害疾病中的胶质细胞增殖和小胶质细胞激活有关[16],同时与促炎性细胞因子及相关神经毒性有关[17],并且MI升高影响神经元兴奋性和神经递质释放[18]。用1H-MRS定量的神经胶质代谢物MI可作为神经退行性疾病生物标志物[9]。研究还发现即使NAA没有降低,轻度认知功能损害患者的MI也升高[19],MI升高被认为是早期认知功能损害的标志物,而NAA降低与痴呆病理学相关[20]。这些研究提示CID患者出现认知功能损害可能与DLPFC区MI关系密切,患者存在神经胶质细胞活化的可能。国内的研究也提示失眠患者胶质细胞与认知损害相关[21]。同时本研究没有观察到NAA的改变,推论失眠患者的轻度认知功能损害在病理进程中尚处于早期。NAA可以反映神经组织可逆性功能障碍[22],认知功能损害是否能够随着失眠症状的改善而得到逆转有待长期观察。
Cho参与细胞膜代谢及髓鞘形成,是神经元密度和膜转换率的标志物,对记忆功能至关重要[23]。Cho升高往往反映细胞膜分解代谢,游离胆碱增加[24]。结合本研究观察到的DLPFC区Cho浓度升高,并且与认知功能评分呈负相关,提示CID患者出现认知功能损害可能与DLPFC区胆碱能神经元变性有关。另外,本研究并没有观察到Glx、tCr浓度显著性差异,考虑其与认知功能相关性较小,这与既往研究结论相同[25]。
综上,本研究结果提示CID-MCI患者DLPFC区可能存在神经胶质细胞活化及胆碱能神经元变性,介导了认知功能的改变。但本研究中1H-MRS提供的单一影像学指标不足以明确与失眠伴认知功能损害相关的全部病理生理过程。未来有待大样本、多中心、多模式磁共振研究,深入探讨其相关神经影像学机制。
