气相色谱质谱法测定土壤中5种苯并咪唑类的残留
2021-10-23郭延萍刘永玲
郭延萍,刘永玲
(海东市生态环境局,青海 海东 810600)
0 引 言
苯并咪唑类杀菌剂,是指含有杀菌活性的咪唑环类的有机化合物,如噻菌灵、咪鲜胺等,在农业、林业等广泛应用,确保农作物、林作物等高产、稳定[1-3]。该类杀菌剂属于内吸性杀菌剂,通过与病原真菌的微管蛋白结合,抑制病菌细胞的有丝分裂,起到杀菌、抑菌的作用[4]。苯并咪唑类杀菌剂常用于水稻类纹枯病、稻瘟病,小麦类黑穗病、赤霉病,瓜果类白粉病、灰霉病等,该类杀菌剂毒性低,且能够抑制病菌生长,在杀菌剂市场占据着关键的地位,随着对具有抗菌活性的咪唑类杀菌剂和分子生物学的研究,该类杀菌剂的应用也越来越广[5]。据统计,杀菌剂在喷洒、施用时,约20%起到杀菌、抑菌作用,大部分的杀菌剂随着空气流通、雨水冲刷等进入到土壤中,对土壤环境造成不可逆的损伤,严重影响土壤微生物、动物等生态系统[6]。因此,加强对典型土壤中苯并咪唑类杀菌剂残留的监测,具有重要的意义。
常用于土壤前处理的提取方法主要有:固液萃取提取法、超声提取法和加速溶剂提取法等;净化的主要方法有:凝胶净化色谱法、QuEChERS (Quick、Easy、Cheap、Effective、Rugged、Safe)净化法和固相萃取净化法等方法[7-9]。提取方法中,加速溶剂萃取是在高温、高压条件下进行多次提取,提取效率相对最佳;净化方法中,QuEChERS 净化法相对其他方法,具有试剂用量少,净化效果好、操作简便等优点,实验开发一种采用加速溶剂提取法将典型土壤中噻菌灵、恶咪唑、抑霉唑、咪鲜胺和氟菌唑提取出来,QuEChERS 净化法将提取液净化后,上GCMS/MS 仪定量测定的分析方法[10-15]。实验证明,此方法检测准确度高、灵敏度高,可以用于典型土壤中苯并咪唑类杀菌剂残留的监测。
1 试验部分
1.1 仪器
气相色谱仪:Agilent 7890B 型,配备自动进样器、柱温箱(美国安捷伦公司);三重四级杆串联质谱仪:Agilent 7000D 型(美国安捷伦公司);电子分析天平:sartorius Quintix65-1CN 型(十万分之一,德国赛多利斯公司);加速溶剂萃取仪:Thermo ASE-300 型(美国热电公司);高速冷冻离心机:Biobase TGL-20M 型(山东博科公司);纯水制备仪:Milli-Q direct 16 型(美国密理博公司)。
1.2 标准物质和试剂
噻菌灵标准溶液:100µg/mL,编号为GBW(E) 082320;抑霉唑标准溶液:100µg/mL,编号为GBW(E) 082421;咪鲜胺标准溶液:100µg/mL,编号为GBW(E) 082347;氟菌唑标准溶液:100 µg/mL,编号为BWQ 8059—2016;恶咪唑标准物质:100 mg/瓶,编号为C15789000,以上均购自农业农村部环境保护科研监测所。乙腈、丙酮、正己烷、甲醇:色谱纯(上海安谱科技有限公司);实验用水均为去离子水,纯水制备仪制备,其他试剂均为分析纯(上海化学试剂厂)。
1.3 仪器方法
1.3.1 色谱条件
气化室温度:240 ℃;色谱柱:HP-5 MS(规格:30 m×0.25 mm,0.25 µm)载气:氦气,纯度99.9999%;柱流量:1.15 mL/min;进样方式:不分流;进样量:1 µL,梯度升温。升温程序见表1。

表1 程序升温方法
1.3.2 质谱条件
离子源:ESI 源;电子轰击电压:65 eV;离子源温度:270 ℃;碰撞气:氩气,纯度99.9999%;接口温度:260 ℃;采集模式:MRM;溶剂延迟:3.6 min。
1.4 实验方法
1.4.1 标准储备溶液的配制
取恶咪唑标准物质,精密称取50 mg,置50 mL量瓶中,加甲醇溶解并稀释至刻度,混匀;再精密移取100 µL 该溶液,置10 mL 量瓶中,另取噻菌灵、抑霉唑、咪鲜胺和氟菌唑标准溶液,分别精密移取1.0 mL,置上述10 mL 量瓶中,加甲醇定容至刻度,混匀(5种杀菌剂浓度均为:10 µg/mL)。
1.4.2 标准溶液的配制
取1.4.1 标准储备溶液,定量移取适量,分别置10 mL 量瓶中,制备含5种杀菌剂浓度依次为0.05,0.15,0.6,2.0,6.0,15.0 µg/mL 的标准系列溶液,加甲醇定容至刻度,混匀。
1.4.3 样品溶液的制备
前处理:取研细后的典型土壤样品,过60 目筛网,取过筛后的土壤样品12 g,加15 g 硅藻土,混合均匀后装填至22 mL 的萃取罐中,用乙腈-丙酮(体积比为1∶1)混合溶剂萃取。萃取方法见表2。

表2 萃取条件
净化:将上述萃取液转移至旋蒸瓶中,45 ℃旋蒸至近干,用20 mL 冰醋酸(1%)-乙腈溶液转移至50 mL 塑料离心管中,加入分散固相萃取剂硫酸镁5 g、乙酸钠2 g 盐析,涡旋1 min,高速冷冻离心6 min(转速为10000 r/min);将离心后的上清液转移至25 mL 装有净化试剂PSA 的净化管中,涡旋1 min,高速冷冻离心6 min(转速为10000 r/min)。将离心后的净化液置试管中,氮吹至近干(温度45 ℃),残渣加甲醇1 mL,混匀即得。
2 结果与讨论
2.1 提取方法的选择
土壤基质通常含有大量的无机物、有机物、水分等,如金属氧化物、硅酸盐等,成分较为复杂,常用的前处理方法有:超声提取法、索氏提取法和加速溶剂提取法等。高效的前处理方法,须将待测物尽量进行提取,且将干扰物质进行消除。超声提取法和索氏提取法,待测物提取率偏低、基质干扰较大,最终导致检测结果准确度偏低等;加速溶剂提取法是在一定的温度和压力下,反复多次的提取,待测物提取率高,且通过研究合适的提取溶剂,可以有效降低基质干扰。实验通过考察对加标浓度为0.15 µg/mL 的加标样品进行提取后提取率,比较上述3种方法对5种咪唑类杀菌剂提取率的影响,最终确定快速溶剂萃取法作为前处理方法。比较结果见表3。
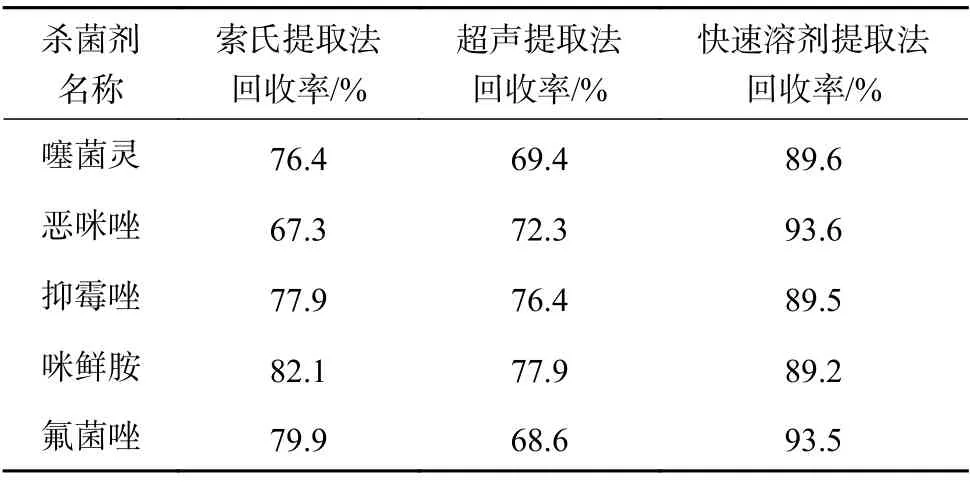
表3 前处理方法比较结果
2.2 萃取条件的优化
加速溶剂萃取法,是在高温、高压的条件下将待测杀菌剂,从土壤基质中提取出来的前处理方法,影响其提取效果的因素主要是温度和压力。选择适合的温度能够保证提取溶剂在样品基质中加速流动,降低待测杀菌剂与土壤的相互作用力;同样选择合适的压力,能够保障萃取溶剂保持液态,更快地与土壤基质混合,从而提高待测杀菌剂在萃取过程的溶解能力,达到高效提取的目的。实验通过设定萃取温度(80,85,90,95,100 ℃)和萃取压力(9,9.5,10,10.5,11 MPa),考察典型土壤加标样品(加标浓度:0.15 µg/mL),在上述变化条件下的提取情况。结果,选择萃取压力为10 MPa 和95 ℃时,回收率达到最佳。
2.3 色谱柱的优化
实验考察气相色谱-质谱法常用的HP-5 MS、DB-17 MS 和Rtx-5 MS 型质谱专用柱,柱长度、膜厚和内径均一致。保持1.3 仪器方法项下色谱和质谱条件,考察上述3种不同极性色谱柱对5种待测杀菌剂分离情况和重复性的影响。结果,选择DB-17 MS 和Rtx-5 MS 型色谱柱时,5种待测杀菌剂分离效果差,且重复性实验结果较差;选择HP-5 MS色谱柱时,5种待测杀菌剂响应和分离良好,峰型尖锐,重复性结果良好。故实验选择HP-5 MS 色谱柱作为分离柱。
2.4 MRM 方法的优化
取5 µg/mL 的噻菌灵、恶咪唑、抑霉唑、咪鲜胺和氟菌唑标准溶液,按照1.3 项下的质谱条件进行一级扫描-全扫描(Q3Scan 模式),确定各农药的目标离子和保留时间。然后对目标离子进行二级扫描-产物离子扫描(Production scan 模式),得到母离子对应的碎片离子。特征离子对以及相应的碰撞能量、丰度比是质谱测试的定性依据。而定量计算时,为保证检测结果的准确度,通常以丰度较大的特征离子对的色谱峰面积作为定量依据。因此,本文选择响应较高的一个碎片离子作为定量离子,再选择2个碎片离子作为定性离子。对此方法进行碰撞电压、碰撞时间等的优化,最终确定5种农药残留的多反应监测(MRM)方法。5种农药典型色谱图见图1,质谱离子参数见表4。
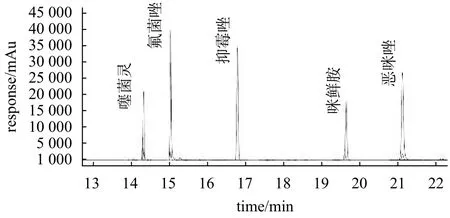
图1 5种农药质量色谱图

表4 5种农药质谱参数1)
2.5 方法线性范围、曲线方程和检出限
取1.4.1 标准储备溶液,定量移取适量,分别置10 mL 量瓶中,制备含5种杀菌剂浓度依次为0.05,0.15,0.6,2.0,6.0,15.0 µg/mL 的标准系列溶液,加甲醇定容至刻度,混匀;按1.3 仪器方法项下色谱和质谱条件,分别进样以上溶液各1 µL,收集谱图。根据谱图中待测杀菌剂响应值为纵坐标(Y),对应的浓度为横坐标(X),计算标准曲线方程,以3 倍信号噪音比值计算检测限,结果如表5 所示。

表5 待测杀菌剂线性范围、曲线方程、相关系数和检出限
2.6 加标回收率考察
取空白典型土壤样品,过60 目筛网,取过筛后的土壤样品12 g,加15 g 硅藻土,混合均匀后装填至22 mL 的萃取罐中,分别加入1.4.1 标准储备溶液适量,后续按1.4.3 样品溶液项下方法处理,制备含5种待测杀菌剂浓度分别为0.02,0.15,2.0 µg/mL的加标溶液,每个加标浓度点配制3 份;再按1.3 仪器方法项下色谱和质谱条件,分别进样以上溶液各1 µL,收集谱图,根据实际检测结果和加入量计算加标回收率,结果见表6。

表6 加标回收率结果
2.7 方法重复性试验
取空白典型土壤样品,过60 目筛网,取过筛后的土壤样品12 g,加15 g 硅藻土,混合均匀后装填至22 mL 的萃取罐中,加入1.4.1 标准储备溶液适量,后续按1.4.3 样品溶液项下方法处理,制备含5种待测杀菌剂浓度为0.06 µg/mL 的加标溶液,同法平行制备6 份;再按1.3 仪器方法项下色谱和质谱条件,分别进样以上溶液各1 µL,收集谱图,计算6次检测结果的重复性RSD。结果,噻菌灵、恶咪唑、抑霉唑、咪鲜胺和氟菌唑重复性RSD 分别为3.26%、3.18%、3.75%、4.43%和2.73%,表明方法具有良好的重复性。重复性试验结果见表7。
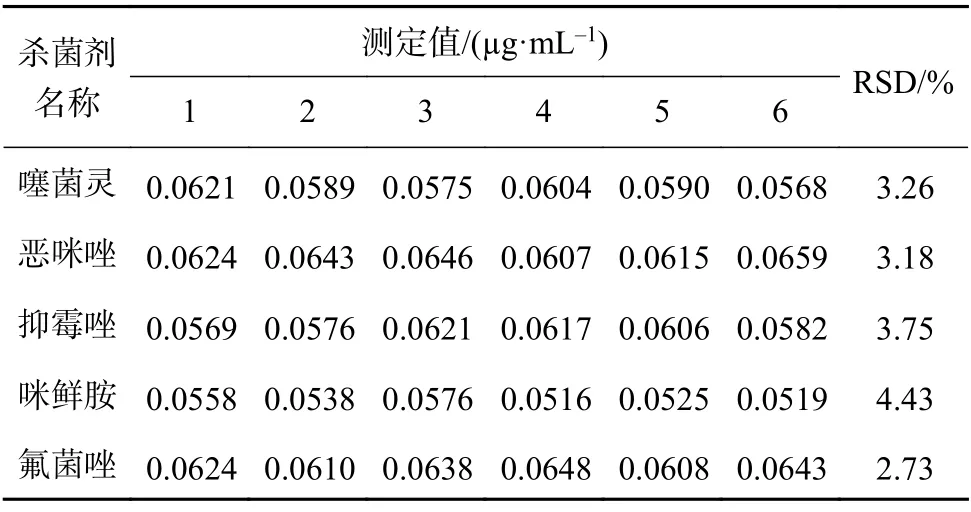
表7 重复性试验结果
3 结束语
实验建立采用加速溶剂提取法将典型土壤中噻菌灵、恶咪唑、抑霉唑、咪鲜胺和氟菌唑提取出来,QuEChERS 净化法将提取液净化后,上GC-MS/MS仪定量测定的分析方法。实验首先对土壤的前处理方法进行了选择,确定加速溶剂萃取法作为前处理方法;考察了常用萃取溶剂的萃取效果,对色谱条件和质谱条件进行了优化,确定上述最佳条件后,对方法的线性、重复性、加标回收率等进行了考察,结果表明实验建立的方法线性范围广、加标回收率范围在85.9%~103.1%之间,5种待测杀菌剂重复性(n=6)均在5.0%范围内。实验结果证明方法具有前处理速度快、灵敏度高、检测结果准确等优点,可以用于典型土壤中苯并咪唑类杀菌剂残留的监测。
