傣药方在治疗新型冠状病毒肺炎中作用的网络药理学和分子对接分析
2021-10-23王晨钰刘同祥
王晨钰,韩 涵,郭 磊,刘同祥,唐 丽
(1.民族医药教育部重点实验室(中央民族大学),中央民族大学药学院,北京 100081;2.军事科学院军事医学研究院毒物药物研究所 抗毒药物与毒理学国家重点实验室,北京 100850;3.中国人民解放军总医院京中医疗区礼士路门诊部,北京 100045)
0 引 言
新型冠状病毒肺炎(novel coronavirus pneumonia,COVID-19)是由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染导致的急性呼吸道传染病。2019 年12 月首次报道,至2021 年3月3 日15 时,COVID-19 感染已涉及到全球222 个国家和地区,累计确诊新型冠状病毒肺炎患者1.14 亿余例,累计死亡已超过254 万例[1]。自2020年10 月中旬,欧美国家出现第二轮反弹,截至2021 年3 月4 日,美国确诊人数达5082 万余例。目前,我国多地发生零星散发病例和局部聚集性疫情,疫情防控形势复杂严峻。病毒感染可触发细胞因子风暴,初期多伴有发热、乏力等临床表现,重症患者可出现呼吸困难与低氧血症,甚至会伴有急性肺损伤、急性呼吸窘迫综合征,更严重的则会有死亡风险。
傣族居住区大多属于“瘴疬之区”,在与传染病长期斗争的过程中,傣医积累了对各类传染病发生与防治等方面的认识和经验。据云南西双版纳傣族自治州卫生健康委文件显示,傣药方参与治疗确诊新冠肺炎病例13 例,疑似病例1 例,中傣西医结合治疗促进病例症状改善,通过综合施策,治愈率达98.85%。傣医根据 COVID-19 感染的临床特征和易感人群的体质特点,将其分为三种类型并针对不同的临床表现,分别采用相应的傣医特色药方进行防治(见表1[2-4])。

表1 傣医药对 COVID-19 的治疗方案
网络药理学[5]通过网络分析理论从整体角度研究药物的作用机制,为中药多成分、多靶点的药物作用机制阐释提供了一种新的研究策略。本工作利用网络药理学和分子对接的方法[6]首次分析傣药方治疗COVID-19 中发挥作用的活性成分和作用机制,有助于阐释傣族医药药方的作用机制和特点,为发挥民族医药、中医药在COVID-19 防治中的积极作用奠定基础。
1 材料与方法
1.1 傣药方主要成分及靶标数据库的构建
根据复方所含中药的名称,从中药与化学成分数据库(http://www.organchem.csdb.cn/scdb/main/tcm_introduce.asp)查询包含的化学成分,对数据库中不包含的中药,通过文献搜索查询对应的化学成分。
对所有化合物借助中药系统药理分析平台(TCMSP,https://tcmspw.com/tcmsp.php)根据口服生物利用度(oral bioavailability,OB)≥30%,类药性(drug likeness,DL)≥0.18 作为筛选条件,筛选出具有活性成分的化合物。对于TCMSP 数据库不包含的化合物,绘制结构式,保存为“*.sdf”格式文件,利用ADME 筛选,根据指标(PK 中GI tools 为High;Druglikeness前5个条件Lipinski、Ghose、Veber、Egan、Muegge 至少有两个为yes)筛选出符合要求的活性成分纳入表中。
再利用Pubchem(https://pubchem.ncbi.nlm.nih.gov/)对活性成分验证,结构转化为“*.sdf”格式的文件,设置为“Homo sapiens”后进行靶点预测(Swiss target prediction,http://www.swisstargetprediction.ch/),构建活性成分靶点库。
1.2 COVID-19 靶基因数据库的构建
在数据库GenCLiP 3(http://ci.smu.edu.cn/gen clip3/analysis.php)和GeneCard 数据库(https://www.genecards.org/)中以“Novel Coronavirus”,“Corona Virus Disease”作为关键词检索以构建疾病靶点库。
1.3 靶点筛选
使用R 语言(3.6.3)Venn Diagram 数据包,依据药物靶点与COVID-19 靶基因数据库,对靶点取交集,得到药方潜在靶点。
1.4 蛋白相互作用(PPI)网络构建与分析
使用STRING数据库(https://string-db.org/,version 11.0),输入潜在靶点,在organism 项设置物种为“Homo sapiens (Human)”,最小相互作用要求得分(minimum required interaction score)设置为0.90,隐藏单独靶点得到PPI 网络。将 PPI 数据导入Cytoscape 3.7.2 软件中,利用MCODE 筛选连接最为紧密的功能模块。
1.5 中药调控网络的构建
将Drug disease(药物与疾病的靶基因交集)、mollists(药物的有效成分)文件导入Cytoscape 3.7.2 软件构建中药调控网络图。同时通过软件的Network Analyzer 分析药方治疗COVID-19 拓扑学参数,得到核心成分及关键靶点。
1.6 基因富集分析和通路注释研究
基因本体论(gene ontology,GO)是注释基因及其表达产物的常用方法,京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)可对药物作用靶点或差异表达基因进行信号通路分析。将药物与疾病相关靶点,使用R 语言,引用Stringi 包,利用cluster Profiler,enrichplot,ggplot 2进行GO 和KEGG 通路富集分析,设定阈值P路富集分析,筛选具有显著性差异的生物过程和可靠靶点通路,P值越小,富集显著程度越高。
1.7 分子对接
从RSCB PDB数据库(https://www.rcsb.org/)下载SARS-CoV-2 3CL 水解酶(PDB ID:6LU7)[7]和血管紧张素转化酶2(ACE2)(PDB ID:1R42)[8]的3D 结构PDB 格式文件,使用AutoDock Tools 1.5.6 软件,以6LU7 和ACE2 作为受体,将复方网络中药方中节点排名前十的化合物作为配体,根据靶蛋白复合物中配体的坐标确定活性位点,设置活性口袋,运行AutoDockVina 进行对接,用pymol 2.2.0 和ligplot+2.2 进行结果分析。
2 结 果
2.1 三种傣药方中各中药包含的化合物和对应的潜在靶点
傣药方中各中药包含的化合物和潜在靶点统计见表2,依据中药与化学成分数据库,得到了马莲鞍、羊耳菊、洗碗叶根、藤甘草、圆锥南蛇藤、野柿根、生藤的化合物数;依据已有文献[9-21]得到了马兰、百样解、葫芦茶、山大黄的化合物数。需要说明的是,药方2 中的毛翼核果藤、勐腊大解药两味中药,药方3 中的长柱山丹、人字树、茴香豆蔻三味中药,未查询到活性成分,因此仅在表中给出各自的药理作用特点[22]。后续分析中,暂未考虑这五味中药对于药方整体的活性靶点及作用通路的影响。

表2 3种傣药方的中药包含的化合物和对应的潜在靶标个数
再根据OB≥30%,DL≥0.18,得到各药方活性成分,绘制分子式,经过ADME 筛选与PubChem 验证,药方1、2、3 分别得到化合物311、243、289 个,活性成分53、43、49 个。将活性成分进行靶点预测后得到药方1、2、3 靶点数目分别为600、564、473 个。
2.2 各傣药方的主要成分的网络药理学分析
2.2.1 活性成分治疗疾病相关靶点的筛选
在数据库GenCLiP 3 和GeneCard 数据库中得到COVID-19 相关的疾病靶点共900 个,再利用Venn 图(见图1)得到各药方治疗COVID-19 的作用靶点。
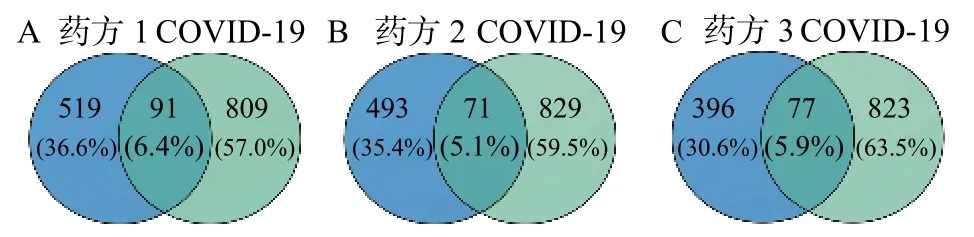
图1 傣药方1(A)、2(B)、3(C)药物靶点与COVID-19 相关靶点的Venn 图

续表 23种傣药方的中药包含的化合物和对应的潜在靶标个数
2.2.2 PPI 网络分析及关键靶点的筛选
String 分析结果表明,药方1、2、3 分别有91、71、77 个靶蛋白,254、144、206 条互作边,得到的靶点间互作强度,以PPI 表示,边越多表示关联度越高,如(图2)所示。三个药方中的功能模块中包括的核心基因有炎症因子、MAPK1、3、8、14;丝氨酸和苏氨酸特异性蛋白激酶C(PRKC)系列的PRKCA、非受体型酪氨酸激酶(JAK1)等。

图2 傣药方1(A)、2(B)、3(C)与COVID-19 交集靶点的PPI 网络图,网络节点代表蛋白质,边代表PPI
2.2.3 靶点的GO 生物功能注释
GO 富集分析主要包括3 个方面:细胞组成(cellular component,CC)、生物过程(biological process,BP)和分子功能(molecular function,MF)。将药方1 与疾病的73 个共有靶点进行GO 富集分析,得到41 项CC 相关,1865 条BP,111 项MF 相关,将最显著的前10 条进行柱状图和气泡图展示(图3)。在CC 中,药方1 作用靶点富集条目分布于膜筏(membrane raft)、膜上结构域(membrane microdomain),分别各占据总富集数目的18.7%与17.6%。BP 包括在生物调节、细胞过程、免疫系统过程、细胞定位、多细胞生物过程、应激反应等主要生物过程,主要富集条目为肽段丝氨酸残基修饰(peptidyl-serine modification),占总富集数目的24.2%,以及氧化应激反应(response to oxidative stress),占总富集数目的25.3%。MF 中,条目包括蛋白质丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)等,其富集数目占总富集数目的17.6%。药方2 富集到38 项CC 相关,1709条BP,85 项MF 相关。部分条目和药方1 有重合,然而在某一相同条目下的基因数量存在差异,反映出药方2 治疗COVID-19 参与的BP 与药方1 的区别,推测这一区别可能是两者对应治疗不同症状的COVID-19 的原因之一。药方3 富集到39 项CC相关,1422 条BP,70 项MF 相关。

图3 傣药方与COVID-19 交集靶基因的GO 富集分析图
2.2.4 KEGG 通路富集分析
KEGG 通路富集分析表明药方1、2、3 分别富集到168、170、151 条生物通路,发现75%左右的通路集中在免疫、炎症、内分泌相关,对上述三种相关富集条目较多的生物通路进行可视化分析(见图4),药方1 中,免疫相关通路如B 细胞受体信号通路、T 细胞受体信号通路、肿瘤坏死因子(TNF)信号通路、人巨细胞病毒感染通路、磷脂酰肌醇3-激酶-蛋白激酶B(PI3K-Akt)信号通路最为显著,其中TNF 信号通路可以激活半胱氨酸蛋白酶、应激活化蛋白激酶(JNK)、NF-κB 三条信号通路,实现抗病毒、细胞凋亡、免疫调控功能;PI3K-Akt 信号通路可参与增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。

图4 傣药方富集到的免疫、炎症、内分泌通路的KEGG 通路分析
药方2 主要富集于细胞凋亡信号通路、缺氧诱导因子-1(HIF-1)信号通路以及晚期糖基化终末产物—晚期糖基化受体(AGE-RAGE)信号通路等,HIF-1 信号通路是参与调解人体缺氧的重要通路,调节该通路可能有助于改善COVID-19 患者临床缺氧症状。AGE-RAGE 信号通路可促进NF-κB 通路、HIF-1α、JAK-STAT 通路等激活,也可引起大量黏附分子、生长因子、促炎细胞因子如白介素6(IL-6)、IL-8 等的表达和释放,最终引起慢性细胞活化和组织损伤。例如可以通过HIF-1α 信号通路抑制炎症因子的释放,从而发挥抗炎作用。另外,AGERAGE 通路中,AGEs 的堆积能激活NF-κB 信号通路,AGEs 与受体RAGE 结合可激活多种细胞内信号级联,如 JAK-STAT,从而使炎症信号持续存在,诱导细胞凋亡使出现肺组织损伤等症状。
药方3 富集于大量的炎症相关通路,例如瞬时感受器电位(TRP 通道)的炎症介质调节、Toll 样受体(TLR)通路、MAPK 信号通路、IL-17 信号通路、JAK-STAT 信号通路、NF-κB 信号通路、花生四烯酸代谢通路等,其中对JAK-STAT 信号通路的激活可改善气体交换功能,从而抑制炎性介质的释放、减轻LPS 诱导的急性肺损伤。
2.2.5 中药活性成分调控网络图分析
构建了药物-成分-靶基因-疾病的中药调控网络,得到各药方中每个药物的靶点调控重要程度,以节点度来反映节点的重要程度,节点度数值越高,越可能是核心成分或靶点。
药方1 网络图中总共包含147 个节点,534 条边,平均度值为7.27;药方2 网络图中总共包含137 个节点,425 条边,平均度值为7.27;药方3 的网络图中总共包含125 个节点,352 条边,平均度值为5.63,各个药方网络图中节点度值排名前十位的化合物分别汇总于表3。选取节点度前10 位和作用靶点前10 位绘制中药调控网络图(见图5)。
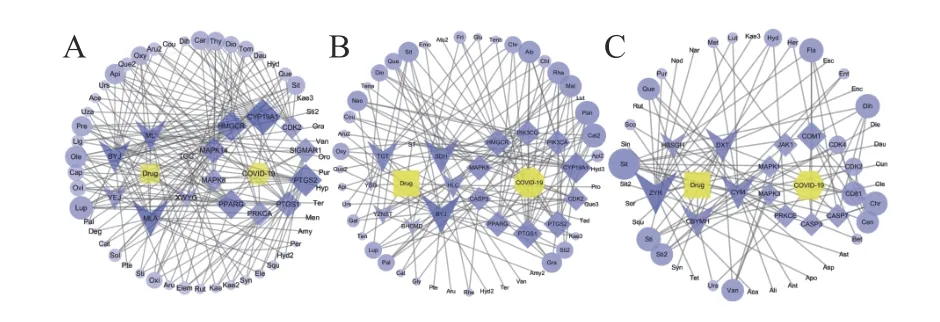
图5 傣药方1 (A)、2(B)、3(C)的中药复方-成分-疾病-靶点调控网络图,图中菱形为预测的排名前十的靶点,三角形为中药(简称),圆形为药物活性成分(简称)
2.2.6 分子对接分析
针对网络图拓扑分析得到的节点度值排名前十的活性化合物,汇总对接结果(表3)。一般认为,化合物与受体所形成的构象能量越低,结构越稳定,结合活性较高。若结合能<0,表明配体分子均能和受体蛋白自发结合,结合能<–5.0 kcal/mol 时,表明结合性好,结合能越低,对接结果越佳。
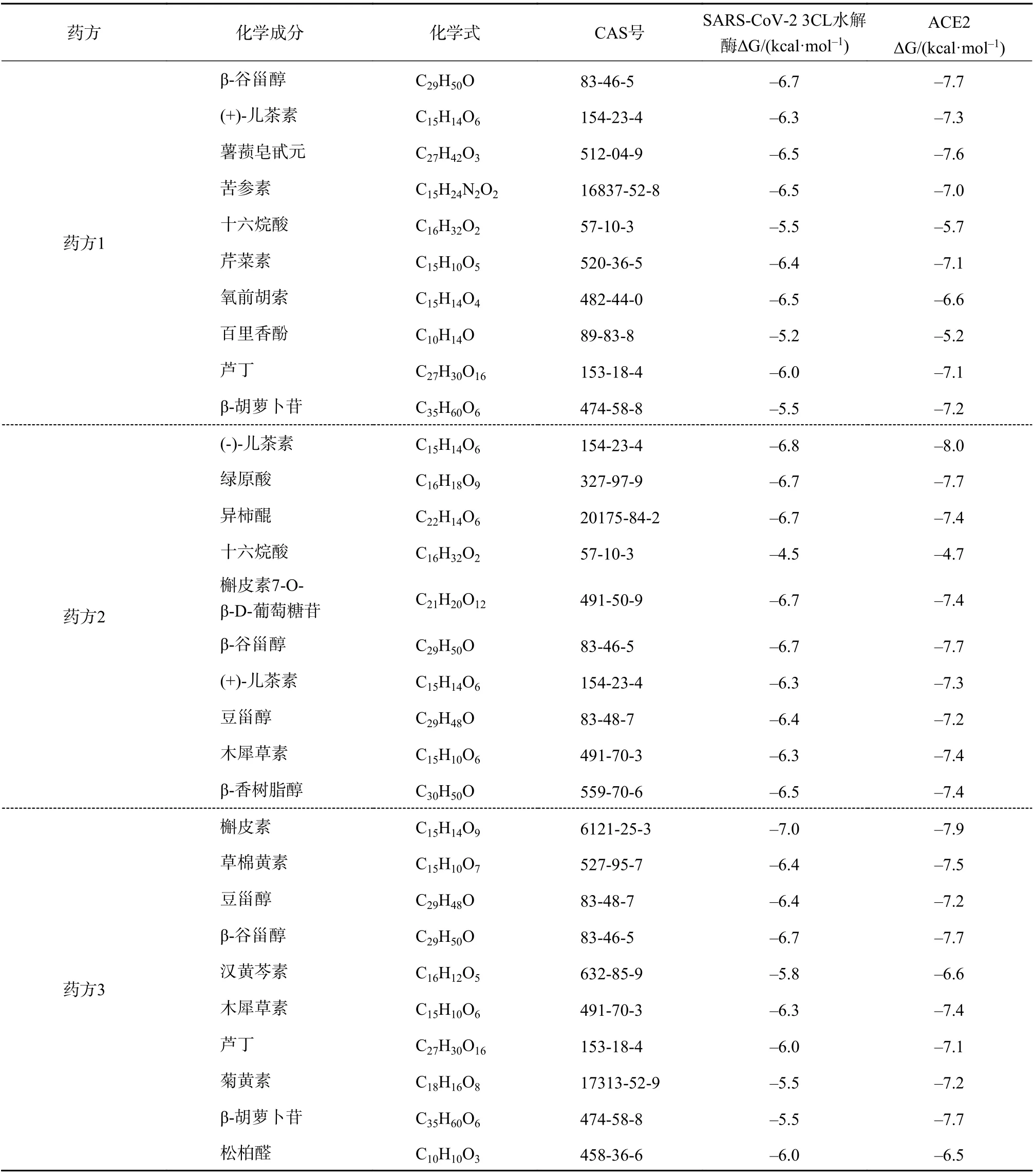
表3 傣药方1、2、3 排名前十的化合物分别与COVID-19 的SARS-CoV-2 3CL 水解酶和ACE2 的对接参数
进一步选择结合能最低的构象进行分子对接。对于SARS-CoV-2 3CL 水解酶,选择β-谷甾醇(与其最低结合能为–6.7 kcal/mol)、(-)-儿茶素(–6.8 kcal·mol–1)、槲皮素(–7.0 kcal/mol)。由ligplot 分析,β-谷甾醇与Met165 等氨基酸残基间主要通过疏水作用力、与Cys145 等残基通过氢键作用,作用距离为2.9Å;(-)-儿茶素则与Tyr126 等残基间产生疏水作用;槲皮素与6LU7 的Ile106 等残基产生氢键或者盐桥作用,另外也与Gly174 残基发生疏水作用。在与ACE2 进行对接,选择β-谷甾醇(与其最低结合能–7.7 kcal/mol)、(-)-儿茶素(–8.0 kcal/mol)、槲皮素(–7.9 kcal/mol)(见表4)。

表4 β-谷甾醇、(-)-儿茶素、槲皮素分别与SARS-CoV-2 3CL 水解酶、ACE2 的对接模式图及ligplot 分析
3 讨 论
傣医药因特有的整体合参特点,其针对COVID-19 的治疗药方收录为《新型冠状病毒感染的肺炎诊疗方案(试行第六版)》[23]。普遍认为病毒先通过诱发机体产生失调、过度的免疫应答,导致患者体内炎症因子过度表达而出现“细胞因子风暴”,从而间接造成肺炎及急性肺损伤[24]。我们在此根据网络药理学与分子对接的结果,对其主要作用成分、关键靶点、通路分析展开讨论。
3.1 重要成分
在各傣药方对应的网络图中,共获得了22 个重要成分,主要以黄酮类(11 个)、萜类(4 个)为主,其他7 个则属于甾体皂苷类、脂肪酸类、香豆素类、甾醇类、苯丙素类、蒽醌类、酚酸类化合物,其中β-谷甾醇、(-)-儿茶素、槲皮素节点度值较高,同时在分子对接结果中相对较好。已有研究表明β-谷甾醇可以显著减轻脂多糖诱导的肺水肿和炎症反应;(-)-儿茶素归属于儿茶素类,其结构相似化合物表儿茶素已呈现出较好的抗炎活性[24];槲皮素作为一种天然黄酮,具有良好的抗炎作用。例如可以通过[25]降低转化生长因子-β1(TGF-β1)、α-平滑肌动蛋白(α-SMA)和TNF-α 表达,从而抑制大鼠肺泡细胞凋亡,达到降低大鼠肺组织炎症和纤维化损伤的目的。另外,近期相关研究表明[26]槲皮素等化合物参与多种阶段COVID-19 的治疗,可抑制 JAK2-STAT3 信号通路的激活,从而可下调肺脏炎症反应的应答,同时还兼有抗病毒、抗氧化、神经保护等作用[27],本工作中的GO 富集、KEGG 通路结果也主要集中在这些通路中。
从3种成分与靶蛋白的分子对接相互作用图和3D 空间构象可以看出,β-谷甾醇、(-)-儿茶素、槲皮素等和SARS-CoV-2 3CL 水解酶、ACE2 结合活性均较高,通过疏水作用力、离子键、氢键等多种相互作用力促使复合物的形成(表4),有利于抑制病毒与核心蛋白的结合。其他主要活性成分则主要作用于与机体免疫功能相关、炎症相关的信号通路,以促进机体提高免疫力,阻断病毒入侵。
3.2 关键靶点及通路分析
3.2.1 关键靶点
从PPI 网络图可以看出,靶点之间存在多种相互作用,其中度值排名前20 的靶点主要包括炎症因子、丝裂原活化蛋白激酶、蛋白激酶C 等,其中炎症因子的相关靶点包括IL-1β、IL-2、IL-6、JAK1、STAT3 等,目前研究表明IL-1β[28]可上调IL-1RI来增强肺部炎症;IL-2[29]主要由CD4+Th1 分泌,通过结合对应受体发挥炎症反应的调节功能;IL-6[30]可通过趋化炎症细胞聚集和促进炎症细胞浸润,加速肺纤维化早期的肺泡炎症反应,从而介导特发性肺纤维化的发生,造成肺损伤,已有研究确证了IL-6 等相关靶点的重要作用,例如 Xu[31]等使用先前用于治疗各种类型的关节炎(包括类风湿性关节炎和细胞因子释放综合征)的IL-6 的受体特异性抗体Tocilizumab,通过减轻肺纤维化损伤给出对重度COVID-19 的治疗效果。考虑到SARS-CoV-2触发强烈的免疫反应[32],可能引起细胞因子风暴综合症(CSS),其相关临床特征[33]可以通过炎症因子相关作用来解释,所以用于抑制过度炎症反应的免疫调节剂可能是治疗COVID-19 的潜在药物。另外,JAK1[34]可以参与细胞凋亡、免疫调节、细胞因子信号转导等过程。STAT3[35]目前也已被证明在调节免疫和炎症反应中起着重要作用。
3.2.2 共性通路分析
SARS-CoV-2 病毒感染会引起剧烈的免疫及炎症反应,并激活大量细胞因子。2020 年以来对中药成分与COVID-19 网络药理学分析的相关文献亦表明[36-43],黄酮类可通过调控IL-17、TNF、T 细胞受体、Th1 细胞分化、血管内皮生长因子(VEGF)等信号通路来减少IL-6、IL-1β、TNF-α 等炎性因子的分泌,上调IL-10 等抗炎因子来抑制炎症反应、促进细胞生长分化和肺血管生成,减轻肺损伤进而发挥防治COVID-19 的作用。萜类活性成分则可通过调节T 细胞受体、IL-17、VEGF 等信号通路,发挥抗病毒、免疫、抗炎的作用。
和以往研究相比,本工作中的三个药方大多涉及免疫系统、炎症系统、内分泌相关的通路,更侧重于免疫与炎症相关通路,例如黄酮类活性成分可共同通过促使烟雾诱导的TGF-β 减少释放[44],抑制“上皮-间质”转化来减轻肺纤维化;也可通过阻断促分裂原活化蛋白激酶通路,该通路的关键靶点主要包 括MAPK1、MAPK3 等,MAPK1可通过调控VEGF和MAPK 信号通路,促进修复损伤肺组织达到抗COVID-19 的目的[45-47],MAPK3[48]也广泛参与肺部炎症疾病的发生发展。
我们不难发现,各药方的某些活性成分之间存在共同的关键靶点,例如药方1 的β-谷甾醇与药方2 和3 的活性成分豆甾醇具有共同的靶点IL-17、TNF-α 和IL-6 等;药方1 的活性成分苦参素与药方2 的(-)-儿茶素具有共同的靶点JAK1、STAT3等;药方2 的活性成分绿原酸与药方3 的槲皮素具有共同的靶点IL-6、MAPK1 等,继而调控炎症相关通路如TNF 信号通路、MAPK 信号通路以及JAKSTAT 信号通路等。
3.2.3 差异通路分析
整体上来讲,从靶点的功能注释以及通路富集上的差别可以推测傣医对于这三种症状对症下药的科学依据。药方1 主要富集于抗炎通路、病毒感染通路,与其相对应的各靶点则是参与炎症反应或者病毒感染细胞过程中的各个重要因子,例如MAPK1、MAPK3、MAPK8、JAK1、EGFR、STAT3 等,在抗炎反应与细胞的生长、增殖、凋亡信号通路中发挥着重要作用,也反映出在风毒初起、水伤火盛型的症状对应下,药方1 治疗的重点放在抗炎、病毒感染细胞的通路上,从而提高机体的免疫能力。
对于风毒壅肺、火盛土伤型的症状,药方2 主要集中于病原菌、病毒感染通路、抗炎信号通路等,PTGS2、PTGS1、NOS2、PRKCA、PRKCB、PRKCE、IL-6 靶点在整个调控过程中发挥着重要作用,这些通路对临床上患者所出现的发热不退、咳嗽气喘、痰多黄稠、心悸胸闷、腹胀便秘等症状有着协同调控的作用。
药方3 以清火解毒、疏风调水、补水培土为治则,对应可治疗的临床症状为高热不退、全身乏力、气促胸闷、呼吸困难、神志不清等,比前两种症状都更为严重,核心靶点主要有PIK3CA、PIK3CB、MAPK1、IL-6、IL-1β,其对应的通路重点集中在炎症相关信号通路、细胞增殖凋亡通路,富集结果显示对细胞增殖凋亡作用较大,然而是否存在全身效应还需要进一步结合动物实验、以及相应的指标方可得出准确判断。
就抗炎通路而言,从富集作用较为显著的通路来看,药方1 与其他药方的抗炎通路区别在于多出了花生四烯酸信号通路,花生四烯酸的代谢产物如前列腺素、白三烯和脂毒素等作为体内重要的炎症物质参与机体免疫及炎症反应过程。MAPK 等其他的抗炎通路在药方3 中的富集条目数占比约23%,同等情况下抗炎通路的富集条目数高于药方1 和2。说明抗炎通路贯穿整个药方的治疗过程,且随着症状不同,对应的抗炎通路在治疗过程中发挥的作用也存在局部差异。
4 结束语
本工作通过网络药理学和分子对接技术,初步探索了傣药药方防治COVID-19 的生物学作用机制,从分子水平阐述了傣药方的多成分、多靶点对机体的整体调控,为民族医药基于傣药方治疗 COVID-19 提供了进一步的科学依据,其确切机制仍需后续的实验研究验证。例如构建新型冠状病毒肺炎动物模型,根据本工作揭示出的药方3 可能通过细胞凋亡、炎症相关信号通路干预新型冠状病毒肺炎的特点,通过监测动物模型中的炎症因子MAPK1、IL-6及凋亡相关蛋白Caspase-3、Bcl-2 等指标的表达水平,从而对药方3 的调控作用进行验证。
