不同发育期牦牛肺组织中血管形成相关基因的表达谱
2021-10-23孟祥琼陈一博成若通俞红贤
孟祥琼,周 娟,陈一博,成若通,俞红贤,3,魏 青,3
(1.青海大学生态环境工程学院,青海 西宁 810016;2.青海大学农牧学院动物医学系,青海 西宁 810016;3.省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016)
牦牛(Bosgrunniens)是以青藏高原为起源地的特有物种,其对高原环境有良好适应性[1],早已引起国内外学者的广泛关注,并开展了包括组织形态结构、血氧运输、细胞呼吸代谢以及牦牛适应低氧的分子机制等多方面研究。在发育学方面,研究表明高原牦牛的肺部组织发育比低海拔黄牛快,且高海拔牦牛1日龄时肺泡隔内的毛细血管较为丰富,毛细血管网较黄牛致密,分布也较为广泛,这便于高原牦牛快速适应低氧环境[2-3]。为进一步研究牦牛肺组织发育的分子机制及其与牦牛适应低氧的关系,本试验选取1日龄、30日龄、180日龄和成年牦牛的肺组织为研究对象,通过对其转录组学数据分析,筛选与血管形成相关的基因,并结合其生长发育特点,阐明这些基因的变化规律对牦牛出生后肺组织内血管生长发育的影响,为进一步揭示牦牛低氧适应机制提供理论基础。
1 材料与方法
1.1 试验动物 本试验以青海省海晏县(海拔3 200 m)环湖型牦牛为研究对象,分别取1日龄(HY-1)、30日龄(HY-30)、180日龄(HY-180)及成年牦牛(HY-A)4个发育阶段的肺组织,其中HY-1和HY-A组牦牛各2头,HY-30和HY-180组牦牛各3头。
1.2 试验试剂 TRIzol裂解液、dNTP Mixture、10×PCR Buffer(Mg2+plus),均购自生工生物工程(上海)股份有限公司;TianScript cDNA、TB Green®PremixExTaqTMⅡ(Tli RNaseH Plus)、TaKaRaExTaq等,均购自TaKaRa生物工程(大连)有限公司。
1.3 试验方法
1.3.1 牦牛肺组织总RNA的提取及cDNA第1条链的合成 分别取1日龄、30日龄、180日龄和成年牦牛的肺组织,用TRIzol法分别提取4个年龄段的总RNA,用核酸蛋白检测仪测定浓度后,按照反转录试剂盒说明书步骤反转录成cDNA的第1条链,-20 ℃保存。
1.3.2 引物设计合成 在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)上查询相关基因的序列,用Primer 6.0软件设计特异性引物(表1),引物由生工生物工程(上海)股份有限公司合成。

表1 qRT-PCR特异性引物序列Table 1 The information of primers for qRT-PCR amplification
1.3.3 qRT-PCR 以β-Actin为内参,目的基因和内参基因分别设置3个平行。采用相对ΔΔCt法(2-ΔΔCt)对qRT-PCR试验数据进行分析。
1.3.4 转录组数据分析 转录组数据进行初步分析,以倍数差异(|FoldChange|)>1.5,错误发现率(FDR)≤0.05为条件筛选出差异表达基因,统计每个发育阶段的血管生成相关基因,然后对血管生成相关基因在各个时期表达量的变化趋势进行分析。
2 结果
2.1 转录组数据验证 以每个发育阶段牦牛肺组织的cDNA为模板进行qRT-PCR试验,结果如中插彩版图1所示,mRNA水平表达量与转录组数据目的基因的表达水平相似,变化趋势与转录组数据基本一致。

图1 目的基因在每个发育阶段的相对表达量Fig.1 Relative expression of the target gene at each developmental stage
2.2 差异表达基因筛选 通过差异分析软件DESeq2对2个不同发育阶段间的差异表达基因进行分析,检验参数为|FC|>1.5,padj<0.05,FDR<0.05。检验结果如中插彩版图2所示,1日龄和30日龄组别比较,共表达基因17 218个(69.71%),差异基因311个(1.26%),其中上调基因139个(0.56%),下调基因172个(0.70%);30日龄和180日龄组别比较,共表达基因17 404个(70.47%),差异基因3 190个(12.93%),其中上调基因1 775个(7.19%),下调基因1 415个(5.74%);180日龄和成年牦牛组别比较,共表达基因17 232个(69.77%),差异基因693个(2.81%),其中上调基因430个(1.74%),下调基因263个(1.06%)。
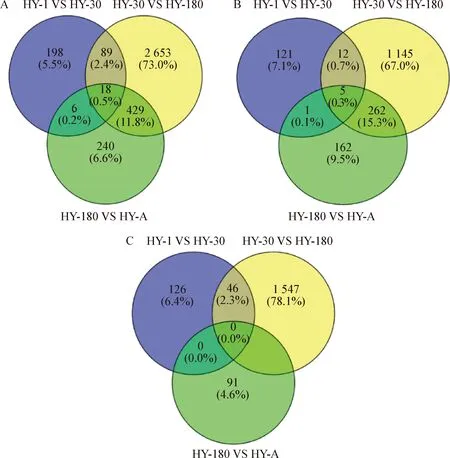
图2 差异表达基因维恩图Fig.2 Venn diagram of differentially expressed genesA:共同差异表达的基因;B:共同上调表达的基因;C:共同下调表达的基因A:Common differentially expressed genes;B:Common up-regulated genes;C:Common down-regulated genes
综上所述,30日龄组和180日龄组比较差异表达基因数最多。且3个比较组中的共同差异基因为18个(表2),其中均为上升的基因有5个,分别是MIA、SEMA3C、NTN4、ADGRE1和DMXL2,没有共同下调的差异表达基因。

表2 比较组别中共同的差异表达基因Table 2 Differentially expressed genes in the comparison groups
2.3 血管生成相关基因筛选 结合相关文献共筛选出血管形成相关基因39个(表3)。

表3 血管形成相关基因注释Table 3 The annotation of angiogenesis-related genes
2.4 血管生成相关基因各时期表达量变化趋势 39个血管生成相关基因可分为3类,包括血管组成、抑制血管生成和促进血管生成。利用转录组数据分析各发育阶段基因表达量的变化趋势(中插彩版图3)。血管组成类基因共4个,表达量均在30日龄 时达到最大,之后便急剧降低,并且30日龄之前的表达量均大于180日龄和成年的表达量,这表明牦牛在30日龄之前主要进行物质积累,并为后期的生长发育做准备(中插彩版图3A)。抑制血管生成的基因共6个,表达量均在180日龄时大幅降低,之后的发育阶段也持续下降(中插彩版图3B)。促进血管生成的基因共29个,大部分基因在180日龄时表达量达到了最大,随后便逐渐降低,少数基因表达量在30日龄时达到最高后逐渐降低(中插彩版图3C)。
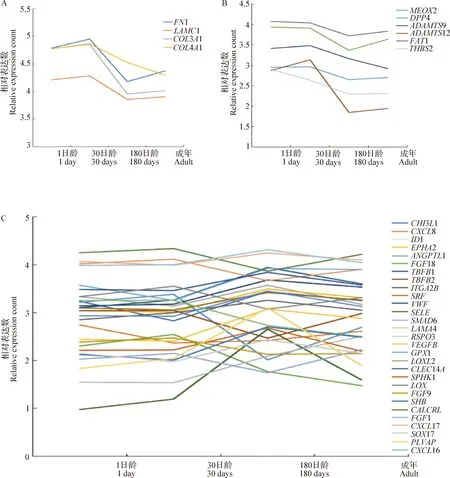
图3 血管生成相关基因表达量变化趋势Fig.3 Trends in the expression of angiogenesis-related genesA:血管组成类基因;B:抑制血管生成的基因;C:促进血管生成的基因A:Angiogenesis-like genes;B:Angiogenesis-inhibiting genes;C:Angiogenesis-promoting genes
3 讨论
研究人类肺组织发育发现,肺血管形成是肺泡发育的重要特征,持续的肺血管网生成可有效促进气血交换[4]。肺组织损伤造成缺氧,将导致肺泡发育受阻,进而使得肺微血管形成减少[5-6]。有研究发现,出生后持续高氧作用将有利于大鼠肺内微血管形成[7]。而前期研究发现,牦牛在高原低氧环境下牦牛肺组织发育正常,肺内微血管形成未受影响[8]。动物肺组织内血管的形成也是一个多因子、多通路共同作用的结果[9]。
血管组成类基因(FN1、LAMC1、COL3A1、COL4A1)包括纤连蛋白、层粘连蛋白、III型胶原蛋白和IV型胶原蛋白,其中纤连蛋白能够与其他多种分子相互作用,参与迁移、生长、凋亡和分化等细胞活动,在发育和生理过程中发挥重要作用,III型胶原蛋白是中空器官(如血管、子宫和肠道)的主要结构成分,IV型胶原蛋白是基底膜的主要结构成分。这4个基因表达量均在30日龄时达到最大,之后便急剧降低,并且30日龄之前的表达量均高于180日龄和成年阶段的表达量,这表明牦牛在30日龄之前主要进行物质积累为后期的生长发育做准备。
血管生成是促血管形成因子和抑制因子协调作用的复杂过程,抑制血管生成的基因主要是通过抑制细胞粘附、细胞因子的作用和血管平滑肌的生长进而抑制血管的生成[10],其基因表达量均在180日龄时大幅降低,之后也基本上都持续下降。促进血管生成的基因主要是通过促进内皮细胞的增殖和迁移,促进细胞粘附和维持血管稳定来促进血管的生成[11],部分基因在180日龄时表达量达到了最大,其余基因表达量则在30日龄时达到最大。
各年龄比较组共有5个上调表达的基因,有研究报道,FN1在小鼠及其他脊椎动物胚胎的原肠期就已表达[12-13],除此之外,其在血管细胞的迁移位点的表达量也很丰富[14],且在小鼠试验中,纤连蛋白基因的缺失会导致小鼠的血管等发育异常及死亡[15-16];NTN4也与血管形成密切相关,试验表明NTN4在体外可以诱导血管内皮细胞的增殖、迁徙并促进新生血管生成[17],但FN1、NTN4在牦牛体内血管发育的相关研究均未见报道。为研究MIA在爪蟾不同发育阶段的表达,对受精卵期(s1)、卵裂期(s4)、原肠胚期(s11)、神经胚期(s13、s18)、尾芽期(s28、s32)的胚胎中MIA的表达量进行检测,结果显示:从受精卵开始,MIA的mRNA表达即可检测,并持续表达于胚胎发育各阶段[18],这与本试验结果是一致的,在牦牛出生后肺组织的发育过程,血管形成贯彻始终。在视网膜形成过程的相关研究中发现,SEMA3C与视网膜内血管形成有关,对基因敲除处理试验鼠和对照组中基因表达量进行检测,试验组小鼠SEMA3C的表达量明显降低,SEMA3C对视网膜血管生成有调节作用,其缺失会导致形成的血管不稳定,此外,通过组织学染色观察到新生血管簇有异常生长和视网膜血管渗漏的情况[19-20],但大型哺乳动物相关研究并未见报道,这是牦牛相关研究的首次报道。
根据前期组织学研究推测,1~30日龄为物质快速积累时期,30~180日龄为血管快速发育时期[21]。而根据上述分析30日龄和180日龄都有升高比较明显的血管形成的基因,且差异基因表达数量显著增加(中插彩版图2)。可见1~30日龄,再到180日龄这个阶段血管生成比较剧烈,其中有些促进血管生成的基因表达量并未在180日龄时达到最高,反而在发育早期达到最高,这些基因可能参与早期的血管生成。
