基于Oncomine 芯片数据库分析低密度脂蛋白受体相关蛋白4在甲状腺乳头癌中的表达及意义△
2021-10-23冯鑫源田昀灵傅松波邴志桐赵楠洪成恩王素媛龚文倩吴啸天
冯鑫源,田昀灵,傅松波,邴志桐,赵楠,洪成恩,王素媛,龚文倩,吴啸天
1兰州大学第一临床医学院,兰州730000
2兰州大学第一医院内分泌科,兰州730000
3中国科学院近代物理研究所,兰州7300000
甲状腺癌(thyroid carcinoma,TC)约占所有恶性肿瘤的1%,且在内分泌系统恶性肿瘤中居首位。世界卫生组织对TC 进行分型,其中甲状腺乳头状癌(papillary thyroid carcinoma,PTC)在人群中最常见,占75%~80%,且恶性度相对较低,临床预后较好;其次是滤泡性癌、髓样癌和未分化癌。近年来,中国TC 的发病率呈逐年上升趋势,在美国TC 已成为威胁人们生命健康的首位疾病。Hucz等研究证实,低密度脂蛋白受体相关蛋白4(lowdensity lipoprotein receptor related protein 4,LRP4)在PTC组织中的表达水平明显高于相应癌旁组织,提示LRP4 可能是甲状腺癌的致癌因子。Zhou 等通过对19 例PTC 患者进行转录组测序,发现LRP4在肿瘤组织及PTC细胞系中高表达,不同PTC细胞系中的沉默LRP4
基因,可以抑制肿瘤细胞在组织内的侵袭和增殖,从体外实验的角度证明了LRP4作为致癌因子的作用。进一步研究发现,LRP4 主要是通过激活细胞上皮-间充质转化,从而促进PTC的转移。Oncomine 数据库是一个基于基因芯片的数据库和整合数据挖掘平台,在此数据库中可根据选题需求设定筛选和挖掘数据的条件。本研究通过筛选Oncomine 数据库中LRP4 的基因芯片信息,对相关资料进行深入挖掘分析,得出其在PTC中的表达结果及其与预后的关系,现报道如下。1 资料与方法
1.1 数据检索
在Oncomine 数据库中进行检索,第一步设定筛选条件“Gene:LRP4”可得到LRP4 在不同肿瘤组织中的表达情况。第二步在上述检索基础上对分析类型、肿瘤类型、数据类型及参数进行限制,添加检索条件①“Analysis Type:Cancervs
Normal Analysis”;②“Cancer Type:Papillary Thyroid Gland Carcinoma”;③“Data Type:mRNA or DNA copy number”;④分析参数为“P-value ﹤1E-4,Fold change=2,Gene rank=top10%”,可得到LRP4 在PTC中的表达情况。第三步继续对临床结局进行限制,增加筛选条件“Clinical Outcome:Survival Status”,可得到LRP4 与PTC 患者预后的相关数据,可对生存状态、随访时间、DNA 拷贝数值等数据进行提取并利用统计学软件绘制生存曲线。1.2 观察指标
研究LRP4
基因在多种肿瘤组织中的表达情况,可通过检索Oncomine 数据库中的基因表达情况并生成图谱,其中红色代表在肿瘤组织中高表达,蓝色代表低表达,颜色深浅表示表达程度。研究LRP4
基因在PTC 中的表达情况,可通过数据库中自带的Meta 分析功能对多个独立、同类型研究进行综合分析,其中红、蓝色表示的意义同上。此外,对于单个研究可通过t
检验进行差异表达分析,同时根据LRP4
在正常组织及PTC 中mRNA 表达量的中位中心强度生成箱式图,可通过图像及表达强度判断基因在不同研究中的表达情况。预后分析结果可通过生成的生存曲线进行观察。1.3 统计学方法
将各项数据记录于Excel 表格中,采用SPSS 20.0 统计软件进行数据分析,采用Kaplan-Meier 法绘制生存曲线(根据生存状态进行筛选,分析数据均为DNA 数据),以P
﹤0.05 为差异有统计学意义。2 结果
2.1 LRP4 在多种肿瘤中的表达情况
Oncomine数据库中共收集了400项不同肿瘤的研究结果,包括头颈部肿瘤、肺癌、肝癌、胃癌、肾癌等,其中LRP4表达明显增高的有11项,表达明显降低的有7 项(一篇文献可包含多个数据集,故参考文献总数小于数据集总数)。LRP4在头颈部肿瘤中高表达的研究有5 项,在结直肠癌中高表达的研究有2项,在脑及中枢系统肿瘤中高表达的研究有1 项,其他肿瘤中在生殖细胞肿瘤中高表达的研究有2项;LRP4在乳腺癌、肺癌、黑色素瘤、部分结直肠癌中低表达。(图1)
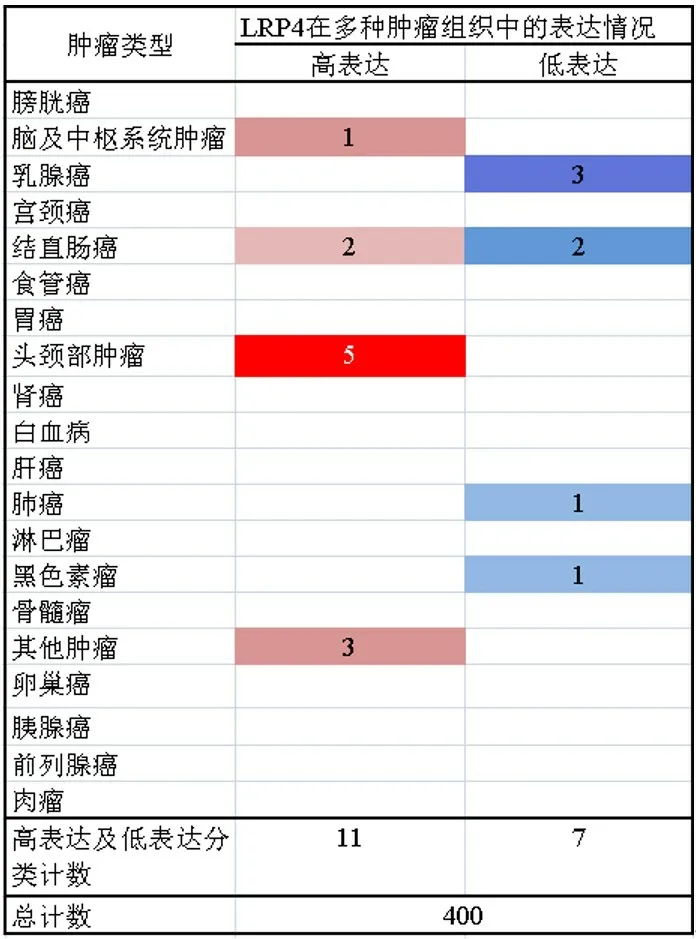
图1 Oncomine数据库中LRP4在多种肿瘤中的表达情况
2.2 LRP4 在PTC 中的表达情况
在Oncomine数据库中,自2006年起共有3篇文献涉及LRP4 在PTC 组织和正常组织中的表达情况,共5 个mRNA 数据集包含了135 例样本。文章分别发表于Clin Cancer Res
、Proc Natl Acad Sci U S A
杂志。对这5 项研究结果进行Meta 分析显示,LRP4 在所有差异表达基因中的中位数值排名为11,P
=3.06×10,提示LRP4在PTC中高表达。2.3 LRP4 在正常组织及不同PTC 组织中的差异表达情况
在Oncomine 数据库中,LRP4 在上述5 项数据集中正常组织及PTC 组织中的差异表达结果显示,LRP4 在PTC 及其不同分型(包括滤泡型PTC及柱状细胞变异性PTC)组织中的表达量均明显高于正常组织(P
﹤0.01)。(表2)
表2 Oncomine 数据库5 项数据集中LRP4 在正常组织及PTC 组织中的差异表达情况
2.4 LRP4 与PTC 患者预后的关系
在Oncomine 数据库中,对“Clinical Outcome:Survival Status”进行限制,筛选出一癌症基因组图谱(The Cancer Genome Atlas,TCGA)DNA 数据集,其中包括1012 例样本信息,LRP4
基因表达与正常组织有差异的样本共505 例,其中PTC 组织327 例(高表达164 例,低表达163 例),对数据进行提取并进行分析显示,LRP4 高表达与低表达患者的生存情况比较,差异无统计学意义(χ
=0.423,P
=0.515)。(图2)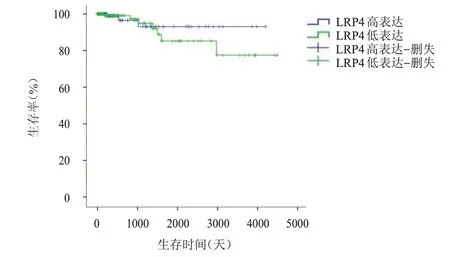
图2 Oncomine数据库中LRP4高表达(n=164)与低表达(n=163)PTC患者的生存曲线
3 讨论
头颈部肿瘤的相关发病资料显示,TC 的发病率居首位,是临床上最常见的内分泌系统恶性肿瘤,其中又以PTC 最为多见。近几十年TC 在世界各国的发病率呈快速增长趋势,尤其在近十年来发病人数迅速增加。全球流行病学数据显示,2018 年TC 患者约56.7 万例,占全部肿瘤患病人数的3.1%,在世界居第九位,在中国居第七位。甲状腺癌的致病因素复杂,但主要与放射性物质、碘摄入量、肥胖、性激素、遗传因素、心理因素、社会因素和生活压力等有关,且不同性别、年龄和地区患者之间存在明显差异,但其具体病因和发病机制尚不明确。探索TC 尤其是PTC 的发病原因、机制及精准治疗方法是目前国内外研究的热点。
LRP4是低密度脂蛋白受体家族的成员之一,由细胞外结构域、O 寡糖修饰域、4 个β螺旋桨结构域及8 个LDLa 结构域构成。LRP4
起初为神经肌肉疾病的关键基因,近些年研究发现其水平与血浆中胆固醇含量有关。而肿瘤发展和迁延又与胆固醇水平相关,有研究证明低密度脂蛋白可促进肿瘤的发展恶化。在胆固醇介导的神经细胞生长过程中,LRP4 可通过结合apoE 抑制神经细胞的生长。Wei 等研究证实,PTC 患者LRP4 表达水平升高,提示LRP4 可能在PTC 的发病机制中发挥重要作用,LRP4 促进PTC 的增殖、迁移和侵袭。研究表明,敲减LRP4
可抑制TPC-1 细胞增殖、迁移和侵袭,而过表达LRP4 可逆转过表达miRNA-140 对TPC-1 细胞增殖、迁移和侵袭的抑制作用。因此,LRP4 为PTC 的诊断、治疗以及预后提供新的思路和靶点。Oncomine 数据库是目前世界上最大的基因芯片数据库和整合数据挖掘平台,注册账户后可以通过使用过滤器挖掘肿瘤相关的基因信息。本研究所有资料都来自该数据库中的基因芯片数据,研究方法一致。通过对Oncomine 数据库进行深入挖掘结果显示,LRP4 在头颈部肿瘤、结直肠癌、神经系统肿瘤等多种肿瘤中高表达,且LRP4 在TC中高表达。目前有研究显示,LRP4 可通过诱导磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)介导的上皮-间充质转化促进PTC 的增殖、迁移和侵袭;LRP4
基因敲除可改善PTC 细胞的攻击行为,表明LRP4 可能是PTC 的一个有效的生物标志物,也是一个有用的治疗靶点。此外,本研究也存在一定局限性,由于Oncomine 数据库中收录数据的限制,对于LRP4 与TC 患者生存状态的研究仅利用一项DNA 数据进行间接分析,未直接通过mRNA 数据探索LRP4 表达差异与患者预后之间的关系。尽管通过对数据库PTC 基因芯片信息进行了深入分析,但由于Oncomine 数据库中数据量的限制,研究结果还需进一步结合临床研究进行验证。LRP4 在PTC 中的作用机制及临床意义还有待更多研究进一步探索和完善。综上所述,通过对Oncomine 基因芯片数据库中肿瘤相关基因的信息进行深入挖掘,发现基因LRP4
在PTC 组织中高表达,在正常组织中低表达,有助于丰富LRP4 在PTC 精准治疗中的理论依据,但其具体作用机制还需进一步研究。