首发为食管鳞癌的多原发癌患者临床特征及生存分析*
2021-10-22张彦秋彭雪梅冷爱民
文 珍, 张彦秋, 吴 蓉, 彭雪梅, 陈 彬, 冷爱民
(中南大学湘雅医院, 湖南 长沙 410000)
多原发癌(multiple primary malignancies,MPMs)是指同一个体的单个或多个器官、组织同时或者先后发生两个或两个以上独立的原发性恶性肿瘤[1]。自1889年 Billroth 首次对1例外耳上皮癌切除术后发生胃癌的病例进行了报道以来,多原发癌得到了越来越多的关注。Warren和Gates通过回顾性分析总结1259例多原发癌患者的临床资料后,首次提出了关于多原发癌的临床诊断标准[2]。
近年,多原发癌的发病率呈现持续上升的趋势。然而,由于多原发癌病因及发病机制的复杂性,以及肿瘤患者临床特征的差异性,临床上对多原发癌的诊治仍存在较大问题。多原发癌的漏诊和误诊,不但会延误患者病情使其错过最佳的诊治时机,而且会影响患者的预后,降低其生存质量。所以,进一步开展多原发癌的研究,对于提高临床诊治水平及改善肿瘤患者预后具有重要的意义。
由于多种影响因素的共同作用,多原发癌的发生及分布情况在不同的地区各有异同。欧美国家多原发癌以乳腺癌、结直肠癌等偏多[3],而日本和韩国则以消化道肿瘤居多,其中又以胃癌为首[4]。多项研究显示,消化道器官是我国多原发恶性肿瘤常见的发病部位[5]。
近20年里,食管癌在全球恶性肿瘤中发病率位居第8、死亡率位居第6。中国作为食管癌发病率和死亡率最高的国家,每年新发食管癌病例数高达47.8万例,每年也大约有37.5万人死于食管癌[6]。在我国,食管癌中90%以上为鳞状细胞癌,食管鳞癌(esophageal squamous cell cancer,ESCC)是消化系统常见的恶性肿瘤,虽然总体预后较差,但疾病不同阶段的患者预后差别极大。中晚期食管鳞癌患者5年生存率虽仅15%左右,但早期患者5年生存率可高达90%以上[7]。作为食管癌的一种特殊类型,多原发食管癌包括各原发病灶均在食管以及发生于食管外其他器官组织的原发性恶性肿瘤。由于各原发肿瘤病理类型不同,预后也不尽相同。多原发癌的发生在一定程度上影响食管癌的治疗方式选择及治疗效果,因此,在对食管癌进行诊治时,密切关注多原发癌显得尤为重要。
目前,关于食管鳞癌患者再发多原发癌的病例仍然缺乏大样本病例研究,既往病案报道限于病例数量较少难以进行有效的统计分析。虽有较多关于多原发食管癌的大数据研究,但对于首发癌为食管鳞癌后发生多原发癌患者的具体研究鲜有报道。本研究的目的是基于SEER数据库大量的数据,分析ESCCFPM患者的临床特征并探讨影响其预后的相关因素,提高临床医师对多原发食管癌的认识,以期提高医疗诊治水平,减少对多原发癌的漏诊和误诊,改善患者预后。本文对大样本的研究,也可为我国今后的类似研究提供参考和借鉴。
1 资料与方法
1.1 一般资料
基于SEER数据库,使用客户端SEER Stat(8.3.6)下载所需的患者资料。考虑SEER数据库于2004年对一些肿瘤变量信息进行了更新及扩增,使得研究数据更加丰富。同时为保证一定随访时间,本研究选取2004年1月1日至最近更新到的2016年12月31日的数据。
诊断标准:(1)每一个肿瘤必须是由组织病理学证实为恶性;(2)每一个肿瘤有各自的病理形态,在位置上必须是分开和独立的;(3)必须排除可疑的转移癌或复发癌。1961年Meortel又根据两癌间隔时间,将多原发癌分为同时性多原发癌(两癌间隔时间≤6个月)和异时性多原发癌(两癌间隔时间﹥6个月),从而成为国际上MPMs诊断与分类的金标准。本研究根据诊断第二肿瘤距离食管鳞癌时间间隔是否大于六个月将多原发癌分为同时性多原发癌(synchronous primary malignancy)及异时性多原发癌(metachronous primary malignancy),对于出现3个原发灶及以上病例者第二原发癌和首发食管鳞癌之间的时间间隔被用来确定它是同时性还是异时性的。
排除标准:(1)患者临床资料缺失或不完整,比如病理分级、TNM分期、生存状况、生存时间等;(2)食管鳞癌不是作为首发癌;(3)不是通过病理组织学确诊;(4)存活时间小于1月或者未知;(5)随访情况不明;(6)尸检或死亡证明报告的患者。本研究纳入的研究变量包括确诊年龄、人种、性别、病理分级、TNM分期、原发肿瘤位置、多原发癌部位、首发癌治疗情况(手术、放疗、化疗)、生存时间、生存状态。经过筛选,最后总共纳入540名患者进行数据分析。
1.2 统计学处理
采用SPSS 22.0及 Rstudio(R-3.4.0)统计软件进行数据分析,两组均符合正态分布的连续性数据以t检验(Student’st.test)来检验是否具有统计学差异,否则以Mann-Whitney U检验进行比较是否具有统计学差异。计数资料采用%表示及χ2检验差异的显著性,两组分类资料的分析比较,以卡方检验(Chi—squaredtest)或者Fisher精确检验(Fisher’Sexacttest)进行,使用Kaplan-Meier法作生存预后分析,并绘制生存曲线,建立多因素Cox回归模型分析ESCCFPM患者的相关预后因素。
2 结果
2.1 临床病理学特征
根据入组标准,本研究最终纳入了符合条件的540例ESCCFPM患者,其中男性350例(64.8%),女性190例(35.2%),男女比1.8:1。≤60岁组159例(29.4%),61~80岁组338例(62.6%),>80岁组43例(8.0%)。由于SEER数据库收集的数据主要来源于美国本土,因此本研究中白人在人数上占有绝对的优势,位居第一为326例(60.4%),黑人在数量上排列第二为150例(27.8%),而其他包括亚洲人种在内的仅有64例(11.8%)。ESCCFPM中食管鳞癌患者病理组织学分级为G2和G3级的患者为绝大多数有407例,且食管鳞癌好发部位仍以胸部中、下三分之一段为主。本研究中双原发癌患者491例(90.9%),三原发癌患者42例 (7.8%),四原发癌7例(1.3%)。其中,同时性多原发癌患者245例,异时性多原发癌患者295例。首发食管鳞癌患者主要采用手术、放化疗三种治疗方式。其中,非手术治疗401例(74.3%),手术者139例(25.7%)。手术同时进行了淋巴结切除患者有120例。行放疗患者402例(74.4%),接受化疗患者406例(75.2%,表1)。
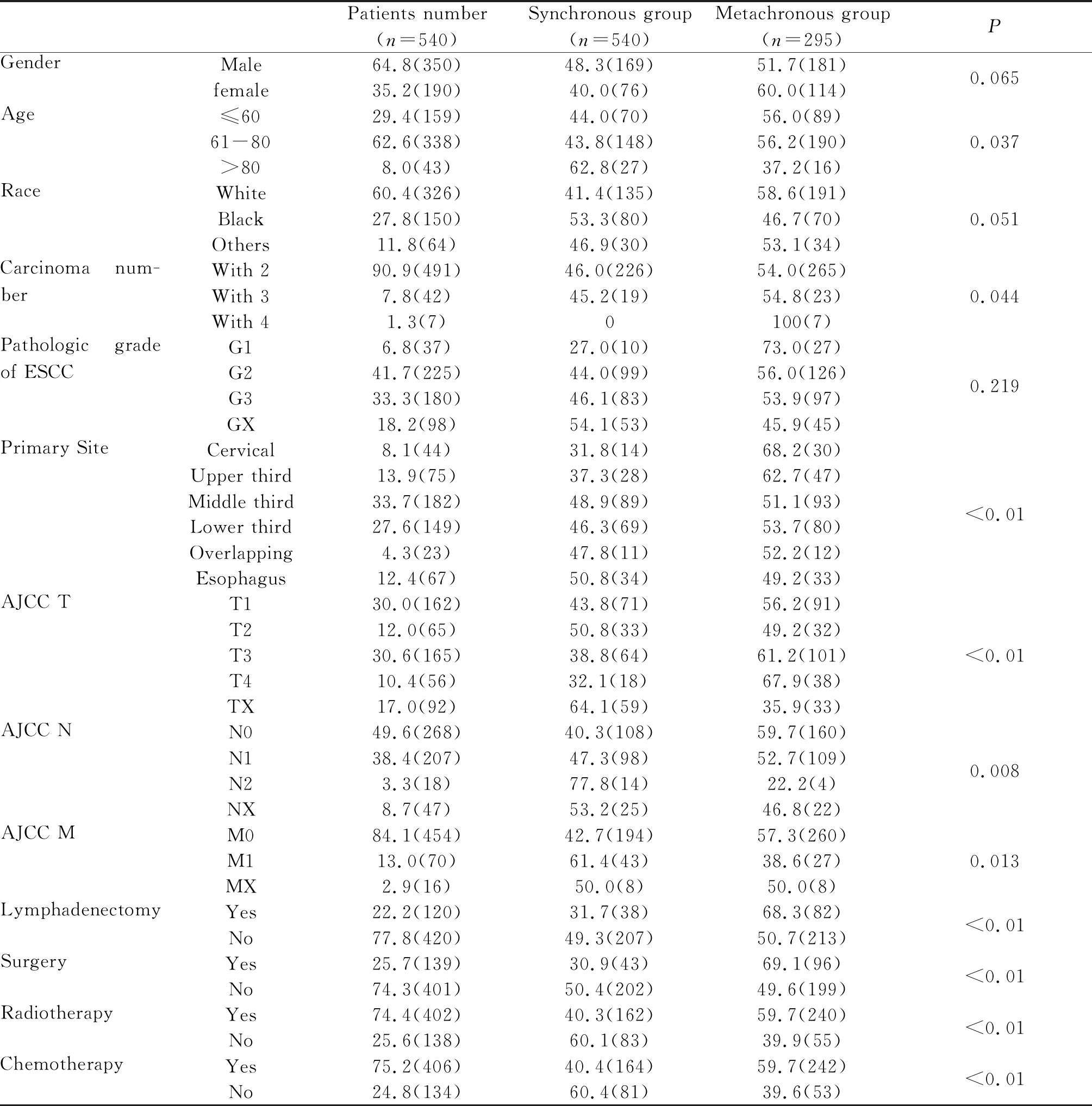
Tab. 1 Characteristics of 540 ESCCFPM patients [% (n)]
2.2 发病部位
540例ESCCFPM患者共计发生于596个部位。发生部位较多依次为:呼吸系统、消化系统、生殖道、泌尿道、胸部(含胸腺和胸膜间皮瘤)、血液系统、甲状腺和皮肤;同时性组前三位依次为:呼吸系统(38.3%)、消化系统(36.7%)和泌尿系统(6.8%);异时性癌组前三位依次为:呼吸系统(35.8%)、消化系统(34.0%)和生殖系统(12.7%,表2)。
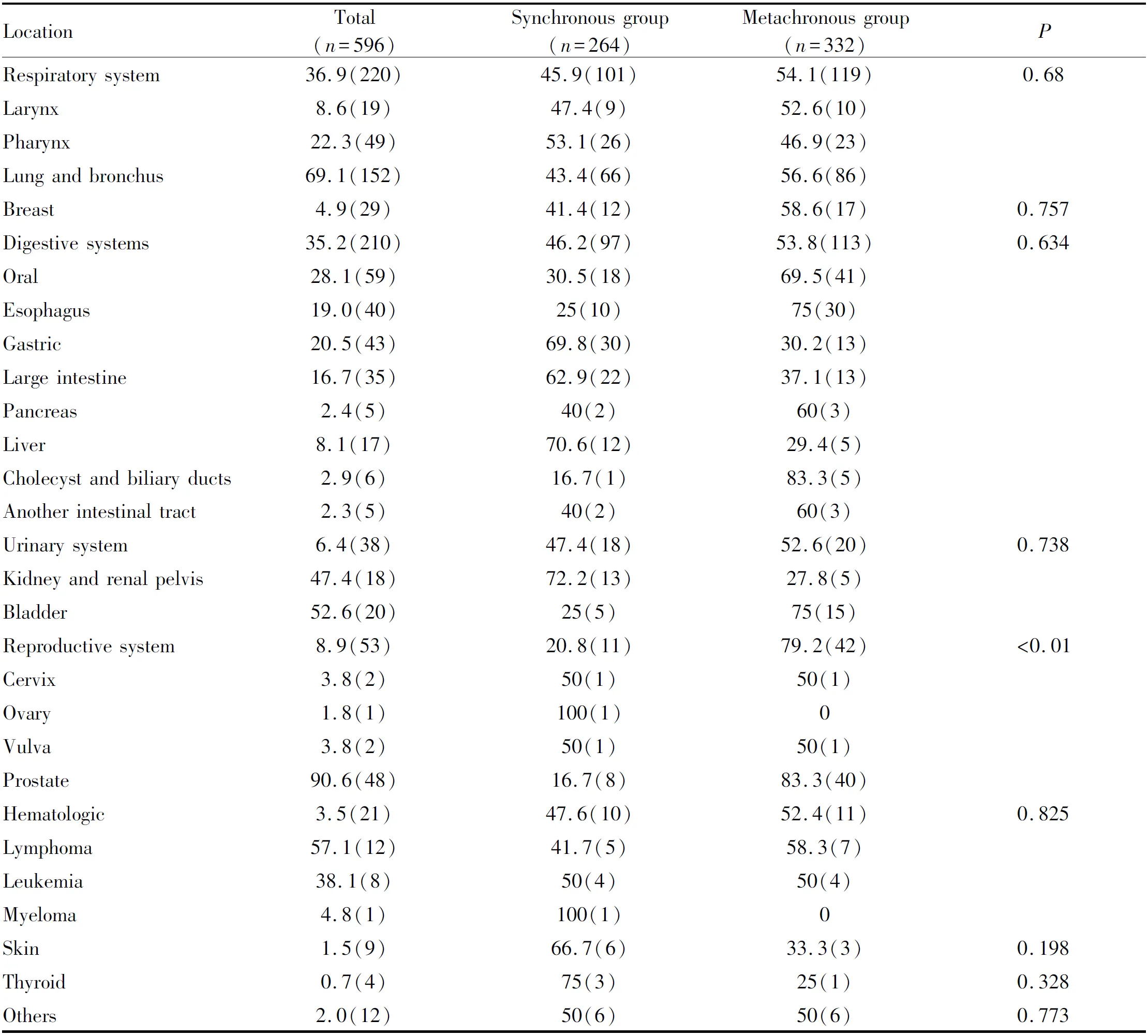
Tab. 2 Distribution of MPMs associated with ESCC [% (n)]
2.3 单因素预后分析
540例ESCCFPM患者总生存时间为1~154月,中位生存时间36月。1年、3年和5年的总生存率分别为75.9%、50.4%和38.9%。单因素生存分析结果显示:食管鳞癌确诊时年龄(P<0.01, 图 1A)、种族(P=0.059, 图1C)、多原发癌发病间隔分组(P<0.01,图1D)、多原发癌数目(P=0.039,图 1E)、手术治疗(P=0.00021, 图1H)、淋巴结切除(P<0.01, 图1F)、放疗(P<0.01, 图1G)及化疗(P=0.00021, 图1I)是影响ESCCFPM患者总生存期的预后因素。
2.4 多因素预后分析
将ESCCFPM患者生存时间作为时间变量,生存死亡作为状态变量,以死亡(Y=1)为事件,将本研究中可能对ESCCFPM有影响的因素作为协变量,纳入 COX 回归分析中,使用向前 LR 的方法输出 COX 回归方程,HR 及 HR 的 95%CI,输出结果“reference”为参照组,详见表3(P<0.05为差异有统计学意义)。“HR”是相对危险度,当HR>1时,提示暴露因素是阳性事件发生的促进因素,当HR<1时,提示暴露因素是阳性事件发生的阻碍因素。如表所示:年龄在61~80区间患者的死亡率是年龄≤60的1.305倍95%CI(1.036-1.645)、年龄>80患者的死亡率是年龄≤60的2.349倍95%CI (1.614-3.421)、黑色人种的死亡率是白种人的 1.321倍95%CI(1.046-1.667)、食管鳞癌T4期患者的死亡率是T1期患者的2.103倍95%CI(1.486- 2.997)、异时性多原发癌组的患者死亡率是同时性多原发癌组的0.216倍95%CI(0.172-0.271)、三原发癌患者的死亡率是双原发癌患者的0.597倍95%CI(0.043-0.884)、行手术治疗患者的死亡率是未行手术的0.578倍95%CI(0.338-0.987)、行放疗患者的死亡率未行放疗的0.587倍95%CI(0.434-0.796)。也就是说,分组为异时性的多原发癌、手术及放疗为影响ESCCFPM患者预后的独立保护因素,而年龄>60、黑色人种、食管鳞癌T4分期是影响ESCCFPM患者预后的独立危险因素。
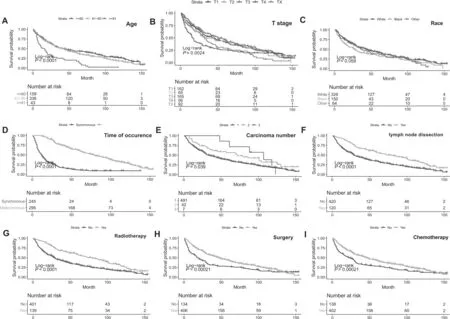
Fig. 1 OS for patients with ESCCFPM stratified by (A) age; (B) 8th AJCC T stage; (C) Race; (D) Time of occurrence; (E) Carcinoma number; (F) lymph nodes dissection (G) radiotherapy; (H) Surgery; (I) Chemotherapy
3 讨论
食管鳞癌(esophageal squamous cell cancer, ESCC)伴发其他器官部位的多原发癌是一种常见的临床现象,文献报道发生率在9.5%~21.9%[8]。由于多原发癌的肿瘤类型不一,预后也不尽相同。多原发癌的存在一定程度影响着食管鳞癌的治疗策略及效果。美国国立癌症研究所“SEER数据库”是北美最具代表性的大型肿瘤登记注册数据库之一,包含了美国18个州地区的统计数据,覆盖了大约28%的美国人口,记录了肿瘤患者的人口学特征、肿瘤特征及生存预后数据,数据可信度高,为临床医师及科研工作者提供了系统的证据支持和宝贵的第一手临床资料[9]。本研究选取该数据库作为数据来源进行分析的结论也相对可靠。食管鳞癌在男性患者中发病率更高,本研究同样发现多原发癌患者中男性人数明显多于女性。这可能与男性患者暴露与更多的致癌危险因素相关。本研究中大部分患者首发癌确诊年龄在61~80岁之间。提示处于此年龄段的食管鳞癌患者应当积极复查,时刻警惕多原发癌的发生。本研究中高龄患者相对于低龄患者预后更差,考虑与高龄患者基础疾病多,且抵抗力及所受危险因素暴露时间长于年轻患者有关。虽然目前没有研究表明种族与食管鳞癌后多原发癌的发生有关,但本文发现黑人患者相对于白人患者总生存率较低。由于数据中黑人人数少,结论可靠性需进一步证实。
汕头大学医学院附属肿瘤医院的Li和Lin等[10]报道,食管鳞癌发生于上,中胸段占病变部位的66.67%。本研究发现无论同时性还是异时性多原发癌,其食管鳞癌的病变部位主要位于胸中、下段,与Chen等[11]报道一致。王肖飞等[12]发现,下段食管癌患者第二原发癌的发病风险较低。本研究暂未发现食管鳞癌发病部位与多原发癌患者预后相关,肿瘤位置与患者预后的相关性仍有待进一步研究。
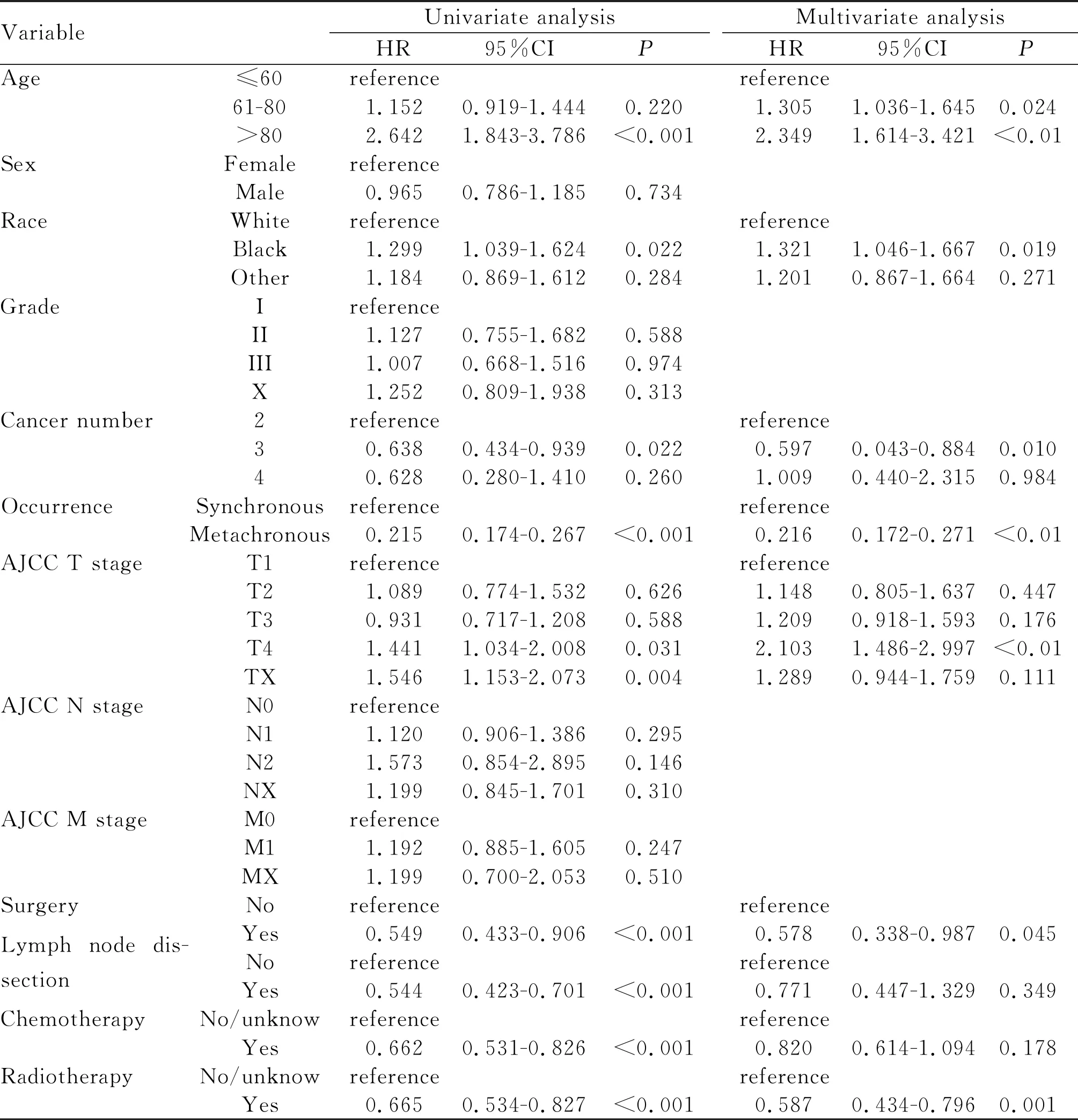
Tab. 3 Univariate andmuItivariate anaIysis of prognosis of ESCCFPM
肿瘤的分化水平是评价肿瘤恶性程度的一个重要指标,分化程度越低的肿瘤其疾病进展速度越快。本研究高分化食管鳞癌患者最少,仅有37例、分化程度为中分化食管癌病例数最多为225例、低分化者180例、未分化者98例,并未发现食管鳞癌的分化程度与患者预后之间的相关性,可能与本研究中有较多未分化患者导致结果出现偏差有关。TNM分期是可以预测肿瘤患者预后的有效工具。有研究显示,食管癌T分期与患者预后显著相关[13]。本研究中,T1期病例数162例(30.0%),T2期65例(12.0%),T3期165例(30.6%),T4期病例数仅56例(10.4%),未明确具体分期者93例(17.0%)。单因素生存分析发现T4期与较差的预后相关,可能与该部分患者肿瘤浸润较深,被发现时多已经发生了侵袭及转移有关。大部分多原发癌患者首发癌诊断在较为早期阶段,N0期患者占总人数的49.6%(268/540),M0期患者占比更是高达84.1%(454/540)。但本研究中未见T0及Tis期患者,确诊时有淋巴结侵犯的患者人数也高达272例(50.4%)。这一方面揭示了早期诊断的患者预后良好,能获得更高的生存期,从而其发生多原发癌能更多地被随访,另一方面也说明了食管癌早期确诊的难度。
本研究中,双原发癌患者有491例(90.9%),三原发癌患者42例(7.8%),四原发癌患者仅7例(1.3%),暂无五原发癌及以上病例。同时性多原发癌组中未见四原发癌的病例。通常意义上,多原发癌的存在被认为与食管癌的不良预后有关。然而,Baba[14]等发现,虽然食管同时性多原发癌的生存期明显短于食管单一癌患者,但异时性多原发癌预后与食管单一癌患者相似。本研究单因素生存分析发现,异时性多原发癌患者相比于同时性患者有更好的预后,与文献报道[15]相符。以上情况出现的原因可能有:(1)同时性多原发癌患者在短时间内遭受多个原发肿瘤的打击,机体基础情况差,难以承受有效的临床治疗。(2)异时性多原发癌在确诊时,首发癌往往已经得到一定程度的控制甚至治愈。(3)有肿瘤病史的患者再发癌症的风险明显高于无病史者,临床医生对异时性多原发癌的识别及治疗方面可能要优于同时性多原发癌。本研究540例ESCCFPM患者总生存期为1~154月,1年、3年和5年的总生存率分别为75.9%、50.4%和38.9%,整体预后情况较好,可能与本研究中异时性多原发癌患者多于同时性多原发癌有关。
食管癌后发生第二原发癌最常见的部位是上消化道及呼吸系统[16],这与本研究发现的结果基本一致。该现象的可能解释为这些部位属纤毛柱状或复层鳞状上皮且暴露于共同的致癌危险因素,如烟酒及各种物理、化学刺激等,导致局部“区域癌化”,最终发生多个位于该区域的原发肿瘤[17]。
在过去的几十年中,外科技术和治疗方式的进步已使接受食管癌切除术的患者的5年总生存率从14.4%提高到46.3%[18]。本研究虽仅25.7%的多原发癌患者对首发食管鳞癌进行了手术治疗,但生存分析发现,手术治疗与更好的总生存期密切相关。手术可直接切除肿瘤病灶,防止肿瘤的浸润及扩散。Otowa,Y.等[19]通过分析比较273例多原发食管鳞癌患者与单一食管鳞癌患者的预后发现二者的总生存率无明显差异,且行手术切除的异时性多原发癌患者预后明显好于未行手术者。Lee等的研究[8]提示在选择的病例中对食管癌伴发多原发癌行病灶切除是可行的,并且预后良好。然而,有研究显示接受手术治疗的多原发食管癌患者术后死亡率相对较高(8.5~9.3%)[1]。关于多原发癌是否能行手术治疗需要临床医生结合患者情况具体分析。
由于多原发癌外科手术操作的复杂性及多种并发症的高发性,放化疗被视为一种可靠的非手术策略。Shirai K等[20]发现行放疗的食管癌多原发患者的预后主要取决于肿瘤的临床分期,而不取决于多原发癌的存在与否,放射疗法对食管癌多原发癌患者是安全且有效的。Shinoto M等[21]报道了同时性头颈癌和食管癌患者行放化疗治疗与较低死亡率相关。本研究中74.4%患者进行了放射治疗,75.2%进行了化学治疗。接受放化疗的患者与未进行放化疗者相比前者有更好预后,且放疗是影响ESCCFPM患者的独立保护性因素。化学疗法与放射疗法相结合可杀伤肿瘤细胞,消除转移和微转移病灶,从而带来生存益处。然而,相反的研究发现接受放化疗的食管鳞癌患者相比未接受者发生第二原发癌的风险更高[22]。放化疗增加食管鳞癌患者发生第二原发性恶性肿瘤的风险可能与放化疗中的化学试剂和放射性离子有关,这些物质多能诱导基因发生突变、降低个体免疫功能从而导致肿瘤发生。多原发癌的治疗具有挑战性,不仅仅是因为对其认识的不足,更重要的是在不同治疗方式的决策及风险评估上难以取得平衡。
尽管SEER数据库统计得到的临床数据量大并且质量较高,但是由于种族、生活环境以及医疗条件的差别,由此得到的结论能否适用于我国尚存在争议,整合国内医院的数据进行多中心统计分析是下一步的研究方向。其次,本研究基于SEER数据库的二次分析,在选取变量方面比较受限,因而对结论的验证能力较差。而且,SEER数据库本身具有一定的局限性,它未纳入如个人史、家族史、环境等可能影响多原发癌发生发展的因素而可能会造成偏倚。第三,尽管数据库收录了放化疗信息,但放/化疗仅被描述为是,否或未知,且放化疗的次序、时间、具体的剂量、具体的方案均未记载,这也可能会造成偏倚。第四,本研究纳入的病例数虽有540例,但数据量仍较少,得到的结论可靠性仍需进一步验证。第五,本研究对食管鳞癌外的其他多原发癌临床特征分析较少,对于不同多原发癌之间的影响未深入探讨,这也是今后需要努力的方向。
综上,近年来,鉴于现代医疗诊治水平的提高及就医情况的改善,肿瘤患者拥有更长的生存期,因此,多原发癌的发病率也不断提升。但由于多原发癌病因、发病机理的复杂性以及肿瘤患者临床特征的差异性,临床对多原发癌的认识及诊治仍存在很大不足。美国ESCCFPM患者,男性多于女性,发生两个原发性癌症的病例多见,再发的原发性肿瘤多累及呼吸、消化系统。对于年龄在61~80岁的ESCCFPM患者加强呼吸及消化道肿瘤的筛查可能有助于早期确诊多原发癌。生存分析显示:食管鳞癌确诊时年龄、种族、T分期、多原发癌发病间隔分组、多原发癌数目、手术及放疗是影响ESCCFPM患者预后的独立危险因素。虽然该数据库来源于美国,本研究亦未结合国内医院的数据进行多中心统计分析对比,故该结论能否适用于我国尚存在争议,但可为我国今后的类似研究提供参考和借鉴。
