Sox11基因对发育期小鼠大脑皮层神经元迁移的影响*
2021-10-22孙小婉栾志琳
吕 烨, 孙小婉, 张 聪, 栾志琳
(大连医科大学医学科学研究院, 辽宁 大连 116044)
人类SOX11基因是转录因子SOX (SRY-related HMG-box) 超家族C亚族成员,该超基因家族由众多SRY (sex-determining region of Y chromosome) 相关基因构成,编码一系列具有DNA结合能力的蛋白质,被认为是一类重要的转录调控因子[1]。
Sox11在发育期神经系统中广泛表达,这揭示了其在神经发生,神经存活和神经突生长中的潜在作用。Sox11一般不表达于神经干细胞,而是表达于分化特定阶段的神经元前体和早期分化神经元,且随着神经发育的进行而下降[2, 3]。大脑分化成熟后,Sox11仅局限表达于两个特定区域,即海马的室管膜下区 (subventricular zone, SVZ) 和海马齿状回 (dentate gyrus, DG),并与神经元前体细胞标记物Doublecortin共通表达于已分化但未成熟的神经元前体中,提示Sox11在新生神经元的产生过程中具有阶段性的特异性功能[4]。
全基因组范围内的染色质免疫共沉淀技术 (ChIP) 表明,Sox11与胚胎干细胞衍生的神经元中的许多特异性基因的启动子区结合,表明Sox11在神经干细胞 (neural stem cells, NSCs) 向神经元的分化中起着重要的调节作用[5]。除此之外,在皮质神经元放射性迁移过程中,Sox11抑制树突形态发生这一功能在大脑皮层的形成中也发挥重要作用[6]。
根据北京大学精神卫生研究所张岱教授课题组在中国北方汉族人群中进行的全基因组关联研究 (genome-wide association study, GWAS) 获得的原始数据,提示人类SOX11基因可能是精神分裂症潜在易感基因。既往我们在包含705例精神分裂症患者和1348例健康对照的中国汉族人群独立样本中进行病例对照关联分析,发现位于SOX11基因3’端非翻译区 (untranslated region, UTR) 或3’端近基因 (near gene) 序列中的6个SNP位点与精神分裂症显著关联 (等位基因P值范围为0.0009到 0.0085),证实该基因与精神分裂症关联,为精神分裂症的易感基因[7, 8]。
目前,Sox11如何通过影响神经发育从而导致精神分裂症的机制尚不明确,即Sox11在神经发育过程中的功能仍有待进一步研究。既往研究显示,诸多精神分裂症易感基因均会影响神经元迁移,如DISC1[9],RELN[10]等。所以,我们有理由推测,Sox11也可以在神经元迁移过程中发挥作用。本研究采用小鼠作为实验动物,用RNA干扰的方法,在胚胎期小鼠脑内SVZ区神经干细胞中干扰Sox11 mRNA翻译成蛋白质的过程,从而降低Sox11的表达,来探索Sox11在大脑发育期,尤其是神经元迁移过程中可能发挥的功能。
1 材料与方法
1.1 主要材料与仪器
真核细胞过表达pcDNA3.1-Myc-6His载体购自美国INVITROGEN公司;pGEM-T载体购自美国PROMEGA公司;真核细胞过表达pcAGGS-IRES-EGFP载体及RNA干扰pSUPER-GFP载体由同济大学丁玉强教授馈赠。荧光定量PCR试剂盒购自大连Takara生物工程公司;荧光定量PCR仪 (美国ABI公司);细胞电转仪 (美国AMAXA公司);冰冻切片机 (美国LEICA公司);荧光显微镜 (日本OLYMPUS公司)。
1.2 质粒构建
扩增小鼠和大鼠的Sox11 cDNA全长 (mSox11 cDNA:正向:5'-GCT AGC GAT GGT GCA GCA GGC CGA-3';反向:5'-AAG CTT ATA CGT GAA CAC CAG GTC G-3'。rSox11 cDNA:正向:5'-GCT AGC GAT GGT GCA GCA GGC CGA-3';反向:5'-AAG CTT ATA CGT GAA CAC CAG GTC GGA G-3'),并将其克隆到pcDNA3.1-Myc-6His质粒和pCAGGS-IRES-EGFP载体中。构建小鼠mSox11 shRNA (正向:5'-GAT CCC CGG GAC TGC GCC GCG GGC AAG GTT CAA GAG ACC TTG CCC GCG GCG CAG TCC CTT TTT-3';反向:5'-AGC TAA AAA GGG ACT GCG CCG CGG GCA AGG TCT CTT GAA CCT TGC CCG CGG CGC AGT CCC GGG-3'),并将其插入pSUPER-GFP载体。表达和敲除的效率通过转染入293T细胞系并用抗SOX11抗体 (sc-518104,美国SANTA CRUZ公司) 和抗c-Myc抗体 (sc-40,美国SANTA CRUZ公司) 进行免疫印迹实验来验证。
1.3 细胞培养
人胚胎肾母细胞瘤细胞株293T (本实验室保存) 用DMEM(H) 加5% FBS于37℃、5% CO2的细胞培养箱中常规培养。
1.4 LipofectamineTM2000介导的真核细胞瞬时转染
293T细胞于转染前一天接种于6孔板,细胞长至汇合度约70%~80%时,可准备进行LipofectamineTM2000 (美国INVITROGEN公司) 介导的真核细胞瞬时转染。用无血清、无抗生素Opti-MEM将5 μg DNA质粒稀释至250 μl,轻柔混匀;用无血清、无抗生素Opti-MEM将10 μl LipofectamineTM2000稀释至250 μl;将DNA稀释液加入LipofectamineTM2000稀释液中,轻柔混匀室温静置20 min;细胞用无血清无抗生素DMEM洗两次,缓慢向培养板中加入上述转染液,置于细胞培养箱培养5~6 h;弃去上述转染液,加入含5%胎牛血清 (美国GIBCO/BRL公司) 的完全培养基培养48 h收获细胞。
1.5 实验动物
实验用孕鼠购自大连医科大学实验动物中心,所用小鼠品系为C57BL/6。以雌鼠见栓为胎鼠胚胎发育第0.5日 (E0.5),胚胎电转实验对象为胚胎期第14.5日胎鼠 (E14.5)。所用小鼠的饲养和实验均遵照大连医科大学动物饲养及使用管理条例。
1.6 胚胎电转
0.7%戊巴比妥钠1 ml/kg,腹腔注射麻醉孕鼠。腹部铺无菌洞巾,正中切口,取出子宫,将电极未拉制端用内径1.5 mm的聚乙烯软管套紧,软管另一端接200 μl 进口砂芯tip头,用口吸住tip头,先通过电极最尖端吸入质粒混合液2 μl。用无齿镊子连带孕鼠子宫壁固定胎鼠头,在胎鼠眼睛稍上方进玻璃电极,方向朝脑矢状缝和冠状缝交点,与皮肤夹角45度方向,约2~3 mm,有突破感时表明电极已经刺入脑室,用口将3组不同的质粒混合液 (对照shRNA质粒、mSox11 shRNA质粒、mSox11 shRNA干扰恢复后质粒) 缓慢吹出进入脑,可以看到脑内有倒三角形蓝色形状出现,表明质粒注入了侧脑室。然后将夹状电极 (Tweezertrode Kit,BTX,尖端直径7 mm) 放于0.9%生理盐水中,通电观察负极周围有气泡产生,表明电极良好,隔子宫壁将胎鼠头沿横轴方向 (平行于中缝) 用电极夹紧,正极在被注射质粒脑室一侧,给予电刺激,刺激模式为LV、42 V、50 ms、间隔1 s,共5个脉冲刺激。每只母鼠转6~8个胚胎,实验组和对照组各半,刺激结束后迅速将子宫移回母鼠腹腔,缝合腹膜和皮肤,进行麻醉复苏,精心饲养。处理胚胎期小鼠 (E14.5) 或出生后小鼠 (P0、P4、P7),在荧光显微镜下观察鼠脑的大脑皮层部位,转染成功的小鼠可以在脑的表面观察到绿色荧光细胞带,随即可进行免疫荧光染色等实验。
1.7 实时荧光定量聚合酶链式反应
按照组织RNA提取试剂盒说明书 (天根科技) 从不同年龄 (E12.5,E14.5,E17.5,P0,P7,P14和P60) 的野生型C57BL/6J小鼠大脑皮质中分离总mRNA,测定其浓度和纯度,并进行逆转录反应生成cDNA (正向:5'-AGA GTT AGA GGA TGA AGG GAT TAT -3';反向:5'-TTC CAA GGA CCA CTT ACA GG-3');实时荧光定量PCR的检测采用SYBR Green嵌合荧光法,扩增目的基因和内参基因;按照荧光定量PCR说明书 (Takara) 的反应体系进行,以GAPDH (正向:5'-GCA CCA CCA ACT GCT TAG C-3';反向:5'-TCT TCT GGG TGG CAG TGA TG-3') 为内参;反应条件为:预变性50℃、2 min,95℃、10 min,然后95℃、15 s,56℃、45 s,共40个循环,每个样品均设有3个复孔。
1.8 原位杂交
用地高辛标记的反义mRNA探针在脑切片检测小鼠Sox11 RNA水平的表达。mSox11探针cDNA使用PCR引物 (正向:5'-TGG AGG GAG AAA GCT GAT GT-3';反向:5'-TTT CAA ACC TTC CGT CTG G-3') 扩增并克隆入pGEM-T载体。用T3及T7为正反向引物合成掺有地高辛标记的探针。将小鼠脑放入OCT中速冻并进行冠状位切片 (20 μm,徕卡冰冻切片机)。根据原位杂交过程进行后续实验。杂交的过程详见参考文献[11]。
1.9 Western blot
脑组织于蛋白裂解液 [20 mmol/L Tris-HCl (pH=7.5),150 mmol/L NaCl,1 mmol/L EDTA,1 mmol/L EGTA,1%NP-40,1% sodium deoxycholate,1 mmol/L PMSF,10 mg/ml aprotinin,1 mg/ml pepstatin A and 1 mg/ml leupeptin] 中进行裂解。加入上样缓冲液后在95℃变性10 min。样品20 μl左右 (含总蛋白20 μg,根据所测蛋白浓度将样品上样量调到相同), 与2 μl 10×上样缓冲液混合,95℃变性10 min;将样品和蛋白Marker依次加入上样孔,每孔上样体积均应相同,空孔以1×上样缓冲液补齐体积;在浓缩胶以稳压70 V进行电泳,进入分离胶后保持稳压110 V,直到溴酚兰染料前沿至胶底或适当位置;将凝胶移入电转槽,使其处于阴极,NC 膜处于阳极,凝胶和膜的两侧分别是滤纸及海绵,夹紧之后注入电转缓冲液,在冰上以380 mA衡流根据目的蛋白分子量转染适当时间;将膜转入用PBST (Tween20) 配制的10%脱脂奶粉溶液,室温封闭1~4 h;用一抗4℃孵育过夜;以PBST洗膜6次,每次5 min;加入二抗孵育,室温1 h;室温操作,按10 ml/100 cm2加入含35 μl/10 ml BCIP和45 μl/10 ml NBT的AP Buffer,避光显色至条带满意为止。
1.10 免疫荧光染色
组织冰冻切片或种植在多聚赖氨酸包被玻片上的细胞标本,染色前用4%多聚甲醛固定20 min,PBS洗涤3次,每次5 min。随后用0.5%TritonX-100 室温通透20 min,PBS洗涤3次,每次5 min。正常羊血清工作液室温封闭1 h。用抗体稀释液稀释一抗后,4℃过夜,PBS洗涤3次,每次5 min。选择相应二抗,用3%牛血清白蛋白稀释,室温孵育1 h,PBS洗涤3次,每次5 min,最后在荧光显微镜下观察照相。所使用抗体详细信息为:抗SOX11多克隆抗体 (sc-518104,美国SANTA CRUZ公司),抗GFP多克隆抗体 (AE012,中国ABCLONAL公司),抗c-Myc单克隆抗体 (sc-40,美国SANTA CRUZ公司),抗GAPDH单克隆抗体 (A19056,中国ABCLONAL公司),山羊抗兔lgG/DylightTM 488 (ZF-0511,北京中杉金桥生物技术有限公司)。
1.11 统计学处理
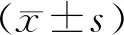
2 结果
2.1 发育期小鼠大脑中Sox11表达模式
为探究Sox11的功能,我们首先明确了其在发育期小鼠大脑中的表达模式。使用Western blot (以GAPDH作为内参) 和实时定量PCR方法检测小鼠脑内Sox11基因在神经发育中的表达。提取E (胚胎期) 12.5、E14.5、E17.5、P (产后期) 0、P7、P14、P21、成年小鼠 (P60) 皮层总mRNA用作进一步实验。
结果显示从胚胎期到成年期,Sox11基因在小鼠大脑均有表达 (图1A和B)。由E12.5至 E17.5,Sox11基因表达量逐渐增加,至E17.5达到峰值。由E17.5至P0,Sox11基因表达量逐渐下降,但表达水平仍较高。P0至P14阶段,Sox11基因表达量继续下降。P14至成年阶段,Sox11基因表达量相对较低,但保持在稳定水平。
应用原位杂交技术,我们发现Sox11基因在胚胎期小鼠大脑有广泛高表达信号;P0至P7阶段,Sox11基因在海马 (hippocampus, Hip)、室管膜下区 (subventricular zone, SVZ) 位置有高表达信号,在大脑皮层 (cortex, CTX) 也存在表达信号。在P14,Sox11基因表达信号集中出现于海马齿状回 (dentate gyrus, DG) 和室管膜下区 (图1C)。
2.2 Sox11基因对小鼠大脑皮层神经元发育与迁移的影响
如图2B所示,在 293T 细胞中进行 LipofectamineTM2000介导的真核细胞瞬时转染,采用 Western blot法,以抗c-myc单克隆抗体和抗SOX11多克隆抗体检验表达蛋白。共转小鼠Sox11-myc (mSox11-myc) 和小鼠Sox11-shRNA (mSox11 shRNA) 时,293T细胞内小鼠Sox11基因表达水平显著降低,说明构建的小鼠Sox11干扰载体能干扰小鼠Sox11基因的表达。但小鼠Sox11基因表达水平的降低同时能够通过大鼠Sox11基因过表达 (rSOX11-myc),以达到其表达恢复的效果 (Rescue)。这些结果说明实验中构建的大鼠和小鼠Sox11基因过表达载体和干扰载体可以运用到以下的功能实验中。接着我们利用胚胎电转技术,在体内干扰小鼠Sox11基因的表达来观测Sox11基因表达下降后小鼠神经元迁移的改变情况。
当mSox11 shRNA与pSUPER-GFP同时电转入14.5 d胚胎 (E14.5) 小鼠的脑室区后,分别在 17.5 d胚胎 (E17.5),出生当天 (P0),出生后4 d (P4) 和出生后7 d (P7) 观测电转的神经元的迁移情况。与对照神经元相比,转染mSox11 shRNA的神经元的迁移明显延迟 (图2A)。

Fig. 1 Expression profile of Sox11 in the developing mouse brain
在E17.5时,对照组神经元有一部分已经到达新皮层的表层,而大部分转染mSox11 shRNA的神经元仍停留在脑室区和新皮层中间区。在P0时,大部分对照组神经元迁移至新皮层的表层,而仍有一大部分转染mSox11 shRNA的神经元停留在中间区。在P4时,大部分对照组神经元迁移至新皮层的表层,而某些转染mSox11 shRNA的神经元仅有一部分迁移至新皮层的表层。在P7时,虽然有一部分的转染mSox11 shRNA的神经元最终到达了神经板表层,但仍有大部分滞留在新皮层4~5层之间以及中间区,与对照组存在显著差异,未能到达其最终发挥功能的位置。
使用大鼠Sox11基因过表达载体 (rSox11-myc) 对小鼠Sox11基因干扰 (mSox11 shRNA) 进行恢复 (Rescue) 后,观测到P0时阳性神经元分布情况与对照组基本一致 (图2C),统计结果也显示Sox11干扰后和干扰恢复后,SVZ (subventricular zone) 区、IZ (internal zone) 区和CP (cortical plate) 区内GFP阳性细胞的分布具有显著性差异 (图2D)。以上结果提示Sox11基因影响皮层投射神经元的迁移。

Fig. 2 Involvement of Sox11 in cortical radial migration in vivo
除此之外,与正常神经元相比,Sox11干扰后神经元轴突和树突的形态均显著发生改变 (图2E和F)。以上结果显示正常的神经元迁移需要Sox11在神经前体细胞中精确的表达,以平衡其在促进神经分化和神经元形态生成中的双重功能。
3 讨论
既往研究表明Sox11是精神分裂症的易感基因,但该基因在小鼠大脑皮层神经元迁移过程中的作用尚不清楚。本研究对Sox11在神经元迁移过程中的功能进行进一步探索,将有助于对其致病机制的深入了解。
Sox11基因在不同发育阶段的表达存在由广泛向局部聚集的特点。胚胎期,Sox11基因在中枢神经系统的多数脑区皆有表达,包括大脑皮层、海马、丘脑、小脑等,提示其在神经形成以及神经元发育成熟过程中均发挥功能;成年后,Sox11基因表达逐渐向神经形成区域集中,至P14该基因仅局限于海马齿状回和室管膜下区两个神经形成微环境,表明其仅在神经形成亦或是神经网络可塑性中发挥功效[12, 13]。
Sox11基因在中枢神经系统的功能研究起步较晚。在2002年,Hyodo-Miura等人首次在爪蟾模型中证实SOX11蛋白通过与MAP激酶NLK直接作用促进神经元分化[14]。2006年,Jankowski等人使用小鼠脑神经瘤细胞系Neuro2A和大鼠背根神经元细胞模型得到SOX11基因是神经存活和神经突生长必要因子的结论[15]。近些年来,还有大量关于SOX11基因所在SOXC家族在组织发生中的功能研究提示SOX11基因与SOX4和SOX12基因共同参与胚胎早期神经形成[16]。
本研究首次选用Sox11基因敲低的小鼠作为实验动物来探索该基因在神经元迁移过程中的作用。胚胎电转实验结果显示,在Sox11基因表达受干扰后,小鼠皮层投射神经元的迁移出现障碍,导致一些本应该迁移到新皮层表层的神经元滞留在中间区,且这种迁移障碍至小鼠P7时仍不能通过生理调节得到代偿。而干扰小鼠Sox11基因的同时使用大鼠Sox11基因对该干扰进行恢复后,可以一定程度上恢复神经元的正常迁移,说明这种异常完全是由小鼠Sox11基因干扰造成的,即Sox11基因确实参与投射神经元的迁移过程。我们推测,Sox11基因促进神经干细胞分化的这一功能[6]可能与其敲除后导致的皮层神经元迁移缺陷有关:当Sox11基因受到干扰时,神经干细胞分化延迟,SVZ区中神经元前体减少,导致放射性迁移缺陷。同时,当采用大鼠Sox11基因过表达来恢复敲低的小鼠Sox11基因时,结果显示阳性神经元分布情况与对照基本一致。值得注意的是,在Sox11受干扰和干扰恢复后,SVZ区、IZ区和CP内GFP阳性细胞的分布具有显著性差异。可见,即使在SVZ区中获得了更多的前体,但这些前体细胞在迁移过程中大多不能形成完整的形态,最终导致迁移缺陷。
从神经干细胞分化,到神经元发育,再至神经元迁移,这一系列步骤皆是神经发育的重要事件。体内神经干细胞存在于室管膜下区和海马齿状回颗粒细胞层,在保持多向分化潜能和增殖性的同时,一定的神经干细胞根据神经发育的需要在胚胎阶段非对称分裂,产生神经元前体细胞,这些细胞在进一步发育的同时迁离神经形成微环境直至到达其最终“居住”的脑区[4]。其中任何一个步骤出现差池,皆会导致神经发育异常,体内除神经形成早期细胞决定外,神经元前体细胞发育各个阶段皆是在神经元迁移过程中逐步完成的。
哺乳动物大脑皮层神经元形成六个板层,以发育中形成的顺序排列。组成这些板层的大部分神经元是室管膜下区放射性迁移而来的。通常认为它们的迁移是由一个放射性胶质纤维形成的网络指导[4]。所以,我们进一步推测Sox11的缺失可能扰乱了该网络指导下皮层中神经元的排布。此外,皮层中神经元的排布必须是严格有序的,这种有序性确保了皮层与海马等脑区之间的功能连接正常。而本研究发现Sox11的功能缺失延迟了神经元的迁移,这将破坏皮层中神经元排布的有序性,进而导致皮层与其他脑区之间的功能连接异常,这可能是Sox11成为精神分裂症易感基因的原因之一。
2016年,Hoshiba等人对Sox11在皮层发育过程中起到的平衡促进和抑制树突形态发生的作用进行了更细致的研究[6]。他们的结果显示,Sox11过早的抑制导致了神经元迁移的缺陷,这与我们的结果是相一致的。也有报道称,神经元迁移的缺陷可能与精神分裂症[17]和双相情感障碍的认知功能障碍有关[9]。同时许多涉及神经元迁移的基因相继被证实与神经精神疾病有关,如精神分裂症和自闭症等[18, 19],本课题组之前的关联研究也证实了Sox11是精神分裂症的易感基因。尽管神经元迁移和大脑皮质发育的机制尚不清楚,但Sox11参与神经元迁移这一关键性功能的揭示,表明了该基因在精神分裂症病因学中的生理重要性。
既往研究表明,抑制Sox11表达会导致神经突的过早发育和成熟[19]。因此,我们推测Sox11也可能由于影响神经突的分支数目,生长速度,或细胞间粘附因子从而改变神经元的迁移。本研究尚不能排除Sox11的敲低可能会影响其他神经元迁移的因素[20]。或者,若能构建Sox11组织特异性敲除小鼠可能会有助于对该基因功能的进一步探究。至此,Sox11影响大脑皮层神经元迁移的分子机制仍有待进一步的研究和探索。未来结合临床,一部分与精神分裂症关联的Sox11基因的阳性单核苷酸多态性位点如何通过影响Sox11基因的表达,从而参与精神分裂症发生发展等机制值得被我们进一步予以关注和研究。
