MELD评分联合SII对失代偿期肝硬化患者预后的预测作用
2021-10-22陆素芳周红王丹丹陈益群赵红利张勇杨
陆素芳,周红,王丹丹,陈益群,赵红利,张勇杨
肝硬化是多种慢性肝病的共同阶段,随着病变进展,最终导致失代偿期肝硬化,患者具有较高的死亡率[1]。研究显示,失代偿期肝硬化患者中位生存期约为24个月,5年生存率为14%~35%,严重影响患者的生命健康[2]。早期评估失代偿期肝硬化患者生存状况,并及时特异性干预可能对改善患者预后有积极作用。Child-Turcotte-Pugh(CTP)评分广泛用于评估肝硬化程度,但近年来研究显示其在失代偿期肝硬化等终末期肝病患者肝脏代偿能力、肝脏储备功能方面具有较大的局限性,且部分指标主观性强、缺乏对肝功能之外的评估,对此类人群预后的评估中准确性欠佳[3]。终末期肝病模型(moldel for end-stage liver disease,MELD)评分是临床应用较广的肝病患者预后评估方法之一,是评估肝脏疾病严重程度的有效指标,且对失代偿期肝硬化患者中短期死亡风险具有较高的预测准确性[4],但低MELD评分肝硬化患者中,其预测的准确性明显受限[5]。炎症反应是导致肝脏病情进展的重要因素,肝硬化合并持续性感染是导致患者死亡的主要因素之一[6]。系统免疫炎症指数(systemic immune-inflammation index,SII)是新型炎症标志物,可综合反应免疫-炎症情况,可高效预测肝硬化合并肝癌[7]、肝门部胆管癌[8]近远期生存率。目前,SII对失代偿期肝硬化预后评估中的作用研究较少,尚未见其联合MELD评分的相关报道。本研究探讨MELD评分联合SII对失代偿期肝硬化患者预后的预测作用,现报道如下。
1 资料与方法
1.1 研究对象
本研究经我院医学伦理委员会批准,回顾性分析2015年1月至2019年12月我院诊治的378例失代偿期肝硬化患者的临床资料。其中男性240例,女性138例;年龄(60.26±12.35)岁;病因分别为病毒性肝炎肝硬化294例,酒精性肝硬化20例,原发性胆汁性肝硬化12例,病因未明52例。纳入标准:①失代偿期肝硬化的诊断标准符合中华医学会肝病学分会制定的指南[9];②年龄>40岁;③住院时间>48 h。排除标准:①急性肝衰竭患者;②肝脏肿瘤或其他肿瘤;③合并血液系统疾病者;④合并其他感染性疾病、免疫功能异常或应用免疫抑制剂者;⑤合并心脏、肾脏等重要障碍严重疾病者;⑥排除资料不全及1年内失访的患者。
1.2 方法
1.2.1 资料收集 通过电子病历系统搜集患者临床资料,其中血液学指标在首次入院2 h内完成检查。①一般资料:年龄、性别、病因、并发症、合并基础疾病等;②血液学指标:中性粒细胞、淋巴细胞、血小板、白细胞(white blood cell,WBC)、白蛋白(albumin,Alb)、红细胞分布宽度(red blood cell distribution width,RDW)、C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、血肌酐(Serum creatinine,SCr)、尿 酸(uric acid,UA)、总胆红素(total bilirubin,TBiL)、丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰胺转移酶(γ-glutamyltransferase,GGT)、碱性磷酸酶(alkaline phosphatase,ALP)、国际标准化比值(international normalized ratio,INR)、凝血酶原时间(prothrombin time,PT)等。
1.2.2 评估指标计算 根据PT、Alb、TBiL等指标计算CTP评分[10]。MELD评分=3.8×ln[TBiL(μmol/L)]×0.059+11.2×ln(INR)+9.6×ln[SCr(μmol/L)]×0.0113+6.4×(胆汁或酒精性肝硬化为0,其他病因为1)[11]。SII=中性粒细胞×血小板/淋巴细胞[7]。
1.3 随访及分组
采用门诊、再入院、电话的形式对患者进行随访,研究起点为患者由于失代偿期肝硬化首次入院,研究终点为患者死亡,随访1年。根据患者预后状况分为死亡组118例(31.22%)、存活组260例(68.78%)。
1.4 统计学分析
应用SPSS 22.0软件进行统计学处理。满足正态分布的计量资料以表示,组间比较采用独立样本t检验;计数资料以%表示,组间比较采用χ2检验。采用多因素Logistic回归分析失代偿期肝硬化患者死亡的独立影响因素。运用ROC曲线分析CTP、MELD评分以及SII预测失代偿期肝硬化患者死亡的临床价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较
死亡组年龄>60岁、合并上消化道出血比例高于存活组(P<0.05),两组性别比例、合并基础疾病、病因等差异均无统计学意义(P>0.05),见表1。
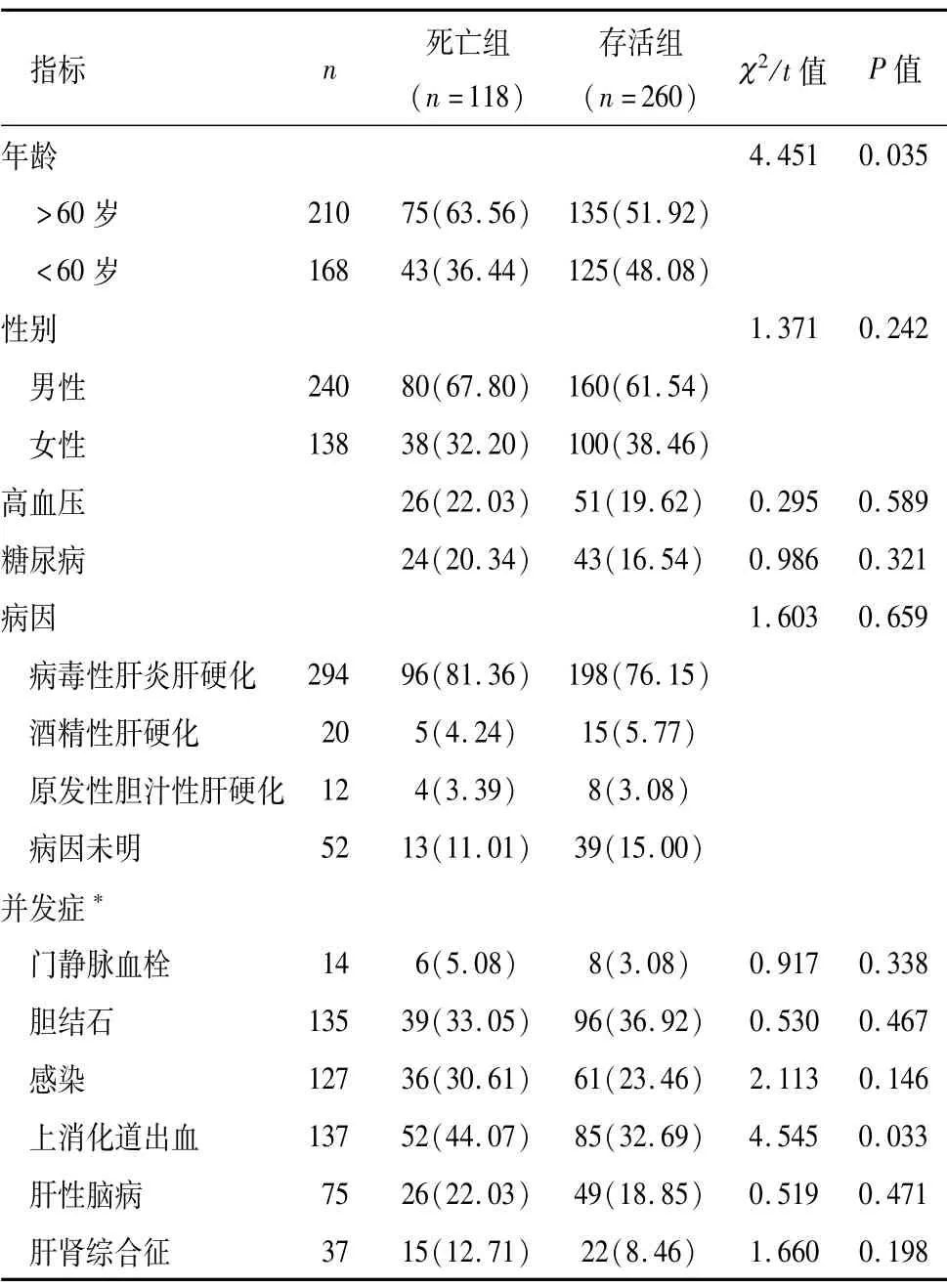
表1 两组一般资料比较
2.2 两组血液学指标比较
死亡组中性粒细胞、RDW、PCT、TBiL、INR、PT水平高于存活组(P<0.05),淋巴细胞、血小板、Alb水平低于存活组(P<0.05),两组WBC、CRP、SCr等差异均无统计学意义(P>0.05),见表2。
表2 两组血液学指标比较()
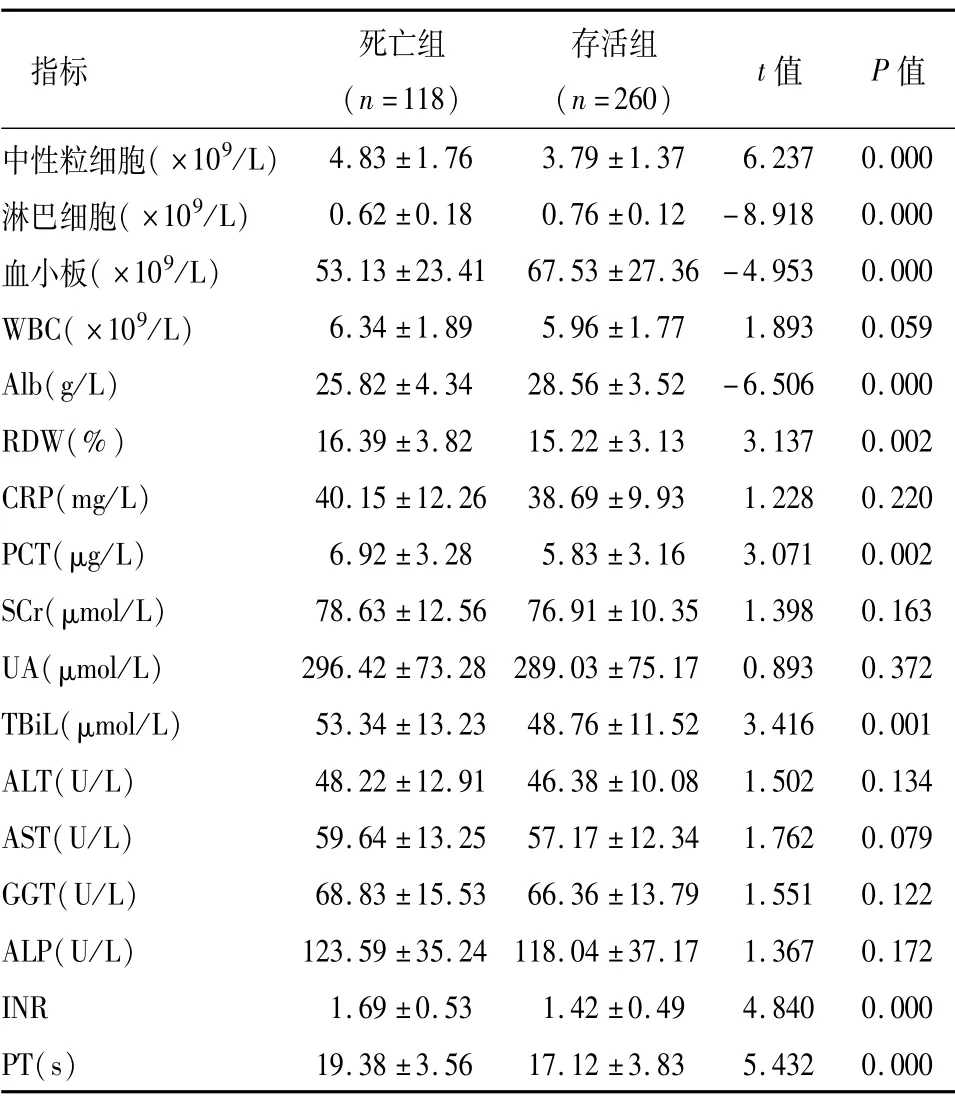
表2 两组血液学指标比较()
2.3 两组评估指标比较
死亡组CTP评分、SII、MELD评分显著高于存活组(P<0.05),见表3。
表3 两组评估指标比较()

表3 两组评估指标比较()
2.4 患者预后的多因素分析
以单因素分析差异有统计学意义的指标为自变量(连续变量以实际检测数据形式纳入模型),患者生存状况为因变量进行多因素Logistic回归分析,结果显示CTP评分、SII、MELD评分是失代偿期肝硬化患者死亡的独立危险因素,见表4。
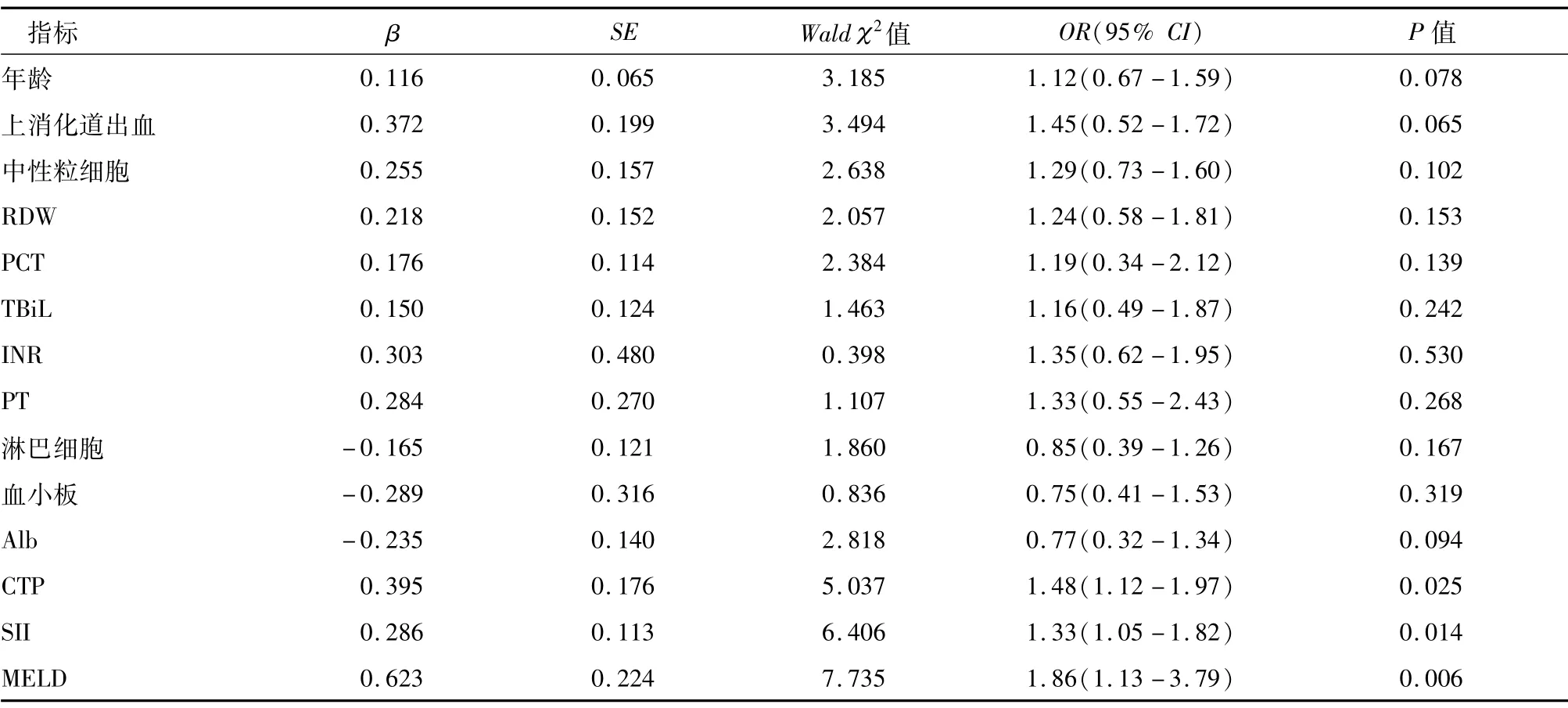
表4 失代偿期肝硬化患者预后的多因素Logistic回归分析
2.5 ROC曲线分析
CTP、SII、MELD评分预测失代偿期肝硬化患者死亡的AUC分别为0.719(95% CI:0.645-0.793,P=0.000)、0.739(95% CI:0.665-0.813,P=0.000)、0.762(95% CI:0.683-0.842,P=0.000),CTP联合SII、MELD联合SII预测失代偿期肝硬化患者死亡的AUC分别为0.811(95% CI:0.754-0.867,P=0.000)、0.883(95% CI:0.828-0.938,P=0.000),均高于三者单独预测,且以MELD联合SII预测的AUC最高,见图1、表5。

表5 CTP、SII、MELD评分预测失代偿期肝硬化患者死亡的ROC曲线分析结果比较
3 讨论
失代偿期肝硬化患者其肝脏代偿功能已无法满足正常的生理功能,病情进展迅速,可导致急性肝衰竭、肝性脑病、感染、多器官衰竭等多种并发症,患者死亡率高[12]。余锐填等[13]对107例失代偿期肝硬化患者进行回顾性分析,结果发现31.8%在1年内死亡。罗永祥等[14]的研究中此数据为30.6%。翟永贞等[15]对240例失代偿期肝硬化患者随访1年,死亡率为41.67%。本研究对我院378例失代偿期肝硬化患者的研究中,1年死亡率为31.22%,符合上述报道范围。不同研究之间,失代偿期肝硬化患者死亡率存在差异的原因,笔者认为可能有以下几个原因:①纳入患者的基础状况不同,如年龄、合并基础疾病、并发症等多个因素能影响患者预后;②研究的时间不同,随着医学技术的进步,患者的生存情况得到改善;③医疗机构的救治能力、研究样本量的差异等均影响研究结果,小样本量易受偏倚因素的影响。因此,失代偿期肝硬化患者中短期死亡风险高,应引起高度重视。
由于肝硬化病变具有不可逆性,早期预测患者的预后风险,分层进行干预、采取个体化治疗,一定程度上能改善患者预后,延长生存期。CTP是广泛应用的评估肝硬化程度的评分系统,但其预测失代偿期肝硬化患者预后具有较大的局限性[3]:①缺乏对肾功能、肺功能等肝外器官功能的评估;②部分指标主观性强,如腹水、肝性脑病分级;③各分级狭窄,缺乏权重,对治疗方案的指导实用性不强。本研究结果显示,死亡组CTP评分高于存活组,CTP评分升高是失代偿期肝硬化患者死亡的独立危险因素,与梁利民等[16]研究结果相符。但ROC曲线分析显示,CTP评分预测失代偿期肝硬化患者死亡的AUC仅为0.719,提示其预测效能中等,与姚运海等的结果一致(0.718)[17]。
MELD评分最早用于合并门脉高压的肝硬化患者行颈静脉肝内分流术后预后的评估,随着其应用的广泛,以作为美国确定肝移植器官分配优先权的标准[11]。近年来,MELD评分逐渐用于预测肝硬化患者生存期的预测。梁利民等[16]研究显示,MELD评分升高是失代偿期肝硬化患者近中期死亡的独立危险因素,且其预测失代偿期肝硬化患者死亡的AUC(0.862)高于CTP评分(0.817)。Cheng等[18]的研究中,也得到了类似结果,即MELD评分预测乙型肝炎肝硬化患者的短期预后能力高于CTP评分。但也有部分研究认为,MELD评分预测肝硬化患者预后的效能与CTP评分相当,甚至低于CTP评分[17,19]。且既往研究在有报道显示,部分MELD评分较低的肝硬化患者短期死亡的现象[5]。本研究结果显示,MELD评分预测失代偿期肝硬化患者死亡的AUC为0.762,虽然高于CTP评分的预测效能,但预测价值仍为中等。可能原因:①未对门脉高压并发症进行评估;②未涉及失代偿期急性事件的评估;③CTP、MELD评分均未将免疫炎症指标纳入评估体系,而免疫炎症指标与患者预后息息相关[19-21]。
有研究者认为,肝硬化患者存在严重的免疫炎症紊乱,是多种病因导致肝硬化标志性病理改变[22]。不少研究通过炎症指标,如中性粒细胞淋巴细胞比值(neutrophils lymphocytes ratio,NLR)来预测肝硬化患者的预后。Zhang等[23]研究表明,NLR与失代偿期肝硬化患者并发症及30 d死亡风险呈正相关。但单纯免疫炎症反应在失代偿期肝硬化预后的预测中价值有限,不少研究将其与MELD评分联合应用。梁利民等[16]研究显示,MELD评分联合NLR预测代偿期肝硬化患者12个月死亡的AUC高于二者单独预测。陈卉等[19]的研究中,MELD评分、NLR预测代偿期肝硬化患者12个月死亡的AUC分别为0.746、0.739,而二者联合预测的AUC为0.847。但NLR仅仅反应炎症指标,缺乏对免疫-炎症的综合评估。SII是在NLR的基础上增加了血小板,可反映免疫-炎症水平:①中性粒细胞升高不仅能分泌多种炎症因子,加剧组织损伤,且抑制淋巴细胞活性;②血小板参与凝血功能,其值过度升高可能引起凝血功能紊乱[24-25];③淋巴细胞是机体的免疫防御功能的主要执行者,其值降低提示免疫功能减弱、易发生感染。在肝癌患者中,治疗前SII水平与根治术后肝癌患者的治疗效果呈负相关[26]。在肝硬化合并肝癌患者中,术前高水平SII组患者的中位生存期以及1、2、3年累积生存率均低于低SII组,多因素Cox回归分析显示SII组患者的死亡风险是低SII组的6.197倍[7]。在失代偿肝硬化患者中,SII升高组患者的生存时间显著缩短,多因素校正其他影响因素后发现SII升高是失代偿肝硬化患者1年死亡的独立危险因素[14]。目前尚未见MELD评分联合SII预测失代偿肝硬化患者预后的相关研究。本研究结果显示,MELD评分联合SII预测失代偿肝硬化患者死亡的AUC高于二者单独预测,且高于CTP评分联合SII,提示MELD评分联合SII在此类患者的预后评估中有较高的应用价值。
综上所述,MELD、SII升高是失代偿肝硬化患者死亡独立危险因素,二者联合应用预测失代偿肝硬化患者死亡的价值高于CTP评分联合SII。且SII检查方便、费用低廉,且能动态监测,具有较好的临床应用价值。护理人员在对患者进行监测时,监测MELD、SII水平有助于对患者进行分层管理。
