大脑中动脉不同部位急性脑梗死的DKI 表现特点
2021-10-22孙海珍吴亚琳何澈倪红艳尹建忠
孙海珍 吴亚琳 何澈 倪红艳 尹建忠
脑梗死的早期发现和对急性脑梗死病灶及缺血程度的评估,对于治疗方案的选择和预后起着关键作用。扩散加权成像(DWI)是目前临床诊断急性脑梗死最常用的技术,但无法提供水分子扩散的方向信息[1]。扩散峰度成像(diffusion kurtosis imaging,DKI)弥补了上述不足,并且可评估水分子的非高斯扩散特性,其不仅可提供特征性的峰度参数,如轴向扩散峰度(axial kurtosis,AK)、平均扩散峰度(mean kurtosis,MK)、径向扩散峰度(radial kurtosis,RK),还能获得扩散张量成像(diffusion tensor imaging,DTI)的方向性扩散参数,包括轴向扩散率(axial diffusion,AD)、平均扩散率(mean diffusion,MD)、径向扩散率(radial diffusion,RD),较传统扩散成像能更全面地反映组织微结构的变化[2-3]。由于脑组织灰质和白质结构本身的DKI 特征存在较大的不同,且皮质和脑组织深部梗死的血供特点也可能存在不同,因此需要对不同部位脑梗死的DKI 改变特点和最佳的评估参数图进行研究,有助于减少病灶的漏诊及误诊。
本研究旨在评估DKI 各峰度参数与扩散参数在急性脑梗死早期诊断中的价值,比较大脑中动脉供血区不同部位急性脑梗死后DKI 峰度参数的改变特点,以期找到早期诊断各部位脑梗死的优势参数图。
1 资料与方法
1.1 研究对象 回顾性收集2016 年3 月—2019年1 月天津市第一中心医院就诊的患大脑中动脉供血区急性脑梗死的病人共62 例,其中男37 例,女 25 例;年龄 43~71 岁,平均(57.26±6.27)岁;发病至首次 MR 检查时间 10~32 h,平均(19.15±4.05)h。纳入标准:①发病至首次MRI 检查的时间<72 h;②年龄18~80 岁;③梗死病灶位于单侧的大脑中动脉供血区;④影像质量清晰。共纳入62 例病人的84个病灶,根据分布部位将病灶分为3 组,其中皮质组28 个、皮质下白质组25 个、基底节区组31 个(其中2 个病灶位于灰质核团,其余均位于白质)。
1.2 检查方法 采用德国Siemens Trio 3.0 T MRI扫描设备,头部8 通道相控阵线圈。行常规横断面T1WI、T2WI、DWI 扫描,并行 DKI 扫描。扫描参数:b=0、1000、2000s/mm2,20 个方向,TR 3 000ms,TE95ms,层厚5 mm,层间距 1.25 mm,FOV 230 mm×230 mm,矩阵183×384,激励次数2,扫描时间为2 min 10 s。
1.3 图像处理 采用DKE 软件进行数据处理并获得 AK、MK、RK、AD、MD、RD 参数图,将预处理完的参数图导入MRIcron 软件。选取合适的病灶,并在每个病灶显示最大的层面手动勾画ROI。病灶纳入标准:①单发病灶;②多发病灶中,每个部位(皮质、皮质下白质、基底节区)仅选取1 个最大的病灶。排除跨多个部位的病灶。在MK 参数图上尽可能大地勾画ROI,并在健侧的镜像位置勾画相同大小的ROI,然后将ROI 复制到其他参数图。分别测量患侧与健侧的相应参数值,并计算各参数值的变化率:Δ 参数值%=(患侧值-健侧值)/健侧值×100%。所有数据均测量2 次,最终结果取2 次结果平均值。
1.4 统计学方法 采用SPSS 19.0 软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,2 组间比较采用配对t 检验;3 组间比较采用单因素方差分析,组间进一步两两比较采用LSD-t检验。率以百分数(%)表示,采用秩和检验比较Δ 参数值%的差异。P<0.05 表示差异有统计学意义。
2 结果
2.1 病灶及健侧对照区的DKI 参数值比较 与健侧对照区相比,病灶的 AD、MD、RD 值均减低,AK、MK、RK 值均增高(均 P<0.05),见表 1。3 组病灶在AK、MK、RK 参数图上均表现为高信号(图 1)。
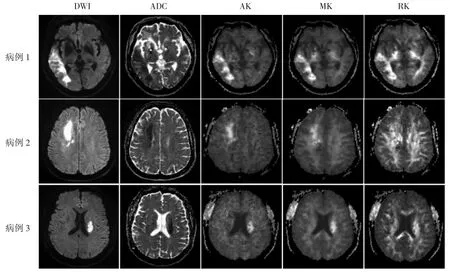
图1 大脑中动脉供血区急性脑梗死的DKI 表现。病例1 男,65 岁,皮质梗死,DWI 上示右侧颞叶呈高信号的急性梗死灶,ADC 图上呈低信号,AK、MK、RK 图上均呈高信号,且信号增高程度基本一致,边缘清晰。病例2 女,58 岁,皮质下白质梗死,DWI 上示右侧半卵圆中心呈高信号的急性梗死灶,ADC 图上呈低信号,AK、MK 图上均呈高信号,RK 图受影像背景本身高信号的影响病灶显示欠清。病例3 男,50岁,基底节区梗死,DWI 上示左侧放射冠呈高信号的急性梗死灶,ADC 上呈低信号,AK、MK、RK 图上均呈高信号,但RK 图上病灶边界欠清。
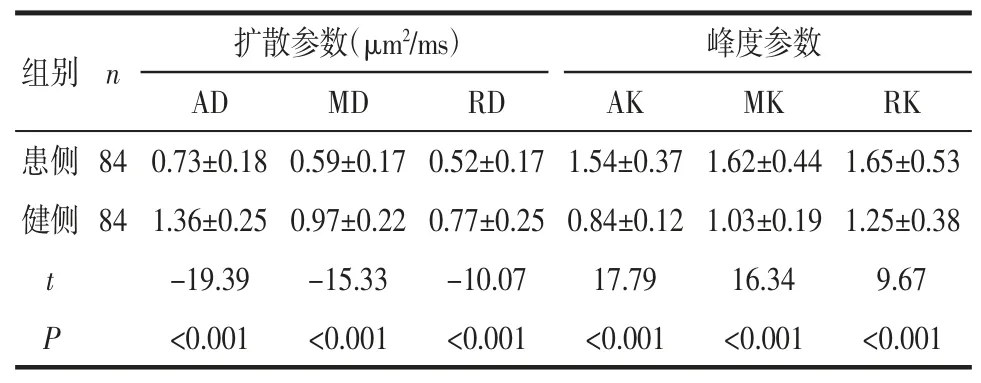
表1 急性脑梗死患侧病灶与健侧对照区的扩散、峰度参数值比较
2.2 病灶的Δ 参数值%比较 病灶的ΔAD%、ΔMD%、ΔRD%、ΔAK%、ΔMK%、ΔRK%分别为-45.05%±15.93%、-38.47%±15.52%、-29.99%±17.73%、87.03%±47.60%、58.66%±34.01%、36.92%±38.89%,差异有统计学意义(H=386.51,P<0.001)。其中,扩散参数的变化率均小于其对应峰度参数的(ZAK-AD=-11.11,P <0.001;ZMK-MD=-11.05,P <0.001;ZRK-RD=-10.30,P<0.001)。
2.3 不同部位健侧对照区峰度参数值比较 3 个部位的健侧对照区AK 值差异均无统计学意义,MK和RK 值间差异有统计学意义(均P<0.05)。其中,皮质下白质组和基底节区组的健侧对照MK、RK 值均高于皮质组的健侧对照区参数值,基底节区组的健侧对照RK 值也高于皮质下白质组的(均P<0.05),见表 2。
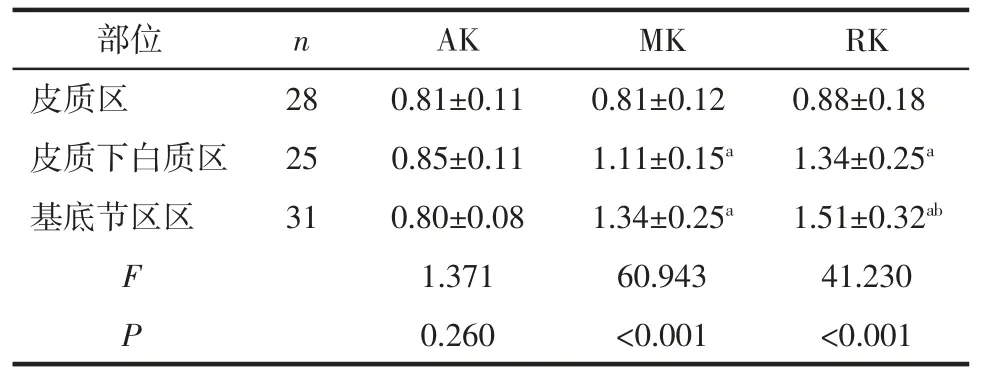
表2 3 个部位的健侧对照区峰度参数值比较
2.4 不同部位病灶间Δ 峰度参数值%比较 皮质、皮质下白质、基底节区病灶的ΔAK%差异具有统计学意义(P<0.05);皮质、皮质下白质、基底节区ΔAK%值逐渐增大(P<0.05);ΔMK%数值亦呈升序分布,但差异无统计学意义(P>0.05);3 组间 ΔRK%的差异无统计学意义(P>0.05),见表 3。
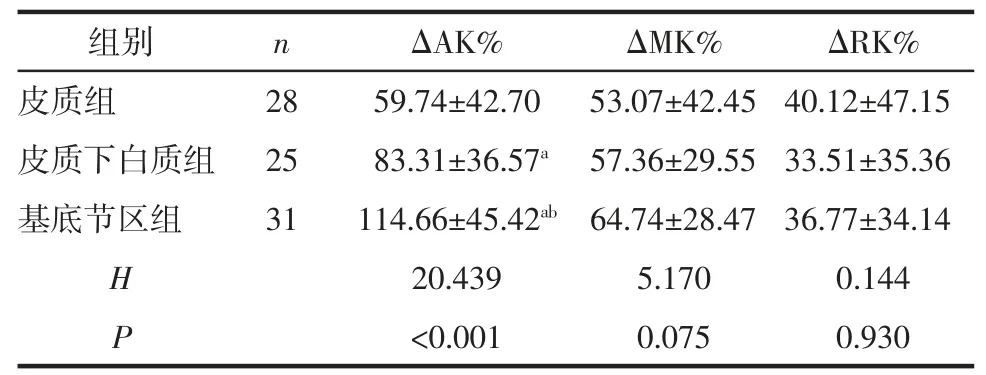
表3 不同部位病灶间Δ 峰度参数值%比较 %
2.5 同一部位病灶中不同Δ 峰度参数值%的比较 皮质组的ΔAK%、ΔMK%、ΔRK%的差异无统计学意义(H=5.08,P=0.079)。皮质下白质组及基底节区组中,ΔAK%、ΔMK%、ΔRK%的差异均具有统计学意义(H皮质下白质组=19.02,P<0.001 ;H基底节区组=42.05,P<0.001)。其中,皮质下白质组的ΔAK%与ΔMK%差异无统计学意义,但均大于ΔRK%(均P<0.05);基底节区组内ΔAK%、ΔMK%、ΔRK%之间的差异均具有统计学意义(均P<0.05),数值呈降序分布(图 2)。
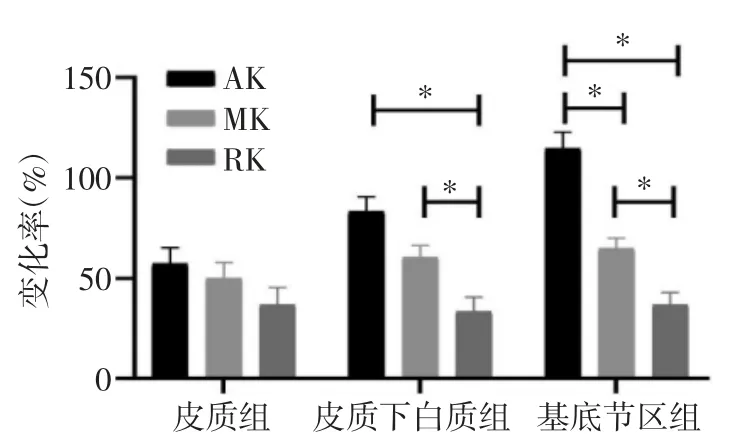
图2 不同部位急性脑梗死AK、MK、RK 百分比变化率比较,*P<0.05。
3 讨论
3.1 扫描方案的选择 DKI 用于急性脑梗死扫描时,扫描时间是关键,应选择合适的b 值及方向数。b 值越高,对水分子扩散受限越敏感;b 值数量越少,成像时间越短。方向数越多,对运动伪影越不敏感,信噪比也越高,但成像时间随之延长[4-5]。Jensen等[6]在脑内水分子扩散的非高斯性定量研究中发现,DKI 扫描至少需要3 个b 值和15 个方向,最大b 值宜在2 000~3 000 s/mm2范围内选取,并推荐采用 3 个 b 值(b=0、1 000、2 000 s/mm2)和 30 个方向的扫描方案,扫描时间为10 min。何等[7]选择了3 个b 值(b=0、1 000、2 000 s/mm2)和 30 个方向推荐方案,并采用多频带EPI DKI(multi-band EPI diffusion kurtosis imaging,m-DKI)与 DWI 识别梗死核心区结果,在不降低信噪比的同时进一步将扫描时间由10 min 缩短至3 min。Yin 等[8]在临床急性脑梗死的研究中使用的扫描方案为同样的3 个b 值和20 个方向,也获得了较为理想的影像质量,其扫描时间仅为2 min 10 s。因此,本研究也选用了3 个b 值(b=0、1 000、2 000 s/mm2)和 20 个方向。
3.2 ROI 参数图的选择 DKI 技术中的峰度参数可以量化真实水分子扩散偏离高斯分布的程度,以此表征水分子扩散受限的程度以及扩散的不均质性,进而反映组织微结构的复杂性及异质性。DKI可以同时得到扩散参数(如AD、MD、RD)及峰度参数(如 AK、MK、RK),其中 MK 为所有方向的平均扩散峰度,无方向依赖性,尤其在白质纤维交叉的区域可以更准确地追踪远端纤维的走行,在描述相对均质的灰质病变时也具有优势。Yin 等[8]在急性脑梗死DKI 与传统扩散成像的随访研究中发现,与急性期MD 及ADC 图所示的病灶范围相比,MK 图上显示的病灶范围更接近于实际的梗死核心区。因此,本研究中选择在MK 图上首先绘制ROI。
3.3 研究的临床意义
3.3.1 DKI 峰度参数与扩散参数的比较分析 本研究在对急性脑梗死Δ 峰度参数%与Δ 扩散参数%的比较中发现,前者较后者显著,而变化率越大越容易检出病灶,提示峰度参数更易发现处于缺血状态的病变组织,与既往研究结果一致[9-10]。但是,皮质与白质间的峰度参数(即AK、MK、RK)在正常情况下即存在差异,因此针对不同部位(皮质、皮质下白质、基底节区)的脑梗死需选择适宜的参数图进行分析,不仅需要对患侧的改变进行评估,健侧的差异也应考虑在内。
3.3.2 不同部位健侧对照区峰度参数值的比较分析 本研究对皮质、皮质下白质、基底节区健侧峰度参数值进行了比较,结果显示各部位健侧对照区的AK 值均无差异,可能是由于AK 参数图的组织间对比度较差,灰白质界限不清,而皮质、皮质下白质的MK 值间存在差异,提示MK 参数图的组织对比度优于AK 图,灰白质界限清晰;皮质、皮质下白质及基底节区的RK 值依次增高,虽具有清晰的灰白质界限,但由图1 可发现RK 参数图在健侧皮质下白质及基底节区本身即呈明显高信号,故在缺血后可能受该部位本身高信号的干扰而影响病灶的检出。
3.3.3 不同部位病灶间Δ 峰度参数值%的比较分析 本研究中对不同病灶的Δ 峰度参数值%进行分析,结果显示皮质组、皮质下白质组、基底节区组病灶的ΔAK%呈依次增大,ΔMK%亦呈升序分布,而ΔRK%无明确分布趋势。由于峰度的变化可以反映组织微结构改变的复杂与异质性,因而Δ 峰度参数值%的变化反映了缺血后皮质下白质和基底节区的组织微结构改变较皮质更为复杂与异质,其中AK、MK 较RK 更容易发现这一特征,这与Zhu 等[11]的研究结果一致。本研究中ΔMK%在3 组间差异无统计学意义,可能与样本量较小有关。
3.3.4 同一部位病灶中不同Δ 峰度参数值%的比较分析 本研究显示皮质病灶中ΔAK%、ΔMK%、ΔRK%无差异,提示AK、MK、RK 检出皮质急性梗死灶的能力是一致的;皮质下白质病灶中ΔAK%与ΔMK%无差异,但均较ΔRK%显著,提示AK、MK 图较RK 图更容易检出皮质下白质急性梗死灶;基底节区病灶中ΔAK%、ΔMK%、ΔRK%依次减小,提示AK 图较MK、RK 图对基底节区梗死病灶的检出能力更强。Guo 等[12]研究发现,皮质、皮质下白质、放射冠等部位梗死灶的 AK、MK、RK 相对值(rAK、rMK、rRK)相比较,皮质、皮质下白质梗死灶的rAK、rMK、rRK 间差异均无统计学意义,而位于放射冠的梗死灶rAK 较rMK、rRK 的变化更为显著,本研究的结果与其基本一致。
3.3.5 不同部位脑梗死优势参数图的选择及机制分析 对于皮质脑梗死,AK、MK 与RK 图检出病灶的能力一致,但AK 图组织间对比度较差,不利于描述病灶的准确位置;另外,皮质主要由神经元的胞体、树突及神经胶质细胞组成,水分子扩散无特定方向,而MK 为所有方向的平均峰度,亦无方向特异性[13]。因此,MK 图更有优势。对于皮质下白质脑梗死,AK、MK 图较RK 图检出病灶的能力更强,其机制可能为,白质主要由轴突和神经胶质细胞构成,而皮质下白质靠近皮质,同时受大脑皮质的长、短穿通支动脉的血液供应,使得缺血后轴突的损伤较轻而表现为低度各向异性;另外,同样受AK 图组织间对比度差及灰白质界限不清的影响,不利于病灶的准确定位。因此,MK 图亦更有优势。对于基底节区脑梗死,AK 图较MK、RK 图检出病灶的能力更强,可能的机制为基底节区主要接受纹状体动脉末支及脑室膜下动脉分支脉络膜动脉的血液供应,吻合支稀疏。本研究基底节区的绝大部分病灶位于白质,其轴突中含大量的线粒体,而线粒体是缺血后产生氧自由基的主要细胞器[14],在梗死后线粒体肿胀、细胞崩解,进而导致严重的轴突损伤,具有高度各向异性。AK 主要反映平行于轴突方向的水分子扩散,因此AK 图更具有优势。
3.4 不足及展望 本研究尚存在一定局限性,仅将脑梗死发生部位分为皮质、皮质下白质及基底节区,未对这3 个部位进一步分析,尤其未对基底节区的病灶,如2 个位于灰质核团的病灶及此部位的白质进行细分。未来在扩大样本量的基础上,将进一步探讨不同脑区DKI 相关参数的改变。
综上,DKI 可提供较传统扩散技术更丰富的参数值,其峰度参数较扩散参数能更容易检出梗死病灶。急性脑梗死后,皮质下白质及基底节区的组织微结构改变较皮质更为复杂,AK、MK 较RK 更有潜力评估不同部位的缺血损伤。对于皮质、皮质下白质的脑梗死,呈低度各向异性,其MK 图对早期诊断更具有优势;而基底节区的脑梗死呈高度各向异性,其AK 图对早期诊断具有优势。
