基于冠状动脉周围脂肪组织影像组学特征及神经网络模型预测冠状动脉狭窄血流动力学严重程度
2021-10-22徐子良文娣娣赵宏亮郑敏文
徐子良 文娣娣 赵宏亮 郑敏文
基于有创冠状动脉造影(invasive coronary angiography,ICA)的血流储备分数(fractional flow reserve,FFR)指标目前已成为评估冠状动脉疾病(coronary artery disease,CAD)血流动力学严重程度的金标准[1-2]。由于FFR 测量费用昂贵且有创,具有潜在的风险,故临床应用受到一定限制。基于冠状动脉CT 血管成像(coronary computed tomography angiography,CCTA) 的冠状动脉周围脂肪组织(pericoronary adipose tissue,PCAT)是一种新型的影像生物学标志物[3-4],PCAT 区域的CT 值与冠状动脉狭窄的血流动力学严重程度之间存在关联[5],但其会随着后续药物治疗而发生变化[6],因此不能作为CAD 诊断的初筛指标[7]。影像组学可以从影像数据中提取大量肉眼无法识别的有用信息,这些信息经过筛选可以用于临床疾病的诊断[8]。相比基于传统临床特征及影像特征构建的模型,基于影像组学特征构建的模型有更高的诊断准确性[9-11]。因此,拟研究PCAT 区域影像组学特征能否预测冠状动脉狭窄的血流动力学严重程度。
1 资料与方法
1.1 一般资料 回顾性收集2013 年6 月—2018年12 月于中国人民解放军空军军医大学西京医院行CCTA 检查及FFR 测量的92 例冠状动脉疾病(coronary artery disease,CAD)病人的临床及影像资料,其中男 66 例,女 26 例;年龄 30~77 岁,平均(58.3±10.3)岁;平均体质量指数(BMI)为(29.4±23.0)kg/m2。排除标准:①有血运重建史者;②患有复杂的先天性心脏病;③CCTA 检查和FFR 测量间隔1 个月以上者;④CCTA 影像质量较差且数据不完整。92 例病人中43 例有高血压,39 例有高血脂,37 例有吸烟史,6 例有家族心脏病史。共计122 支冠状动脉纳入研究,平均FFR 值为0.81±0.08,其中64 支冠状动脉的FFR≤0.80;冠状动脉钙化积分范围 61.2~348.4,中位数为 188.8;CCTA 与 FFR 测量间隔 1~30 d,平均间隔(7.9±5.6)d。
1.2 CCTA 检查 采用西门子Somatom Definition Flash 128 排双源CT 扫描设备。对于心率≥70 次/min的病人,口服50 mg 美托洛尔控制心率。图像采集前2 min 病人舌下含服2.5 mg 硝酸异山梨酯以扩张冠状动脉血管。经肘正中静脉推注碘普罗胺(含碘370 mg/mL,拜耳公司),注射剂量为1 mL/kg 体质量,注射流率5 mL/s,随后以相同流率推注生理盐水40 mL。兴趣区置于主动脉根部,在信号衰减至100 HU 的5 s 后开始采集图像。采用回顾性心电触发螺旋采集,扫描参数:管电压100 kV,参考管电流300 mA,自动管电流调制,机架旋转时间0.28 s/r,螺距 0.17~0.5,z-flying 焦点切片准直 2×128×0.6 mm。图像采集范围从气管分叉处到横膈膜下方2 cm。所有CCTA 图像使用传统的滤过反投影算法重建,使用专为心脏成像设计的中等平滑内核(B26f)。重建层厚0.75 mm、层间距0.5 mm。重建影像传输至Siemens syngo MMWP VE 36A 工作站上进一步评估,采用Agatston 方法自动计算冠状动脉钙化积分。由2 名具有10 年以上工作经验的心血管影像诊断医师在不知道FFR 测量结果的情况下对所有CCTA 影像进行分析,分析结果不一致时2 人共同协商确定。
1.3 FFR 测量 根据美国心脏病学会关于冠状动脉造影的建议,通过标准导管插入术对病人行选择性 ICA 检查。使用 0.014 英寸(1 英寸=25.4 mm)压力传感尖端导丝测量FFR[12]。通过冠状动脉内推注(左冠状动脉80 mg,右冠状动脉40 mg)或静脉内连续输注腺苷(140 mg·kg-·1min-1)诱导充血,并在 FFR测量前向冠状动脉内注射硝酸甘油以扩张冠状动脉。FFR 范围为0~1,FFR≤0.80 表示病变特异性缺血。根据FFR 值将冠状动脉血管分为狭窄组(FFR≤0.8,68 支)和非狭窄组(FFR>0.8,54 支)。
1.4 PCAT 区域定义 PCAT 区域是指2 倍冠状动脉血管直径内,血管壁外周区域CT 值为-190~-30 HU范围内的所有体素。围绕左冠状动脉前降支、左回旋支和右冠状动脉的近端10~50 mm 的节段进行PCAT 区域分割[5]。共计分割出122 处PCAT 区域。
1.5 影像组学特征提取 影像组学特征的提取是在MATLAB 平台上通过自定义脚本实现。从所有PCAT 区域中提取影像组学特征。影像组学特征计算方法参考Aerts 等[8]的研究方法,包括:①一阶统计量特征(强度、均值、陡度等,共计13 个);②形状特征(球度、表面积、体积等,共计6 个);③纹理特征(灰度共生矩阵特征、灰度游程矩阵特征等,共计33 个)。使用三维小波变换对图像进行多分辨力分解,得到8 个小波平面图像。在原始平面(W0)图像及 8 个小波平面(W1-W8)图像上分别提取上述3 类特征,共计提取468 个影像组学特征。所有特征均进行标准化处理(测量数据减去均值并除以标准差)。通过权值推导,在100 次交叉验证里,选取平均累计绝对权值之和位列前10 的影像组学特征作为重要特征。其中一阶统计量特征2个(W0_Standard Deviation、W4_mean),形状特性 1个(W6_surface_area),灰度共生矩阵特征 4 个(W0_constrast_mean、W2_Inverse Difference Normalized_mean、W2_AutoCorrelation_mean、W6_AutoCorrelation_mean),灰度游程矩阵特征3 个(W3_Short Run Emphasis_mean、W3_High Gray Level Run Emphasis_mean、W7_LongRunHighGrayLevelEmphasis_mean)。
1.6 3 种预测模型构建
1.6.1 神经网络模型 使用神经网络算法从PCAT影像组学特征中提取有用特征,构建冠状动脉狭窄预测模型。根据输入特征的数量构建一个5 层神经网络。其输入层以PCAT 影像组学特征作为输入;神经网络最终提取特征数量为16;输出层节点数目为2(表示血管狭窄缺血的概率)。
1.6.2 传统统计学模型和最小绝对值收敛与选择算子模型 通过MATLAB 平台上自定义脚本构建传统统计学模型和最小绝对值收敛与选择算子(least absolute shrinkage and selection operator,LASSO)模型。①传统统计模型。使用单因素分析从所有影像组学特征中选出在2 组冠状动脉血管中(狭窄与不狭窄)差异有统计学意义的特征,然后利用这些特征构建多元逻辑回归模型,计算相应模型指标。②LASSO 模型。使用LASSO 回归在2 组冠状动脉血管中选择重要的影像组学特征,然后利用这些特征构建逻辑回归模型。
1.7 神经网络模型的训练流程 在Python 3.5 平台上采用Tensorflow 软件包自定义脚本实现神经网络模型的训练与测试。采用深度置信网络(deep belief network,DBN)的权值训练方式对神经网络的权值进行初始化,然后使用真实的冠状动脉狭窄标签对神经网络进行微调。具体步骤如下:①采用限制玻尔兹曼机(restricted boltzmann machine,RBM)的训练方式逐层初始化神经网络各层之间的权值。②将真实冠状动脉狭窄标签与网络输出层对接,微调神经网络的权值,完成网络的训练。神经网络训练流程示意图见图1。微调过程中,最大迭代次数设置为200 次,初始学习率设置为1e-3,且每50 次迭代,学习率除以10。为克服各分组样本数量不匹配问题,使用加权损失函数[13]作为神经网络的损失函数。采用Adam 更新算法对网络权值进行更新,其一阶矩和二阶矩的指数衰减率分别设置为0.9 和0.999,各节点激活函数为Sigmoid 函数。模型训练终止条件包括:①达到最大迭代次数;②连续5 次迭代,测试集损失单调升高(过拟合);③连续5 次迭代,测试集损失的变化绝对值不超过1e-5(饱和)。122 支血管按4∶1 的比例分为训练集和测试集,即96 支血管用于训练,26 支血管用于测试。为了克服随机分组效应对结果造成的影响,上述过程重复100 次,每一次都重新对所有血管进行随机分组。
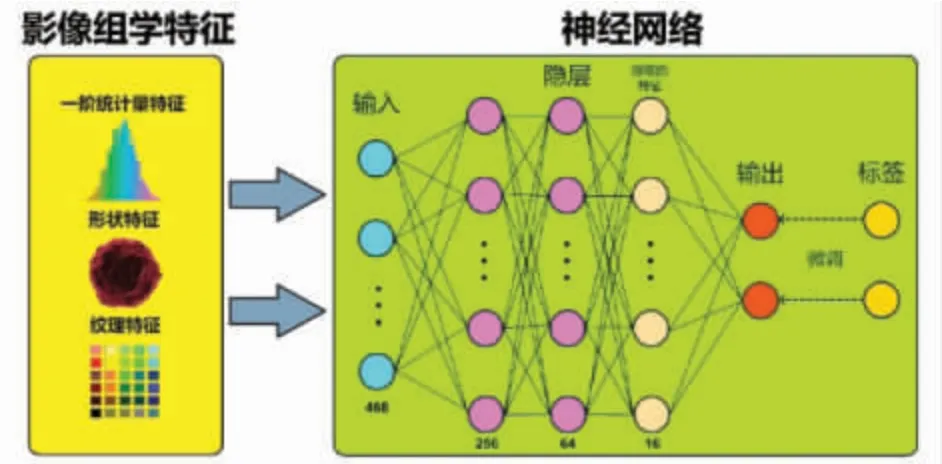
图1 神经网络训练流程示意图
1.8 统计学方法 采用SPSS 26.0 软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,2 组间比较采用独立样本t 检验。采用Pearson相关进行相关性分析。采用受试者操作特征(ROC)曲线评估模型预测冠状动脉狭窄的性能,并计算准确度、敏感度、特异度及ROC 曲线下面积(AUC)。P<0.05 为差异有统计学意义。
2 结果
2.1 3 种预测模型的性能比较 3 种预测模型中,神经网络模型的预测效能最高,其准确度、敏感度、特异度和AUC 分别为81.19%、81.23%、81.16%和0.781 3(0.773 8~0.788 8)。详见表 1。

表1 3 种冠状动脉狭窄预测模型的性能
2.2 神经网络特征、原始影像组学特征与真实标签的相关性分析 16 个神经网络特征与真实冠状动脉狭窄标签的相关性 [最大绝对相关系数(r最大)=0.683 8,P<0.001,平均绝对相关系数(r平均)=0.261 1]高于原始影像组学特征与真实标签的相关性(r最大=0.238 9,P=0.008 和 r平均=0.090 5)。
2.3 狭窄组与非狭窄组重要影像组学特征比较 狭窄组的W6_surface_area 高于非狭窄组,而W6_Auto Correlation_mean 低于非狭窄组(均 P<0.05),其余特征差异均无统计学意义(均P>0.05),见表2。

表2 狭窄组与非狭窄组重要影像组学特征比较
3 讨论
3.1 神经网络在特征运用上的优势 传统统计学模型通常以2 组间是否存在差异为标准筛选特征,模型的运算方法并没有考虑到各个特征之间的联系,所提取的特征通常具有割裂性,因而无法很好地配合完成冠状动脉狭窄的预测,模型性能不佳。采用目前主流特征降维方法的LASSO 模型则在一定程度上克服了这一缺陷,其选择特征时会考虑特征之间的联系,因而构建出来的冠状动脉狭窄预测模型性能优于传统统计学模型。虽然特征降维方法考虑了输入特征之间的信息,并从中选择出配合程度最好的那些特征,用于完成特定的任务,但是与传统统计方法一样,均要舍弃一部分“无用”的特征。这些“无用”的特征虽然在组间的差异可能无统计学意义或者对模型贡献不及其他特征,但是其对任务的完成并非完全没有作用。神经网络模型利用其本身的复杂网络映射,能够很好地克服上述缺陷。本研究通过提取输入层与第一隐层之间(神经网络前两层)的权值发现,对于所有输入的影像组学特征,其累计绝对权值之和并没有十分大的差距,这说明神经网络充分利用了每一个输入的影像组学特征。本研究对比了3 种预测模型,结果也显示使用神经网络方法所构建的冠状动脉狭窄预测模型的预测性能最佳。
3.2 神经网络在特征融合上的优势 传统统计学方法(单因素分析降维+多元逻辑回归)和目前主流的降维+机器学习方法(例如本研究所使用LASSO降维+逻辑归回)虽然在一定程度上可以构建出相对较好的模型,但是其本质还是利用挑选出来的特征构建模型,并没有对其进行信息整合。神经网络会通过隐层对原始输入影像组学特征进行筛选及融合,再借由输出层完成对隐层最后一层的映射,完成模型的构建。本研究使用sigmoid 函数作为神经网络的激活函数,因此完成了集特征融合和逻辑回归为一体的模型构建过程。本研究对原始影像组学特征进行融合,结果显示16 个神经网络特征与真实冠状动脉狭窄标签的相关性明显高于各PCAT影像组学特征与标签的相关性,这充分表明神经网络模型对输入特征具有极佳的融合能力。
3.3 重要影像组学特征分析 本研究通过神经网络权值递推发现,10 个影像组学特征对神经网络模型的贡献最大(100 次交叉验证里,平均累计绝对权值之和位列前10)。灰度共生矩阵特征能够反映特定方向上PCAT 组织之间的空间变化关系,而灰度游程矩阵特征能够反映特定方向上PCAT 组织变化的一致性情况。在这10 个影像组学特征里,PCAT在小波层面映射后的特征居多(8 个),且其中7 个为纹理特征。这些结果表明,相比于原始影像层面,PCAT 在小波层面纹理上的差异能够更好地反映PCAT 的异质性变化。因此,这10 个影像组学特征也许可以作为预测冠状动脉是否缺血的关键性特征,应当予以重视。在这些重要特征里,有2 个小波层面的特征在狭窄组与非狭窄组之间存在差异,分别是 W6_surface_area 和 W6_Auto Correlation_mean。W6 通常反映PCAT 内部CT 值的高频变化的部分,狭窄组W6 的PCAT 形状特征表面积显著大于非狭窄组,而纹理自相关程度显著低于非狭窄组,表明狭窄组PCAT 分布的不均匀程度要大于非狭窄组。上述研究结果表明冠状动脉狭窄可能会引发其周围脂肪组织的分布发生变化,因此PCAT 的分布情况或许可以作为判断冠状动脉是否狭窄的重要依据。狭窄组与非狭窄组重要影像组学特征比较结果表明,2 组间存在差异的“有用”特征并不一定会对模型有很大贡献,而是那些2 组间不存在差异的“无用”特征往往会对模型有一定的贡献,这些结果进一步体现出神经网络相较于传统统计方法的优势。
本研究尚存在一定局限性:首先,研究数据均来自同一中心,因此所提取的神经网络特征的泛化性需要进一步通过其他中心的数据进行验证;其次,研究的样本量不足,模型存在一定的过拟合问题。今后可以在研究中引入多中心数据并增加病例来进一步分析。
总之,本研究采用神经网络的方法,以PCAT 区域影像组学特征为输入,构建了冠状动脉狭窄预测模型。结果表明,以影像组学特征为输入的神经网络模型可以很好地预测冠状动脉狭窄,且预测性能明显优于传统统计学方法及LASSO 方法。其中10个PCAT 区域影像组学特征或许在预测冠状动脉狭窄的血流动力学方面具有重要意义。
