食品中单核细胞增生李斯特氏菌检测能力验证结果与分析*
2021-10-21王利刚周正海付莎莉费云滟
赵 博 王利刚 张 婧 周正海 陈 欣 付莎莉 费云滟 吴 丹
(重庆市食品药品检验检测研究院,重庆 401123)
单核细胞增生李斯特氏菌(Listeria monocytogenes)属李斯特氏菌属,是人类常见的食源性致病菌,该菌广泛存在于自然界,很容易污染食品,其中肉制品、奶与奶制品、水产品、蔬菜等更容易受单核细胞增生李斯特氏菌污染。单核细胞增生李斯特氏菌具有较强的致病性,感染后可导致败血症、脑膜炎、孕妇流产等症状,公共健康危害极为严重,我国食品安全国家标准中对其限量进行了严格的规定。能力验证作为实验室常用的质量控制手段,可以确定实验室某些项目的检测能力,有助于提高实验室检验水平、知名度和信任度。许多检验机构会根据自身情况,定期参加相关机构组织的能力验证,以保持检验机构的检验能力。为验证本实验室食品中单核细胞增生李斯特氏菌的检测能力保持情况,参加了2020 年中国检验检疫科学研究院测试评估中心组织的ACAS-PT903 食品中单核细胞增生李斯特氏菌检测能力验证,现将本次能力验证的过程、结果以及其中采用的操作进行总结分析,以期能够更好地指导今后的检验工作。
1 材料与方法
1.1 参试样品来源
食品中单核细胞增生李斯特氏菌检测能力验证样品,由中国检验检疫科学研究院测试评估中心提供,本次能力验证计划编号为ACAS-PT903(2020),共2 个样品,样品编号分别为20-Y466、20-Y863。
1.2 培养基及试剂
李氏增菌肉汤(LB)、PALCAM 琼脂、李斯特氏菌显色培养基、含0.6%酵母浸膏的胰酪胨大豆肉汤(TSB-YE)、含0.6%酵母浸膏的胰酪胨大豆琼脂(TSA-YE)、木糖发酵管、鼠李糖发酵管等相关配套试剂,产自北京陆桥技术股份有限公司;API Listeria 李斯特菌属鉴定试剂盒、VITEK 2 compact革兰氏阳性细菌鉴定卡,产自法国生物梅里埃公司;BAX System PCR Assay L.monocytogenes 试剂盒,产自美国杜邦公司。
1.3 仪器设备
Climacell 恒温培养箱,德国MMM 公司;VITEK 2 compact 全自动微生物鉴定系统,法国生物梅里埃公司;BAX system Q7 全自动病原微生物检测系统,美国杜邦公司。
1.4 试验方法
根据ACAS-PT903(2020)食品中单核细胞增生李斯特氏菌检测能力验证参试指导书要求对2 个样品进行单核细胞增生李斯特氏菌定性检验,检验依据为《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验》(GB 4789.30—2016第一法)。
1.4.1 增菌
样品开启后,立即加入5 mL 稀释液进行水化,待溶解后,吸出放入无菌袋中,再反复用余下的稀释液清洗西林瓶内壁,清洗液倒入上述无菌袋中,此溶液即为待测样品原液。
以无菌操作取样品25 mL 加入到含有225 mL LB1 增菌液的均质袋中,在拍击式均质器上连续均质1 min。于30 ℃条件下培养24 h,移取0.1 mL,转种于10 mL LB2 增菌液内,于30 ℃条件下培养24 h。
1.4.2 BAX Q7 分子方法跟踪检测
取待测样品原液1 mL 接种于含0.6%酵母浸膏的胰酪胨大豆肉汤(TSB-YE),30 ℃培养24 h 后,取培养物0.1 mL 接种于5 mL 营养肉汤,36 ℃培养18 h;分别取0.1 mL LB1和LB2增菌液的培养物接种于5 mL 营养肉汤,36 ℃培养18 h。
分别移取5 μL 以上培养物至盛有200 μL 裂解液的裂解管中,置于金属浴孵育器中,孵育程序为55 ℃60 min,95 ℃10 min,4 ℃冷却5 min。移取50 μL 裂解物于PCR 管,放入BAX System Q7 全自动病原微生物检测系统,选择单核细胞增生李斯特氏菌程序进行检测。
1.4.3 分离
取LB2二次增菌液划线接种于李斯特氏菌显色平板和PALCAM 琼脂平板,36 ℃培养48 h,观察各个平板上生长的菌落。
1.4.4 初筛
从李斯特氏菌显色平板和PALCAM琼脂平板上分别挑取3~5 个典型或可疑菌落,分别接种于木糖、鼠李糖发酵管,36 ℃培养24 h,同时在TSA-YE 平板上划线,36 ℃培养18 h,选择木糖阴性、鼠李糖阳性的纯培养物继续进行鉴定。
1.4.5 鉴定
对1.4.4 中初筛可疑培养物分别进行染色镜检,并采用API Listeria 李斯特菌属鉴定试剂盒和VITEK 2 compact 革兰氏阳性细菌鉴定卡进行鉴定。
2 结果与分析
2.1 增菌与分子方法跟踪检测情况
经培养,20-Y466、20-Y8632 个样品的LB1、LB2培养物均浑浊,说明LB1、LB2培养基中均有微生物生长。BAX Q7 分子方法跟踪检测情况见下页图1。由图1 可知,20-Y466、20-Y8632 个样品的原液培养物、LB1和LB2增菌液的培养物均检出单核细胞增生李斯特氏菌。

图1 原液培养物、LB1 和LB2 增菌液的培养物BAX system Q7 检测结果
2.2 选择性分离与初筛情况
20-Y466、20-Y8632 个样品的LB2 培养物划线分离后,在李斯特氏菌显色平板和PALCAM平板上均存在符合标准或培养基产品说明书描述的典型菌落,菌落形态见下页表1。由表1 可知,20-Y466、20-Y8632 个样品挑取的典型菌落木糖发酵结果均为阴性,鼠李糖发酵结果均为阳性,符合单核细胞增生李斯特氏菌生化特性。
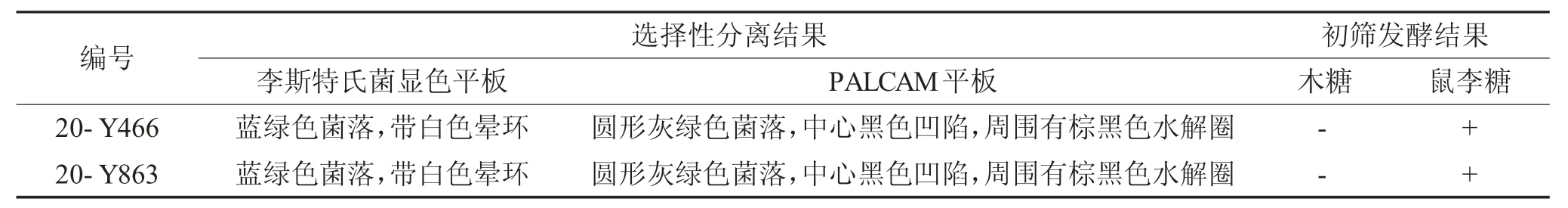
表1 选择分离生长与初筛发酵结果
2.3 鉴定结果
20-Y466、20-Y863 典型菌落的API Listeria 李斯特菌属鉴定试剂盒鉴定结果见表2。根据产品使用说明书可判定20-Y466、20-Y863 典型菌落均为单核细胞增生李斯特氏菌。

表2 API Listeria 李斯特菌属鉴定试剂盒鉴定结果
20-Y466、20-Y863 典型菌落使用VITEK 2 compact 革兰氏阳性细菌鉴定卡进行鉴定,检验结果显示典型菌落均为单核细胞增生李斯特氏菌,详见表3。

表3 VITEK 2 compact 全自动微生物鉴定系统鉴定结果
2.4 筛检与鉴定情况比较
将筛检、分离、鉴定的结果汇总、比较,详见表4。可以看出,20-Y466、20-Y8632 个样品筛检、分离、鉴定结果的指向一致,均显示样品中存在单核细胞增生李斯特氏菌。因此,判定20-Y466、20-Y8632 个样品均检出单核细胞增生李斯特氏菌。

表4 筛检、分离、鉴定的结果汇总
3 讨论
本次比对中,在按照标准步骤检验的同时采用BAX Q7 对样品的原液培养物、LB1和LB2增菌液的培养物进行筛检,检验周期较短,几小时即可获得检验结果,本试验采用跟踪检测的方式可以避免假阳性。在对原液进行筛检时,先使用含0.6%酵母浸膏的胰酪胨大豆肉汤(TSB-YE)对其进行培养,此目的在于对样品中可能受损的单核细胞增生李斯特氏菌进行复苏、复壮以避免出现假阴性结果。另外,LB1、LB2培养基中含有盐酸吖啶黄,如果直接使用LB1、LB2增菌液进行BAX Q7 检测,会影响其荧光信号的检测,造成试验无效。
李斯特氏菌显色平板中的呈色物质底物可与李斯特氏菌具有的酶发生特异性反应,水解底物,释放出显色基团。在平板上,单核细胞增生李斯特氏菌、英诺克李斯特氏菌、绵羊李斯特氏菌呈现蓝绿色菌落,但单核细胞增生李斯特氏菌和绵羊李斯特氏菌的菌落周围有一不透明的白色晕圈。在PALCAM平板上,单核细胞增生李斯特氏菌和英诺克李斯特氏菌均能水解七叶苷并与铁离子反应形成黑色的6,7-二羟基香豆素。因此,李斯特氏菌显色平板和PALCAM平板选择性分离培养的结果并不能直接鉴定单核细胞增生李斯特氏菌。
API Listeria 李斯特菌属鉴定试剂盒作为一款商业化鉴定系统,具有较好的鉴定效果,可以缩短常规生化鉴定所需时间,18 h~24 h 即可获得鉴定结果。在一项单核细胞增生性李斯特菌和英诺克李斯特氏菌的鉴定试验中,利用该系统97.7%的单核细胞增生性李斯特菌与99.4%的英诺克李斯特氏菌得到了正确的鉴定和分型。本次能力验证中,使用该系统获得了较好的鉴定结果,10 项生化反应指标均符合单核细胞增生性李斯特菌的特征。
VITEK 2 compact 自动微生物鉴定系统常用于微生物的鉴定,且符合我国食品微生物学检验相关标准的要求。在一项覆盖了20 个美国官方、第三方检测实验室的评价活动中,采用GP 鉴定卡对720株革兰氏阳性菌进行分析,其中714 株鉴定正确,0 株鉴定错误,0 株未鉴定,6 株未鉴定为革兰氏阳性菌(由于革兰氏染色观察错误导致)。因此VITEK 2 compact 自动微生物鉴定系统是一种可靠的、快速的生化鉴定方法,且可以更好地排除人员操作对试验结果的影响。
随着检验技术的不断革新,分子、色谱等方法也被用于李斯特氏菌的检验,如基于分子手段的PCR 技术,有学者建立了单增李斯特菌实时荧光定量PCR 检测方法,也有在此技术上进行扩展和联用的研究,均有较好的效果。再如,有学者采用气相色谱-质谱联用技术对李斯特属5 种细菌的挥发性代谢产物进行研究,还有学者采用高分辨率热裂解气相色谱质谱技术建立了检测农产品中单核细胞增生性李斯特菌的方法。另外,基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)可以快速、可靠区分李斯特菌,具有很好的稳定性和重复性,且该方法已经形成推荐性国家标准。但实际工作中,由于设备昂贵、耗材成本高、人员要求素质高、数据库覆盖不全等因素,以上方法尚不能完全普及。
本次食品中单核细胞增生李斯特氏菌的检测能力验证的参与和实施,有效地检查了实验室的单核细胞增生李斯特氏菌检测能力,多种检验手段的使用也验证了实验人员的基本素质和职业素养,保证和提升了实验室的检验能力和质量控制水平,对巩固实验室能力有着积极的作用。
