去铁胺通过抑制氧化应激反应促进小鼠深部组织压力性损伤创面愈合*
2021-10-20张子锐张亚萍郭景琳
张子锐, 张亚萍, 郭景琳, 山 慧, 张 菊△
(1青岛大学护理学院,山东青岛 260001;2山东大学第二附院医院,山东济南 250000)
随着社会发展及人口老龄化现象日益凸显,慢性伤口已经成为危害公共健康的主要疾病,包括压力性损伤、下肢动静脉溃疡和糖尿病足溃疡等[1],其中,压力性损伤又称压疮、褥疮,其医疗成本消耗在国内位居第3 位。深部组织压力性损伤(deep tissue pressure injury,DTPI)是一类严重的压力性损伤,因难愈合、进展快和易复发成为防治的重点和难点[2-3],是临床医护工作中亟需解决的难题。
压力性损伤是由压力因素为主导驱动的局部微循环紊乱和重复缺血/再灌注(ischemia/reperfusion,I/R)损伤。I/R 损伤引起局部组织血管内皮损伤、炎症反应及氧化应激,产生大量活性氧(reactive oxygen species,ROS)[4-5]。在诸多I/R 损伤性疾病中存在铁超载[6-7]。铁是一种对细胞和生物体至关重要的基本微量元素,具有独特的电化学性质,过量的游离铁会引起氧化应激,与多种代谢性疾病、肿瘤和慢性伤口的发病机制密切相关[8]。去铁胺(deferoxamine,DFO)是美国食品药品监督管理局(Food and Drug Administration,FDA)批准的一种小分子铁络合剂,对游离铁离子具有高度的稳定性、特异性和选择性[9]。研究显示,局部使用DFO 可有效地抑制ROS的产生,具有抗氧化作用[10]。此外,DFO 可诱导慢性低氧环境中低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)的稳定表达,并刺激新生毛细血管再生,促进伤口愈合[11]。
基于此,本研究拟通过构建小鼠DTPI 模型,探讨DTPI 中铁离子的含量,以及DFO 的治疗效果和作用机制,为治疗慢性伤口提供参考资料。
材 料 和 方 法
1 动物
SPF 级雄性C57BL/6 小鼠,体重(20±2)g,6~8 周龄,购自华富康生物科技有限公司(北京)。所有动物实验经青岛大学附属医院医学实验动物伦理委员会批准(QYFY WZLL 25887),实验动物许可证号为SCXK(鲁)2019-0003。人永生化角质形成细胞(human immortalized keratinocytes)HaCaT 由协和医学院药物所惠赠。
2 主要试剂
DFO 购 于Sigma-Aldrich;Cell Counting Kit-8(CCK-8)试剂盒购于美仑生物科技(大连)有限公司;ROS 检测试剂盒(WLA070a)购自万类生物科技(沈阳)有限公司;苏木精购自索莱宝科技(北京)有限公司;曙红Y(醇溶性)购自生工生物工程(上海)有限公司;普鲁士蓝染色试剂盒购于索莱宝科技(北京)有限公司;Masson 三色染色试剂盒购于雷根生物技术(北京)有限公司;Taq PCR Master Mix 试剂盒购于百泰克生物科技(北京)有限公司;鼠抗HIF-1α 抗体、鼠抗血管内皮生长因子α(vascular endothelial growth factor-α,VEGF-α)抗体、鼠抗基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1)抗体和鼠抗肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抗体均购于万类生物科技(沈阳)有限公司;山羊抗鼠IgG Ⅱ抗(Proteintech)。
3 主要仪器
BX53 正置显微镜购自Olympus;荧光定量PCR仪购自BIONEER;ELx 800 全自动酶标仪购自BioTek。
4 主要方法
4.1 CCK-8 法检测HaCaT 细胞活力 将培养的处于对数生长期的HaCaT 细胞株接种于96 孔板中(每孔5×103个),每组设6个复孔,细胞贴壁24 h后,每孔加入100 μL 含不同药物的培养液,分别于24 h,48 h和72 h 弃去含药培养液,每孔加入含有10% CCK-8的DMEM 培养液,37 ℃恒温培养箱避光孵育30 min,置于酶标仪450 nm处读取吸度光(A)值。
4.2 HaCaT 细胞内ROS 的含量 将HaCaT 细胞以每孔6×104个的密度接种于96 孔板24 h。分别加入不同浓度(100 μmol/L、500 μmol/L 和1 mmol/L)DFO预处理1 h 或2 h,然后加入4%多聚甲醛固定15 min,PBS 清洗3 次,滴加ROS 探针反应液,37 ℃孵育30 min,PBS 漂洗,封片,最后,使用荧光显微镜(BX53,OLUMPUS)观察荧光,最大激发波长为485 nm,发射光谱为525 nm。
4.3 DTPI 模型的构建与分组 选用C57BL/6 雄性小鼠,根据文献[12-14],去除其背部和腹部毛发,在坐骨棘突的背部和腹部两侧各使用磁铁(直径12 mm,厚度5 mm,质量2.4 g,表面磁通密度1 000 Gs)施加压力12 h,之后将磁铁卸下,缓冲12 h。在施加压力期间,小鼠进食正常,行动自由。将小鼠随机分为假手术(sham)组、模型(model)组、DFO 低浓度(2 g/L)组和DFO高浓度(20 g/L)组,每组6只小鼠。DTPI模型建立完成后第1、3、5、7、9、11 和13 天分别皮下注射给药,每天1次。
4.4 电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)检测DTPI 肌肉组织中铁含量 颈椎脱臼处死小鼠后,取20 mg小鼠肌肉组织至25 mL 消解容器中,加入8 mL 王水和2 mL H2O2水,使用石墨加热板120~200 ℃消解60 min至样品完全消解,冷却至室温,取出,置于电热消解器中去除多余氮氧化合物,冷却后过滤定容至10 mL 量瓶中。使用ICP-MS检测匀浆组织中铁离子的含量。4.5 普鲁士蓝染色 分别在第1 和7 天取材,将皮肤肌肉组织标本置于4%多聚甲醛溶液中固定48 h。梯度乙醇脱水:将冲洗后的标本分别置于75%、85%、95%及100%乙醇中24 h。使用纯二甲苯透明,总时间不超过4 h。过滤包埋:弃二甲苯,石蜡包埋,组织切片机切片,厚度为5 μm,使用普鲁士蓝染色后将切片置于37 ℃蒸馏水浸泡5 min,洗去表面结晶物质(白色沉淀物)后行HE 染色。最后封片,镜检。400倍显微镜下观察,每张切片用随机数字表法取5个不重叠视野,用Image Pro Plus 6.0软件计算其平均吸光度值,进行分析。
4.6 创面收缩率 在损伤后的0~14 d中,相同条件下使用数码相机拍摄局部伤口,将第3 天伤口面积设置为1(设为参考点),记录不同时点的伤口面积,使用Image-Pro Plus 6.0 软件按下列公式计算伤口收缩率。伤口收缩率(%)=(第3 天伤口面积-特定时点伤口面积)/第3 天伤口面积×100%。若伤口收缩率为负值,表明伤口面积增加;若伤口收缩率为正值,表明伤口面积减小。
4.7 HE 染色和Masson 染色 取创面组织(1.5 cm×1.5 cm),4%多聚甲醛固定24 h,梯度乙醇脱水,二甲苯使其透明,石蜡包埋组织,切片厚度为5 μm,染色,脱水,透明,封片后,显微镜观察HE 染色和Masson染色组织切片。每张切片用随机数字表法取5个不重叠视野,用Image-Pro Plus 6.0 软件计算其平均吸光度值,进行分析。
4.8 免疫组化染色 取创面组织于4%多聚甲醛中固定,于70%乙醇中梯度脱水,石蜡包埋,使用石蜡块切片机(RM2235)切成5 μm 厚切片。用CD31 抗体染色(稀释1∶500)进行免疫组化分析。最后,使用DP73显微摄影成像系统(OLUMPUS)采集图像数据。4.9 Western blot 按照标准的实验室规程提取总蛋白。行8%~12%SDS-PAGE分离蛋白,然后转移到硝酸纤维素膜上。Ⅰ抗分别为抗VEGF-α(稀释比1∶100)、HIF-1α(稀释比1∶100)、SDF-1(稀释比1∶500)、TNF-α(稀释比1∶500)和β-actin(稀释比1∶100)抗体,Ⅱ抗为山羊抗兔IgG-HRP(稀释比1∶5 000),使用Western blot 检测软件(Gel-Pro Analyzer)检测蛋白表达。
5 统计学处理
统计分析采用SPSS 25.0统计软件进行分析,组间比较采用单因素方差分析和Tukey 检验,使用GraphPad Prism 5.0 软件对平均值进行比较。重复测量数据用均数±标准差(mean±SD)表示。以P<0.05为差异有统计学意义。
结 果
1 DTPI肌肉组织中铁离子含量增高
采用ICP-MS检测DTPI肌肉组织中铁离子含量,ICP-MS测量的标准品和测试样品的质谱图及结果显示,正常组铁离子含量为(41.57±4.48)mg/L。在伤口形成第1天时,模型组和DFO(20 g/L)组铁离子含量分别为(63.21±4.48)mg/L和(48.83±2.89)mg/L;第7天时,模型组和DFO(20 g/L)组铁离子含量分别为(88.91±2.81)mg/L和(52.20±3.61)mg/L,模型组肌肉组织中铁离子含量较正常组显著升高(P<0.01),DFO(20 g/L)组铁离子含量相比模型组显著降低(P<0.05,P<0.01),见图1A、表1。普鲁士蓝染色结果显示,蓝色区域集中于模型组的肌肉区,真皮和表皮内少见,在第1 天时,模型组与DFO(20 g/L)组均无明显铁沉积现象;第7 天时,模型组出现了明显的铁沉积现象;相反,DFO(20 g/L)组中铁沉积数量较模型组有显著减少,见图1B。
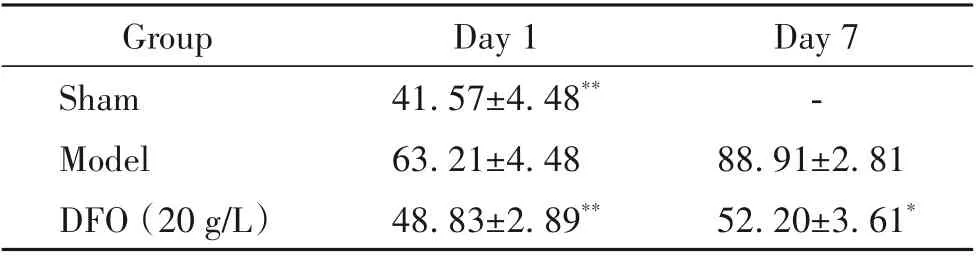
表1 小鼠DTPI肌肉组织铁含量测定Table 1. Determination of iron content in mouse muscle tissues(mg/L. Mean±SD. n=6)
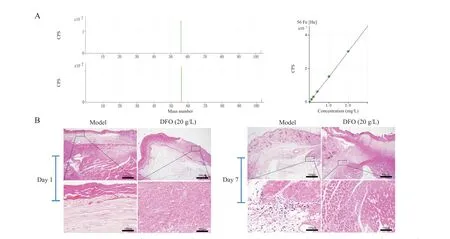
Figure 1. Mass spectra of standard samples(upper left in A)and test samples(lower left in A),the standard curve(right in A),and local iron deposition(B)in muscle tissues of C57BL/6 mice on day 1 and day 7(Prussian blue staining,scale bar=500 or 100 μm). Iron ion"accumulation"phenomenon was obviously observed in model group.图1 标准品和检测样品的质谱图、标准曲线及普鲁士蓝染色评估局部铁沉积
2 DFO对HaCaT细胞无显著毒性
CCK-8实验结果表明,不同浓度的DFO对HaCaT细胞活力均无显著影响,细胞状态良好,见表2。

表2 CCK-8法检测不同浓度DFO对HaCaT细胞活力的影响Table 2. The effects of different concentrations of DFO on viability of HaCaT cells were detected by CCK-8 assay(Mean±SD. n=6)
3 DFO抑制HaCaT细胞中ROS的产生
红色的荧光强度代表的是HaCaT 细胞内ROS的含量。结果表明DFO 可显著抑制HaCaT 细胞内ROS的产生,红色荧光强度的减弱证明了这一点,见图2A。不同浓度DFO 预处理1 h 和2 h 后,结果显示相比于模型组,DFO 对HaCaT 细胞内ROS 的生成具有显著抑制作用(P<0.01),且具有浓度依赖性,其中1 000 μmol/L的DFO抑制效果最好,见图2B。

Figure 2. Inhibitory effect of DFO on ROS production in HaCaT cells. Red fluorescence intensity represents the ROS level in HaCaT cells. Mean±SD. n=6.**P<0.01 vs control group.图2 DFO抑制HaCaT细胞内ROS的产生
4 DFO促进DTPI伤口愈合
DFO 组创面愈合速度与模型组相比显著加快。在创面早期,DFO 组的创面初始面积小于对照组;第7 天,模型组的创面面积为(106±1.25)%,DFO(2 g/L)组和DFO(20 g/L)组的创面面积分别为(69.0±2.45)%和(77.3±2.62)%,DFO组较模型组创面面积显著降低(P<0.05);第14 天,模型组愈合面积为(73.0±1.25)%,DFO(2 g/L)组和DFO(20 g/L)组的创面面积分别为(45.0±1.60)%和(39.0±1.20)%。结果表明,DFO 组在14 d 内伤口愈合率达到约60%以上,然而,模型组在14 d 内未完全愈合,伤口愈合率为(28.0±1.25)%。见图3。
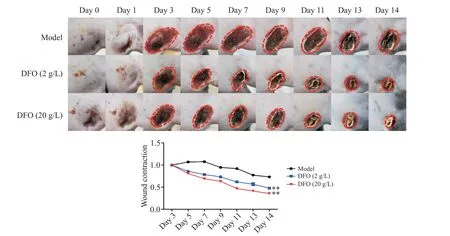
Figure 3. Wound healing after DTPI in C57BL/6 mice. The representative pictures of the three groups record the healing process at different time points. Each image is a square with an actual distance of 1.5 cm. Wound healing results were presented as the percentages of initial area. Mean±SD. n=6.**P<0.01 vs model group.图3 C57BL/6小鼠DTPI后的伤口愈合情况
组织学结果显示,第7 天,DFO 组中真皮层内的炎症细胞较模型组相比显著减少,可见新血管生成,而模型组未见明显的新生血管;第14 天,DFO(2 g/L)组和DFO(20 g/L)组创面表皮变薄,真皮增厚,有少量的毛囊,胶原沉积明显及相对规则的细胞排列,与正常皮肤结构相似,不同浓度药物组之间没有显著差异;模型组表皮增厚,真皮变薄,皮肤附属器再生不良,细胞排列不规则、胶原沉积不明显,见图4。
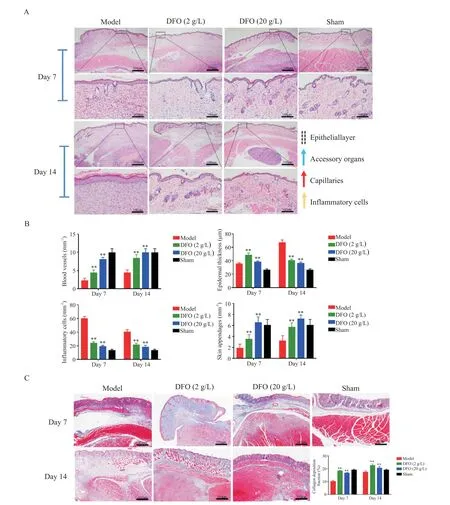
Figure 4. Histomorphological assessment was performed on days 7 and 14 after DTPI in the mice. A:images of HE staining on days 7 and 14(scale bar=500 or 100 μm);B:on days 7 and 14,amount of angiogenesis,degree of epithelialization,inflammatory cell infiltration and skin appendages were assessed;C:images of Masson′s trichrome staining on days 7 and 14,and quantitative analysis of collagen deposition(scale bar=500 μm). Mean±SD. n=6.**P<0.01 vs model group.图4 DTPI后第7和14天时小鼠的组织形态学评估
免疫组化染色结果显示,第7 天,DFO(2 g/L)组和DFO(20 g/L)组的CD31 阳性表达率为(6.3±1.24)%和(8.0±0.81)%,模型组的CD31阳性表达率为(2.7±0.47)%(P<0.01);第14 天时,DFO(2 g/L)组、DFO(20 g/L)组与模型组的CD31 阳性表达率分别为(9.0±0.84)%、(10.0±0.82)%和(4.3±0.47)%(P<0.01),药物组之间没有显著差异,见图5。

Figure 5. CD31 expression level was assessed by immunohistochemical staining on day 7 and 14 after DTPI. The scale bar=500 μm. Mean±SD. n=6.**P<0.01 vs model group.图5 免疫组化染色评估DTPI后第7和14天的CD31表达水平
5 伤口愈合相关蛋白的表达分析
Western blot 结果显示DFO 可调节愈合组织中相关蛋白(HIF-1α、VEGF-α、SDF-1 和TNF-α)的表达。第14 天,DFO 组肌肉组织中HIF-1α 和SDF-1 蛋白表达水平显著高于模型组(P<0.01),其中20 g/L DFO 组表达最高,DFO(20 g/L)组较DFO(2 g/L)组表达具有统计学差异(P<0.05);此外,DFO(20 g/L)组中TNF-α 蛋白的表达水平显著低于模型组和DFO(2 g/L)组(P<0.01);DFO 组中VEGF-α 蛋白水平表达较模型组具有显著升高(P<0.01),见图6。

Figure 6. Relative protein expression of HIF-1α,TNF-α,VEGF-α and SDF-1 after DTPI was detected by Western blot. Mean±SD.n=3.**P<0.01 vs model group.图6 小鼠DTPI后创面组织中HIF-1α、TNF-α、VEGF-α和SDF-1的蛋白表达
讨 论
本研究显示小鼠DTPI 肌肉组织中铁离子沉积异常,而局部应用DFO 可有效地加速伤口愈合并提高愈合质量。DTPI 主要由I/R 损伤引起局部组织内皮血管损伤,红细胞内血红蛋白铁离子“障室封闭”系统瓦解,可螯合状态的铁离子水平升高[15-16]。活性铁离子通过驱动Fenton 型Haber-Weiss 化学反应诱导泛化炎症反应和氧化应激产生大量的ROS,加重氧化应激[17]。
铁贮存于肌肉组织中,检测DTPI 肌肉组织的铁贮备水平,可直接反映DTPI 后有无铁蓄积。本研究结果显示DTPI 肌肉组织中铁离子含量增高,促使伤口呈现一种过度的氧化应激反应,刺激细胞内不断生成ROS,且HIF-1α 的表达随着ROS 的增加而降低。体外细胞实验也证实DFO 能下调HaCaT 中ROS的含量,通过减轻氧化应激反应,促进组织愈合。
创伤愈合是多种细胞、细胞因子和生长因子相互作用的过程,其改变会导致愈合过程的延迟[18-19]。缺氧可诱导细胞因子的产生,刺激成纤维细胞和角质形成细胞的增殖和迁移,局部缺氧可稳定HIF-1α,促进创面愈合[20]。DFO在缺氧条件下能诱导HIF-1α的积累,提高老年小鼠缺血皮瓣的存活,加速新生血管的形成。同样,Bonham 等[21]也证实了局部注射DFO 能够促进老年压力溃疡的愈合。本研究结果表明,DFO 组伤口愈合率较模型组显著增加,至第14天创面几乎完全愈合。通过分子生物学方法分析显示,DFO 上调HIF-1α 和VEGF-α 蛋白的表达,与文献报道的DFO 可稳定HIF-1α 表达是一致的,VEGF-α是其调控细胞因子之一[21]。另外,HIF-1α 也能激活SDF-1 的表达[22]。SDF-1 可激活/调节特定整合素分子来调节骨髓造血祖细胞的黏附/趋化能力,动员和招募血管前体细胞的归巢信号,在血管生成中发挥重要作用[23]。同时,本研究显示,DFO 治疗组的TNF-α 蛋白表达与模型组相比显著下降。TNF-α 被认为是伤口愈合过程中的促炎症细胞因子,参与启动早期伤口愈合反应[24-25],提示DFO 可能通过下调TNF-α 表达,抑制炎症反应,在组织修复中发挥积极作用。此外,经过DFO 治疗后,HE 染色和Masson 染色结果表明小鼠伤口中胶原沉积均匀且致密。这些结果说明DFO 能有效促进小鼠DTPI 创面愈合,可能与HIF-1α激活的信号通路有关。
综上所述,小鼠DTPI 肌肉组织中铁离子异常分布,DFO 可抑制铁离子引起的氧化应激损伤,通过调节HIF-1α/VEGF信号通路参与伤口愈合。
