海带多糖通过抑制NF-κB和JNK通路减轻放射诱导的小鼠下颌下腺炎症反应*
2021-10-20玉洪荣张馨月曾启新
赵 歆, 徐 杨, 柴 溶, 玉洪荣, 敖 翩, 张馨月, 韦 力△, 曾启新△
(1广西医科大学口腔医学院,广西南宁 530000;2广西医科大学人体解剖学教研室,广西南宁 530000)
头颈部恶性肿瘤是高发的恶性肿瘤之一,放射治疗是大部分头颈部恶性肿瘤患者首选的治疗方式[1],而放射(radiation,Rad)治疗会给患者带来程度不一的副作用,口腔干燥症就是其中之一[2]。导致口腔干燥的主要原因是唾液腺损伤引起的唾液分泌量减少,大部分患者因此会发生口腔黏膜炎和猖獗龋等症状,严重降低患者的生活质量[3]。研究表明在Rad 引起的急性唾液腺功能障碍中,炎症反应发挥重要的作用,还能导致后期的慢性唾液腺萎缩[4]。目前常采用唾液刺激剂(如毛果芸香碱等)、唾液替代品[5]、中药和针灸[6]等方法治疗,这些方法只能缓解患者的不适,并不能从根本上解决问题[7]。海带多糖(Laminaria japonicapolysaccharides,LJP)是一种天然的植物多糖,目前多从海带中提取,具有抗肥胖、抗炎和抗Rad[8-9]等作用。LJP 可通过减少炎症因子[10],抑制核因子κB(nuclear factor-κB,NF-κB)/丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)通路来发挥抗炎作用[11]。但LJP 对于放射性唾液腺损伤是否也有保护作用尚不清楚。因此,本研究建立小鼠放射性下颌下腺损伤模型,探讨LJP对Rad 造成的唾液腺功能障碍的作用及其可能的机制。
材 料 和 方 法
1 材料
1.1 动物及分组 SPF 级雄性昆明小鼠96 只,2 月龄,体重28~32 g,购于广西医科大学动物实验中心,许可证号为SCXK(桂)2014-0002。小鼠随机分为4组:对照(control,Ctrl)组、LJP 组、Rad 组和LJP+Rad组,每组24只。小鼠饲养于清洁级动物房1周,提供充足的水和食物。动物实验经广西医科大学动物伦理委员会批准,并按照《实验动物饲养管理和使用指南》进行。
1.2 药品试剂和仪器 LJP(纯度>98%)购自Sigma;抗细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)抗体(ab179707)、抗NF-κB p65抗体(ab32536)、抗NF-κB 抑制蛋白α(inhibitor of NF-κB α,IκBα)抗体(ab7217)、抗c-Jun 氨基末端激酶(c-
Jun N-terminal kinase,JNK)抗体(ab179461)、抗磷酸化 JNK (phosphorylated JNK, p-JNK) 抗 体(ab124956)、抗单核细胞趋化蛋白1(macrophage chemoattractant protein-1,MCP-1)抗体(ab25124)和IgG Ⅱ抗均购自Abcam;通用型SP-9000试剂盒(北京中杉金桥生物有限公司);毛果芸香碱和HE 染色试剂盒(北京索莱宝科技有限公司);ELISA 试剂盒(广州楚杰生物科技有限公司)。[60Co]治疗仪(广西医科大学第二附属医院)。
2 方法
2.1 模型制备 LJP 干预的小鼠于放射前7 d 连续腹腔注射给药(100 mg/kg),其他组用等量的0.9%的生理盐水代替。采用3.5%水合氯醛(350 mg/kg)麻醉小鼠,经腹腔注射麻醉后固定于自制的固定罩内,仅充分暴露小鼠颈部下颌下腺部位,其它部位由铅板遮蔽,源皮距80 cm,给予15 Gy照射[12-13]。
2.2 样本采集 在Rad 处理后1 d、3 d、7 d 和14 d取材(n=4),水合氯醛麻醉后取小鼠眼球血,离心后取上层血清,-80 ℃冰箱保存。分离取出小鼠下颌下腺后立即用4%多聚甲醛溶液固定。
2.3 唾液量的测定 在放射后1 d、3 d、7 d 和14 d
各组随机抽取6 只小鼠检测唾液量。将小棉球制备成适宜塞入小鼠口中的大小,记录此时的重量为m1。选择颈部区域消毒,皮下推注毛果芸香碱(2 mg/kg),将准备好的小棉球放入小鼠下切牙后方舌下的区域,30 min 后拿出棉球,此时棉球的重量记为m2。唾液分泌量(g)=m2-m1。唾液体积按照1 g/mL换算。
2.4 下颌下腺组织形态学检测 将下颌下腺组织固定在4%多聚甲醛固定液中,24 h 后取出脱水石蜡包埋。切片厚度为4 μm,HE染色观察下颌下腺组织的形态学改变。
2.5 免疫荧光染色 石蜡切片脱蜡和高温高压抗原修复后,分别加入抗NF-κB p65抗体和JNK抗体及Ⅱ抗孵育,经DAPI 染色后封片,经倒置荧光显微镜观察并采集图片。应用ImageJ软件分析结果。
2.6 免疫组化 石蜡切片经脱蜡和高温高压抗原修 复 后,分 别 经 抗IκBα、ICAM-1、JNK、p-JNK 和MCP-1 抗体(分别以1∶200、1∶2 000、1∶1 000、1∶250和1∶200 稀释)及Ⅱ抗孵育后染色封片。每个组织切片随机选取3 个高倍视野拍照,采用Image-Pro Plus 6.0进行后续的蛋白表达情况的分析。
2.7 ELISA 实验 取下颌下腺组织匀浆并吸取上清液,ELISA试剂盒室温解冻。根据ELISA试剂盒说明书配制相关的标准品并进行操作,检测上清中TNF-α、MCP-1 和巨噬细胞炎症蛋白2(macrophage inflammatory protein-2,MIP-2)的表达。实验结束后用酶标仪在450 nm处检测样本的吸光度(A)值。
3 统计学处理
采用SPSS 20.0 进行数据分析。计量数据均以均值±标准差(mean±SD)表示。多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 LJP对小鼠唾液腺功能的影响
与Ctrl 组相比,单纯使用LJP 的小鼠分泌的唾液量无显著差别(P>0.05),Rad 处理后的小鼠在各个时点与Ctrl 组相比唾液量均显著减少(P<0.05),而经LJP 干预后小鼠的唾液量比Rad 组显著增多(P<0.05),且随着时间的延长,有逐渐恢复到Ctrl 组水平的趋势,见图1。
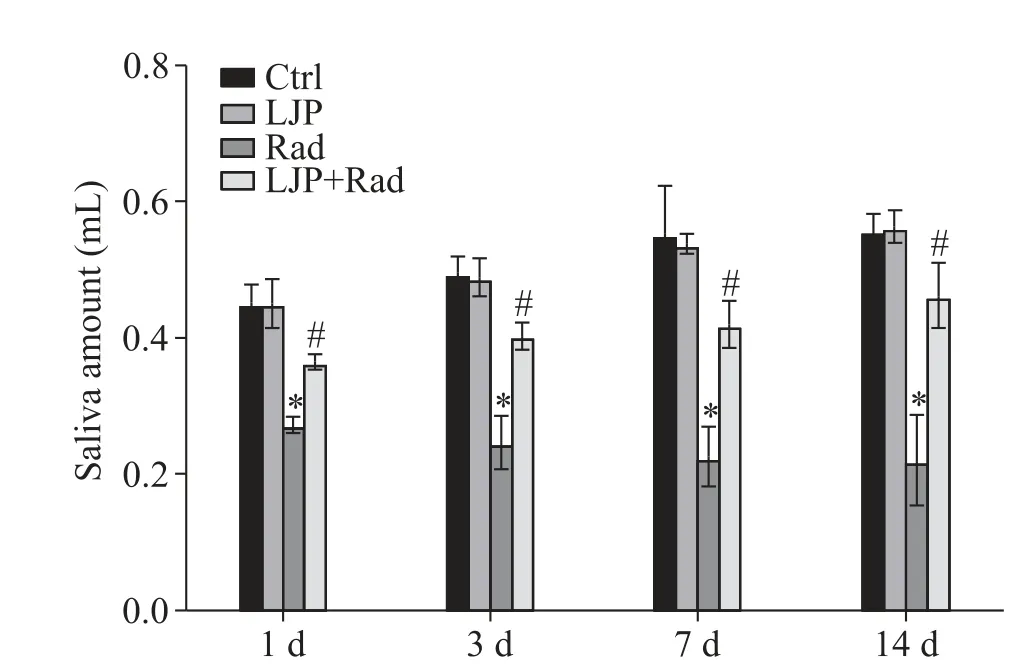
Figure 1. The saliva amount of the mice after radiation(Rad).LJP:Laminaria japonica polysaccharides. Mean±SD. n=6.*P<0.05 vs control(Ctrl)group;#P<0.05 vs Rad group.图1 放射后各组小鼠的唾液量
2 LJP对于小鼠下颌下腺组织形态的影响
Ctrl组下颌下腺腺体细胞排列紧密规则,胞核形态大小正常,胞质均染,未见明显的炎症细胞浸润;Rad 处理后的小鼠均可见下颌下腺间质水肿及炎症细胞浸润,且状况逐渐加重,Rad 处理后7 d,Rad 组可见明显的核固缩,腺泡细胞空泡化和腺体结构疏松,随着时间的推移,下颌下腺组织内炎症细胞数量增多,腺泡细胞萎缩、核固缩范围的程度增加;经LJP干预的小鼠细胞排列较Rad 组整齐,炎症细胞浸润程度显著减轻,见图2。
3 LJP 对小鼠下颌下腺组织中炎症相关细胞因子含量的影响
镜下可见ICAM-1 在Ctrl 组和LJP 组仅在细胞膜有少量表达,而Rad 和LJP+Rad 组在血管内皮及导管上皮细胞上的表达显著增多(P<0.05);与Ctrl 组相比,Rad组下颌下腺组织中炎症细胞因子ICAM-1、TNF-α、MCP-1 和MIP-2 表达显著增高(P<0.05);与Rad 组相比,LJP 干预后的ICAM-1、TNF-α、MCP-1 和MIP-2含量显著降低(P<0.05),见图3。

Figure 3. The effect of Laminaria japonica polysaccharides(LJP)on the content of inflammatory cytokines in submandibular gland of mice after radiation(Rad). The protein expression of ICAM-1(A)and MCP-1(B)was detected by immunohistochemical staining(scale bar=50 μm). The secretion of TNF-α,MCP-1 and MIP-2 was detected by ELISA(C). Mean±SD. n=6.*P<0.05 vs control(Ctrl)group;#P<0.05 vs Rad group..图3 海带多糖对放射后小鼠下颌下腺组织中炎症细胞因子含量的影响
4 LJP 对小鼠下颌下腺组织内NF-κB 信号通路的影响
用免疫荧光法定位NF-κB p65 蛋白,结果显示Ctrl 组和LJP 组各时点NF-κB p65 主要位于胞质区,而Rad处理后的NF-κB p65位置发生了改变,由胞质变为胞核,入核的数量于Rad 处理后1 d 开始增多,在7 d 时入核的量达到了最大,14 d 时入核的量又减少;而经LJP干预的小鼠在各时点入核量均较Rad组减少,有恢复到Ctrl 组的趋势,见图4A~D。用免疫组化的方法检测IκBα蛋白的表达,结果显示IκBα主要位于血管内皮及导管上皮细胞内;Rad 处理后IκBα 的含量较Ctrl 组显著减少(P<0.05),并在Rad处理后7 d 达到最低值;与Rad 组相比,LJP 干预后的IκBα的含量显著增多(P<0.05),见图4E。

Figure 4. The effect of Laminaria japonica polysaccharides(LJP)on the activity of NF-κB signaling pathway in the submandibular gland of mice after radiation(Rad). A to D:the nuclear location of NF-κB p65 was determined by immunofluorescence staining(A:1 d after Rad;B:3 d after Rad;C:7 d after Rad;D:14 d after Rad);E:IκBα protein expression was detected by immunohistochemical staining. The scale bar=50 μm. Mean±SD. n=6.*P<0.05 vs control(Ctrl)group;#P<0.05 vs Rad group.图4 海带多糖对放射后小鼠下颌下腺组织NF-κB信号通路活性的影响
5 LJP 对小鼠下颌下腺组织内JNK 信号通路活性的影响
免疫组化结果显示,与Ctrl组相比,Rad组p-JNK蛋白水平显著升高。计算p-JNK 与JNK 蛋白含量的比值,结果显示,在各时点LJP 组与Ctrl 组相比差异无统计学意义(P>0.05);Rad处理后的p-JNK/JNK 显著升高(P<0.05);Rad 处理后1 d 与7 d,LJP+Rad 组的下调作用不显著(P>0.05),而Rad 处理后3 d 和14 d的下调作用显著(P<0.05)。见图5。
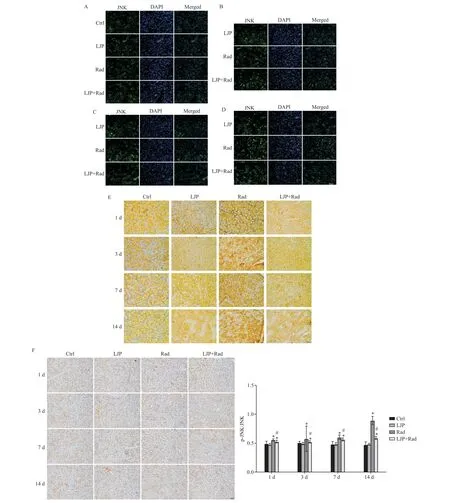
Figure 5. The effect of Laminaria japonica polysaccharides(LJP)on the activity of JNK signaling pathway in the submandibular gland of mice after radiation(Rad). A to D:the expression of JNK was determined by immunofluorescence staining(A:1 d after Rad;B:3 d after Rad;C:7 d after Rad;D:14 d after Rad). The protein levels of JNK(E)and p-JNK(F)were detected by immunohistochemical staining. The scale bar=50 μm. Mean±SD. n=6.*P<0.05 vs control(Ctrl)group;#P<0.05 vs Rad group.图5 海带多糖对放射后小鼠下颌下腺组织JNK信号通路活性的影响
讨 论
放射性唾液腺损伤(radiation-induced salivary gland damage)是头颈部肿瘤患者接受放疗后常见的并发症[14],放射线对唾液腺造成的损伤主要表现为唾液分泌量减少及唾液成分改变[15],导致患者生活质量下降甚至影响到原本的治疗[16]。本研究显示,Rad处理后小鼠的唾液分泌量显著减少,说明Rad处理对小鼠的唾液腺造成了损伤,与文献报道一致[15];而经LJP 干预后,小鼠的唾液分泌量有显著改善,且随着时间的推移,有恢复到Ctrl 组水平的趋势,提示LJP 治疗可以减轻Rad 引起的唾液腺损伤。研究认为,炎症在Rad 诱导的下颌下腺早期损伤中发挥作用[17]。LJP 可以通过抑制NF-κB 活化而减轻全身炎症反应[18],也可以明显抑制哮喘小鼠的气道炎症[10]。但LJP 是否也可以在Rad 诱导的小鼠下颌下腺炎症反应中发挥相似的作用尚未可知。本实验中HE 染色结果可见,与Ctrl 组相比,Rad 处理后下颌下腺组织内可见大量炎症细胞浸润,而经LJP 干预后炎症减轻,故推测LJP 对放射性下颌下腺损伤的保护作用与抗炎有关。
ICAM-1 在Rad 处理后的肺组织的表达显著增加,并在Rad 诱导的肺组织炎症细胞的迁移中发挥重要作用[19]。在舍格伦综合征中主要通过诱导淋巴细胞浸润从而参与唾液腺的炎症反应[20]。有研究证明在暴露于辐射后,患者唾液内的ICAM-1 蛋白浓度增加[21]。静息状态下ICAM-1 在免疫细胞和血管内皮细胞呈低水平表达,但是在炎症刺激下表达会上调,帮助白细胞向受损组织的迁移[22]。TNF-α 是炎症反应中重要的促炎因子,在放射性下颌下腺损伤中发挥重要作用[23]。MCP-1 是C-C 类趋化家族成员之一,通过激活和趋化单核巨噬细胞到损伤的血管内皮周围,促进炎症反应[24]。在舍格伦综合征中,MCP-1 与C-C 基序趋化因子受体2[chemokine(C-Cmotif)receptor 2,CCR2]的相互作用是促进单核细胞在唾液腺浸润的主要原因[25]。而MIP-2 主要对中性粒细胞产生趋化和激活作用[26],在辐射的肺组织中嗜中性粒细胞和巨噬细胞增多,且MIP-2 在胸膜液中的表达水平显著提高,升高的MIP-2 可以加速炎症反应的发生,促进肺的损伤[27]。本研究显示,与Ctrl 组相比,Rad 处理后的下颌下腺组织内ICAM-1、TNF-α、MCP-1和MIP-2水平升高,提示Rad导致下颌
下腺组织内相关的炎症细胞因子水平升高,并且不断促进炎症细胞的聚集,进而加重组织的炎症反应;而LJP 可以缓解上述炎症因子和炎症细胞的聚集,减轻小鼠Rad处理后下颌下腺的炎症反应。
NF-κB 和JNK 信号通路在唾液腺炎症中发挥重要作用[28-29]。NF-κB 是调节炎症相关因子表达的关键转录因子之一[30],被Rad 激活后,其下游的TNF-α和ICAM-1 等炎症因子的表达会被激活[31]。在没有被激活的状态下,IκBα与NF-κB紧密结合,此时主要位于细胞质,当感知到外来刺激时,IκBα 则降解,NF-κB 因此进入细胞核,此时的NF-κB 信号通路就是激活的状态[32]。本研究观察到,NF-κB于Rad处理后入核量不断增加;LJP 给药干预可以显著减少NFκB p65亚基入核,且能显著提高IκBα 表达,提示LJP可以通过抑制NF-κB 信号通路的激活,从而减少下游炎症相关因子的表达。JNK 信号转导通路为MAPKs炎症通路中的重要成员。有研究显示JNK抑制剂可以减少感染组织内炎症相关因子MCP-1 和MIP-2 的表达,从而减轻炎症反应[33]。在接受Rad 的唾液腺组织内,p-JNK 的蛋白表达水平提高了41.65%,而抑制JNK 信号通路的激活可以改善放射诱导的唾液腺炎症[34]。因此,我们也检测了小鼠下颌下腺组织内JNK 的磷酸化水平,与Ctrl 组相比,Rad 组的下颌下腺组织内p-JNK 的表达显著增加,而LJP 给药干预可以显著抑制小鼠下颌下腺组织内JNK 的磷酸化,从而减少下游炎症相关因子MCP-1和MIP-2 的表达,降低炎症水平,达到保护下颌下腺组织的作用。由此可见,LJP 显著抑制Rad 诱导的下颌下腺炎症反应,其机制可能与抑制NF-κB 核内转移及降低JNK蛋白磷酸化水平及有关。
总之,LJP 可以降低TNF-α、ICAM-1、MCP-1 和MIP-2 炎症因子的表达,减轻Rad 处理小鼠下颌下腺组织的炎症反应,从而发挥保护作用,而这种作用可能是通过抑制NF-κB 和JNK 信号通路实现的。然而本研究只对涉及的通路机制进行了初步探讨,后续有待深入研究。
