车前草水提物对环磷酰胺致免疫抑制小鼠免疫功能的影响
2021-10-20李燕华梁月琴李丛元李翠红夏洪颖李仲昆
李燕华 梁月琴 李丛元 李翠红 夏洪颖 李仲昆
昆明市延安医院,云南 昆明 650051
车前草(Ribwort plantain)为车前科植物车前或平车前的干燥全草,为世界范围内应用最广泛的药用植物之一[1-2]。具有凉血、清热、解毒、利尿、祛痰、抗肿瘤、神经和免疫调节的作用[3-6],可治疗热淋涩痛、暑湿泻痢、水肿尿少、痈肿疮毒、痰热咳嗽、吐血衄血等疾症[7]。免疫系统在抵抗微生物和外来抗原方面起着重要的作用,它参与了由宿主免疫状态所决定的疾病的发生与恢复,如癌症、肥胖、糖尿病、肺结核等,对于免疫介导性疾病的预防和康复都至关重要。免疫器官(如骨髓、胸腺、脾脏、扁桃体、淋巴结、粘膜免疫系统包括肠黏膜派氏淋巴结(Peyer′s patches,PPs)、免疫细胞、免疫分子都是机体免疫系统的重要组成部分[8]。环磷酰胺(Cyclophosvnamide,CY)是一种烷基化剂,被广泛应用于免疫治疗和肿瘤化疗,其不良反应包括免疫抑制、骨髓抑制、白细胞减少和氧化应激等[9-11]。有报道[12]称,CY可产生氧化应激,介导氧化还原平衡的破坏,导致生化和生理上的干扰。CY可破坏Th1/Th2平衡[12],诱导T细胞和B细胞的绝对计数下降[13]。目前对车前草多种药用价值的报道甚多,但对肠道免疫功能的影响尚未报道。研究拟通过观察小鼠体重变化率、脏器指数、肠黏膜PPs的数量及淋巴细胞表型、细胞因子水平等指标的变化,初步探讨PAE对肠道免疫功能的影响,为开发利用车前草提供参考。
1 材料与方法
1.1 药物 车前草购自云南新世纪中药饮片药有限公司,经云南省楚雄州人民医院罗宝生主任药师鉴定为车前草属车前草科植物PlantagoasiaticaL。取干燥车前草100 g,煎煮2次,第1次煎煮前先用纯水浸泡约20 min,水量为浸过药面1~3 cm,先用武火煮沸,再改用文火煎煮30 min。合并2次水煎液,用旋转蒸发仪将水煎液浓缩至100 mL,得到车前草水提物,浓度为1 g/mL,含生药量为1 g/mL,冷藏备用,给药剂量按生药量计算。0.9%氯化钠注射液(批号G115051701,四川科伦药业股份有限公司);注射用CY(批号15102925,江苏盛迪医药有限公司)。
1.2 动物 6~8周龄18~22g的SPF级ICR雄性小鼠60只,自湖南斯莱克景达实验动物有限公司购入,动物许可证号SCXK(湘)2013-0004。饲养于昆明市延安医院中心实验室动物房,保持室温25±2℃,湿度50%±5%。
1.3 试剂 改良RPMl-l640培养基(赛默飞世尔生物化学制品(北京)有限公司);胎牛血清(FBS,法国Biowest公司);抗小鼠CD3e-FITC、抗小鼠CD19-PE购自美国BD-Pharmingen公司;MouseIL-4 ELISA kit、Mouse IFN-Y ELISA kit购自欣博盛生物科技有限公司,其他试剂均为分析纯。
1.4 仪器 全自动酶标仪Model550(美国BIO-RAD公司);FACSCalibur流式细胞仪(FC-500)(美国Beckman公司);LEGENDMICRO17台式微量离心机(美国 Thermo公司);TD5M低速多管架自动平衡离心机(长沙万佳森仪器设备有限责任公司);FA2004电子分析天平(上海精密科学仪器有限公司);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂)。
1.5 动物分组、造模及给药 60只SPF级ICR健康雄性小鼠随机分为正常对照组、模型组、PAE低、中、高剂量组,每组12只。PAE低、中、高剂量组分别每天按0.25、0.5、1.0 g/kg灌胃,正常对照组、模型组给予与PAE体积相当的NS灌胃,共14 d。在实验第9d开始模型组和PAE各剂量组小鼠隔日给予CY注射液50 mg/kg腹腔注射,共3次,正常组小鼠给予等体积生理盐水腹腔注射,末次注射CY 24h后颈椎脱臼处死小鼠,取材进行各项指标检测。
1.6 体质量增率、脾脏及胸腺指数测定 上述各组小鼠连续灌胃14 d后称取体质量并颈椎脱臼处死,无菌条件下分离脾脏和胸腺剔除脂肪和结缔组织后称重,分别计算体质量增率、脾脏及胸腺指数:净体质量增率=(处死时体质量-初始体质量)/初始体质量×100%,脏器指数(%)=脏器重量(g)/小鼠体质量×100%。
1.7 PPs细胞表型的测定
1.7.1 PPs计数 将肠腔冲洗干净,迅速放入含5%胎牛血清(5%FBS)的RPMI1640培养基的培养皿中,肉眼可见外肠壁上米白色麦粒样圆形突起即为派氏结(PPs),计数PPs个数。
1.7.2 PPs细胞表型测定 用眼科镊和眼科剪小心分离出小肠外壁PPs,将PPs迅速浸入RPMI1640液的培养皿中,将PPs移入经RPMI1640液浸润过的120目细胞筛中,用研磨棒加适当力度轻轻研磨,再RPMI1640液冲洗过滤;取其过滤液再经200目细胞筛过滤后收集滤液加至 5 mL,以 2000 r/min 离心 10 min,弃上清液,加入RPMI1640液约 3 mL,重悬细胞即得PPs细胞悬液。将收集到的PPs细胞悬液进行细胞计数并调节细胞浓度至1×107/mL,分别取100 μL细胞移入流式细胞专用管进行荧光标记,每管依次加入抗小鼠CD3e-FITC,CD19-PE单克隆抗体各0.5 μg,混匀后 4 ℃ 避光 30 min,荧光标记结束后,用PBS洗涤细胞2次后重悬于400 μL的PBS中用流式细胞仪检测细胞表型。
1.8 ELISA检测细胞因子分泌水平 打开小鼠腹腔取出全段小肠,向将NS3 mL注入肠腔内,保留并轻轻晃动4 min,使肠内容物充分混匀溶解,收集肠腔内的NS于EP管中,3000 r/min离心 10 min,取上清液,编号备用,按酶联免疫技术(ELISA)鼠IL-4、IFN-γELISA试剂盒说明书上的流程操作进行检测操作,以酶标仪测定肠黏膜IL-4、IFN-γ的光密度值。
2 结果
2.1 PEA对免疫抑制小鼠体重增加率、胸腺及脾脏指数的影响 与正常对照组相比较,模型组、PEA低、中、高剂量组体重增加率、胸腺指数均显著降低(P<0.05),模型组、PEA低、中剂量组脾脏指数显著降低(P<0.05);与模型组相比较,PEA中、高剂量组的体重增率显著增高(P<0.05),PEA低、中、高剂量组脾脏指数和胸腺指数显著升高(P<0.05);与PEA低剂量组相比较,PEA中、高剂量组体重增率、脾脏指数和胸腺指数显著升高(P<0.05);与PEA中剂量组相比较,PEA高剂量组体重增率、脾脏指数和胸腺指数显著升高(P<0.05)。见表1。
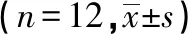
表1 各组小鼠体重、脏器的指数化情况
2.2 PEA对PPs数目及淋巴细胞表型的测定 与正常对照组相比较,模型组、PEA低、中剂量组小鼠肠黏膜PPs数目及CD19+细胞比例均显著降低(P<0.05),模型组、PEA低剂量组小鼠肠黏膜PPs内CD3+细胞比例显著升高(P<0.05);与模型组相比较,PEA低、中、高剂量组小鼠肠黏膜PPs数目及CD19+细胞比例均显著升高(P<0.05),CD3+细胞比例显著降低(P<0.05);与PEA低剂量组相比较,PEA中、高剂量组小鼠肠黏膜PPs数目显著升高(P<0.05),PEA高剂量组的小鼠肠黏膜CD19+细胞比例显著升高(P<0.05),CD3+细胞比例显著降低(P<0.05);与PEA中剂量组相比较,PEA高剂量组小鼠肠黏膜PPs数目显著升高(P<0.05)。见表2。
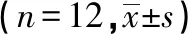
表2 PEA对各组小鼠肠黏膜PPs数目及淋巴细胞表型的影响
2.3 PEA对细胞因子的调节 与正常对照组相比较,模型组、PEA低、中剂量组小鼠肠黏膜IFN-γ、IL-4浓度均显著降低(P<0.05);与模型组相比较,PEA低、中、高剂量组小鼠肠黏膜IFN-γ、IL-4浓度比值均显著升高(P<0.05);与PEA低剂量组相比较,PEA中、高剂量组小鼠肠黏膜IFN-γ、IL-4浓度比值均显著降低(P<0.05);与PEA中剂量组相比较,PEA高剂量组小鼠肠黏膜IFN-γ、IL-4浓度比值均显著降低(P<0.05)。见表3。
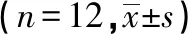
表3 各组小鼠肠黏膜IFN-γ、IL-4分泌量
3 讨论
胸腺是机体的中枢免疫器官,也是参与细胞免疫和T细胞分化、发育和成熟的重要器官;脾脏是机体最大的外周淋巴组织器官,是机体的免疫中心,含有大量NK细胞、记忆T细胞及Th细胞等,在机体免疫中都发挥着重要作用。免疫器官所含免疫细胞数量及功能与其重量密切相关,脏器指数可在一定程度上反应机体免疫功能的强弱,因此,脾脏及胸腺重量的改变可初步反映出受试物对机体免疫系统的影响[14]。
PPs富含T细胞(约为40%)和B细胞(约为60%),在免疫监视和细胞介导的黏膜免疫中具有重要作用;是诱导细胞增殖活化和抵御肠道内有害物质侵袭的主要部位,PPs中淋巴细胞及其亚群的数量和活性状态可作为反映肠道黏膜局部的免疫状态的指标[15]。CD3分子为T细胞的特有标志,表达于成熟的T淋巴细胞表面。CD19分子是与B细胞增殖、分化、活化及抗体产生有关的重要膜抗原,存在于全体B细胞表面,是最重要的B细胞标记因子。茯苓多糖能拮抗CY诱导的各淋巴组织中T、B细胞亚群的失衡,尤其是肠道免疫系统作用[16],表现为PPs细胞中CD3+细胞比例下降,CD19+细胞比例上升。
维持肠黏膜系统免疫功能平衡的另一个重要因素是细胞因子。辅助性T细胞(helperTcell,Th)可分为Th1和Th2两种类型,对机体免疫有重要的调节作用。其中Th1细胞调节细胞免疫,促进细胞毒性活动和炎症反应,与迟发型超敏反应的发生和机体抗肿瘤作用有关,主要分泌IFN-γ和IL-2等细胞因子;Th2细胞辅助B细胞增殖分化为浆细胞,分泌抗体调节体液免疫,主要分泌IL-4等细胞因子;IFN-γ和IL-4分别是Th1和Th2细胞的特征性细胞因子。
CY是治疗恶性肿瘤最常用的烷化剂,属广谱抗肿瘤药物,可抑制细胞的DNA合成、干扰细胞的增殖、抑制抗体形成,是临床上治疗肿瘤和免疫性疾病的常用药物之一[8],其主要毒副作用是免疫和骨髓抑制。在既往的研究[16-18]中提示注射CY可出现免疫抑制,表现为实验动物体重、脏器指数、肠黏膜PPs的数量及细胞因子水平降低,PPs内CD3+细胞比例升高,CD19+细胞比例均降低,本研究的结果与之相同。在有的研究中显示PPs内CD3+细胞数量降低,由于在本研究并未测量PPs内CD3+、CD19+细胞的绝对数量,CD3+细胞比例的升高考虑为CD19+细胞下降较多引起PPs内细胞总数降低所致。
许多天然物质(包括植物来源和动物来源)具有调节先天和适应性免疫功能和抗氧化的特性,临床上已经使用许多中草药来预防化疗药物的毒副作用[8,19-20]。有许多生物活性多糖对免疫系统有较深的影响,且无明显毒副作用,具有免疫调节功能[21],如促进细胞因子或趋化因子分泌、激活补体系统和免疫相关细胞等[22]。同时在众多的研究中,许植物多糖[16,18]能够对抗CY引起的免疫抑制状态如:实验动物体重、脏器指数、肠黏膜PPs的数量及细胞因子水平降低,PPs内淋巴细胞表型比例的改变。在本研究中,PEA已表现出了与前述报道相似的改变,尤其以中、高剂量组明显,然而中、高剂量之间的差异不明显。
PAE预处理可改善CY致免疫抑制小鼠的免疫功能。由于本文仅研究车前草水提物对环磷酰胺致免疫抑制小鼠的免疫功能是否有影响及其影响的程度,故并未设立阳性对照组,有关车前草水提物与其它免疫调节剂的比较,有待进一步深入的研究。
