梅花鹿角和马鹿角的蛋白质组成与分析
2021-10-20张海莲陈晓王玉团
张海莲,陈晓,王玉团
(1.菏泽市立医院,山东 菏泽 274031;2.山东省食品药品检验研究院,山东省食品药品安全检测工程技术研究中心,山东 济南 250101)
鹿角始载于《神农本草经》,列为上品,为鹿科动物马鹿(CervuselaphusLinnaeus)或梅花鹿(CervusNipponTemminck)已骨化的角,分别习称马鹿角和梅花鹿角,功能为温肾阳,强筋骨,行血消肿[1-2],临床上主要用于治疗人体肾阳虚衰之症,因疗效非常确切,故应用广泛。
目前对鹿角的研究主要集中在蛋白酶解工艺及蛋白和多肽药理作用方面[3-4],也有微量元素分析[5-7]、多糖测定[8]和氨基酸分析[9]等方面的研究报道,但对鹿角的生物活性成分蛋白质组成方面的研究较少。利用蛋白质组学技术对鹿角中主要蛋白质进行结构分析与种类确认,可以明确鹿角的主要蛋白质组成。试验中采用蛋白变性溶液对鹿角进行处理,再用胰蛋白酶酶解,然后通过超高效液相-高分辨质谱联用仪进行多肽分离及质谱数据采集,最后选择目标蛋白质数据库进行比对,得到鹿角中蛋白质及多肽的信息[10]。
1 仪器与材料
1.1 仪器 超高效液相色谱仪Ultimate 3000联用Fusion-Orbitrap高分辨质谱仪(Thermo 公司),XSE205电子天平(赛多利斯科学仪器有限公司)。
1.2 材料 Millipore 10 K超滤管;胰蛋白酶(Sigma公司,批号:SLBG6452V);马鹿角、梅花鹿角[安国药材市场王兵要鹿茸铺提供,产地为黑龙江省伊春市,经山东中医药大学彭艳丽教授鉴定,分别为鹿科动物马鹿(CervuselaphusLinnaeus)和梅花鹿(CervusNipponTemminck)已骨化的角,编号分别为DWY-MLJ-03和DWY-MHLJ-03];盐酸胍、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸二钠(EDTA二钠)、二硫苏糖醇(DTT)、碘代乙酰胺(IAA)、碳酸氢铵均为分析纯;甲酸、乙腈为色谱纯。
2 方法与结果
2.1 供试品溶液的制备 取鹿角粉碎成细粉(过五号筛),精密称取20 mg,加2 mL蛋白质变性溶液(含6 mol·L-1盐酸胍、1 mol·L-1Tris和2 mmol·L-1EDTA二钠),加0.05 mL的 0.5 mol·L-1DTT溶液,置于90 ℃保温处理4 h,取出,放冷至室温。加入0.12 mL的0.55 mol·L-1IAA溶液,摇匀,避光反应30 min,10 000 r·min-1离心10 min,取上清液0.2 mL置于10 k超滤管中,反复离心洗涤,截留物加0.2 mL的1%碳酸氢铵溶液和5 μL胰蛋白酶溶液(10 mg· mL-1),置于37 ℃酶解12 h,0.22 μm滤膜过滤,即得。
2.2 超高效液相色谱条件 色谱柱为Thermo Hypersil GOLD(100 mm×2.1 mm,3 μm),柱温40 ℃,流动相A为0.1%甲酸,流动相B为乙腈,梯度洗脱程序见表1,进样量为5 μL,流速0.3 mL·min-1。
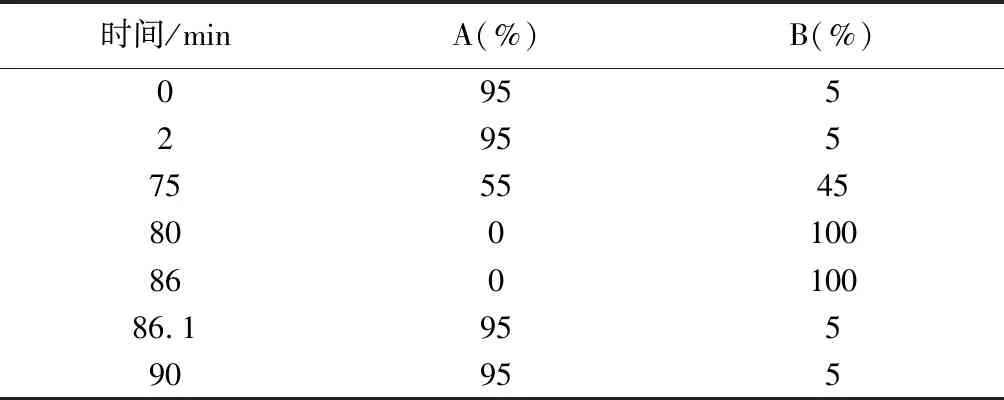
表1 液相色谱梯度洗脱程序
2.3 高分辨质谱条件 采用Fusion-Orbitrap高分辨质谱仪,电喷雾离子源(ESI+),喷雾电压为3.5 kV,雾化温度350 ℃,离子传输毛细管温度为320 ℃,S-Lens传输效率设置为60%。一级质谱采用Orbitrap作为质量分析器,分辨率为120 000(m/z400),采集范围为350~1 550 Th,RFLens设为60%,Mass Tolerance设为10 ppm;二级质谱采用离子阱作为质量分析器,分辨率为30 000(m/z400),First Mass(m/z)为100,采用Rapid Scan模式进行扫描,HCD碎裂模式,碎裂能量设置为40%。
2.4 数据采集 按上述色谱和质谱条件,对供试品溶液进行分析,总离子流图见图1。
2.5 数据处理方法 目前没有鹿角完整的蛋白质组数据库,为鉴定出尽可能多的蛋白质,选择Deer(鹿)以及Colleagn(胶原蛋白)和Keratin(角蛋白)组成的蛋白质组数据库Deer+Colleagn+Keratin(截止到2019-03-21)。经对该组合蛋白质数据库进行分析,该库含有鹿科所有动物及近源动物的已知蛋白,蛋白种类非常丰富,能满足研究需要。利用蛋白质解析软件PEAKS Studio 8.5来处理质谱数据,为鉴定出尽可能多的已知多肽,必须进行合理的参数设置,软件参数设置如下:-10lgP(Peptide)≥20、-10lgP(Protein)≥20、 FDR(Peptide-Spectrum Matches)=0.4%、Ascore(Post-translational modification of Peptide)≥0、Peptide mutation ion intensity≥0%、Proteins unique peptides≥0、ALC(De novo only)≥50%、FDR为0.4%,设定无论氨基酸是否修饰还是变异全部进行检测。

A.马鹿角;B.梅花鹿角图1 UPLC-HRMS鹿角总离子流图
3 分析
3.1 总离子流图(TIC)分析 由图1可知,马鹿角和梅花鹿角酶解后多肽的总离子流色谱图相似度非常高,提示两者具有相似的多肽组成。目标多肽主要在保留时间75 min之前流出,75 min以后的色谱峰经质谱确认,均为单电荷,为鹿角中非多肽有机物。
3.2 多肽种类及匹配情况的分析 根据表2结果可知,马鹿角和梅花鹿角鉴定出的多肽种类分别为1 565和1 546种,说明两者在相同酶解条件下得到的多肽种类数非常相近。共有多肽数占已匹配多肽数两者均约为50%,扣除酶解过程中产生的不完全酶解多肽或异常断裂形成的多肽,则马鹿角和梅花鹿角90%以上的多肽是相同的,可见两种鹿角多肽组成具有非常高的相似性,与总离子流图分析结论相一致。
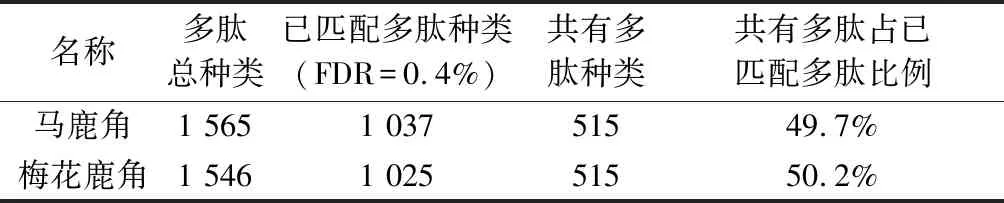
表2 多肽匹配结果
3.3 覆盖度和相对含量top 10蛋白质组成的分析 基于蛋白质覆盖度的高低可以明确目标物中蛋白质的组成。对组成目标蛋白质的各种多肽响应值进行累加,可以获知目标物中蛋白质的相对含量。覆盖度top 10的蛋白质90%为Ⅰ型胶原蛋白,其中表3中马鹿角编号1和梅花鹿角编号6蛋白质均来自鹿的血液,原因是鹿角由真皮层形成,而真皮层富含血液。相对含量top 10的蛋白全部为Ⅰ型或Ⅱ型胶原蛋白质,且两者70%的蛋白质相同。
4 讨论
由表3和表4可知,部分蛋白来自非鹿科动物体,说明目前对鹿角的蛋白组成研究不充分,鹿角中很多蛋白没有被发现鉴定,更进一步说明本研究具有必要性。试验中曾尝试仅用Deer蛋白库,结果蛋白覆盖度较低,top 10中蛋白有9个覆盖度不足65%,鉴定出的蛋白种类较少。而采用Deer+Colleagn+Keratin组合库,含量较高的蛋白均能进行匹配,top 10中蛋白覆盖度不低于90%,该结果更有利于分析鹿角中的未知蛋白。
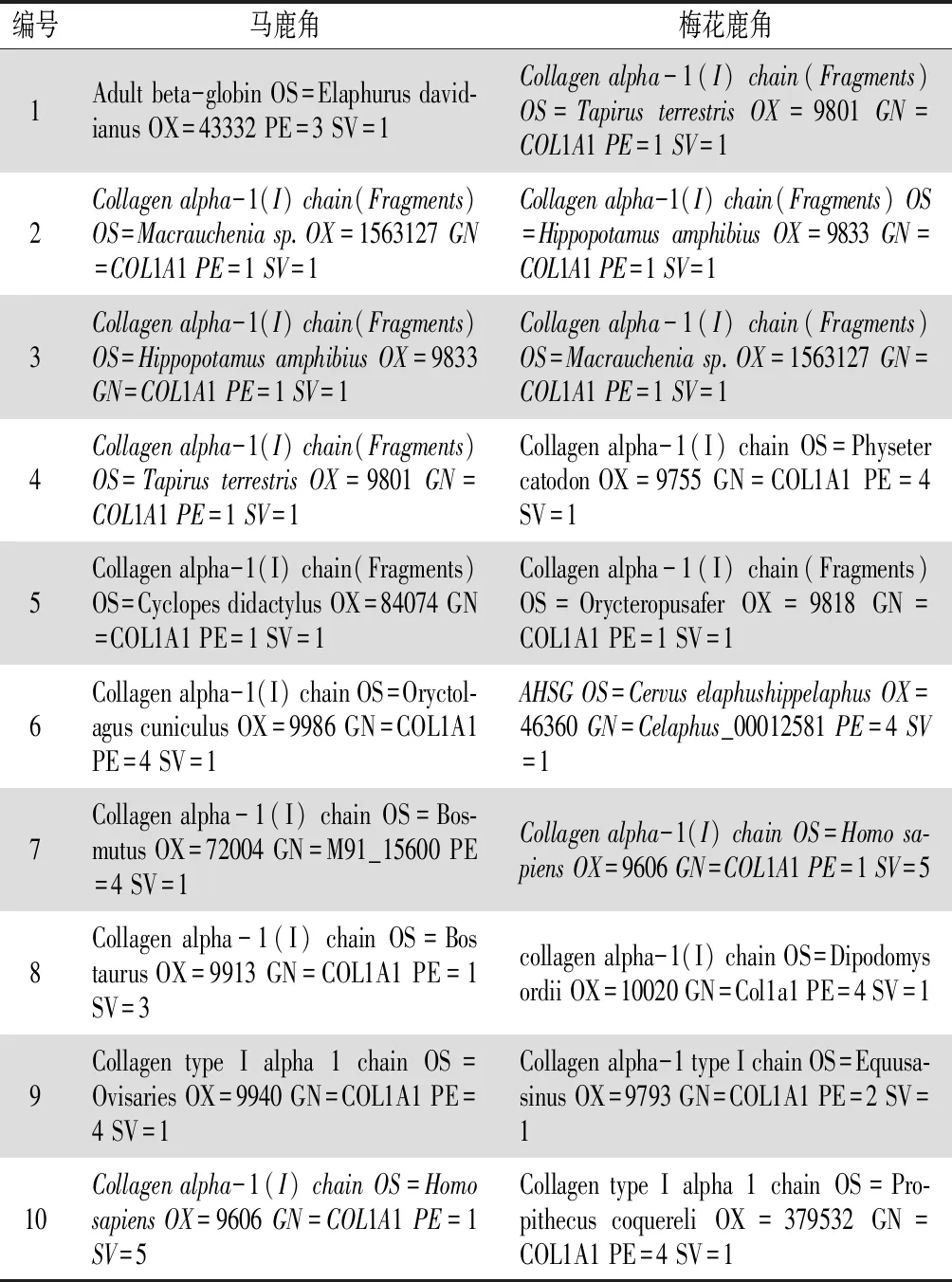
表3 覆盖度top 10的蛋白质组成

表4 相对含量top 10的蛋白质组成
鹿角及其炮制品(鹿角胶和鹿角霜)临床用量非常大,但针对其生物活性成分胶原蛋白质的结构研究尚少,本研究基于蛋白质组学技术对马鹿角和梅花鹿角进行了分析,明确了组成梅花鹿角和马鹿角的主要蛋白质,同时发现两者所含蛋白质主要为Ⅰ型胶原蛋白,并含少量Ⅱ型胶原蛋白,不含角蛋白。目前自然界存在的胶原蛋白种类有几十种,其结构和功能各不相同。Ⅰ型和Ⅱ型胶原蛋白结构上的区别主要是含糖量的不同,Ⅰ型胶原蛋白的含糖量约为1%,而Ⅱ型可高达10%。Ⅰ型胶原蛋白对骨质疏松症发生、发展、以及严重程度密切相关,Ⅱ型胶原蛋白能修复各种关节损伤,提示鹿角所具有的强筋骨的功能可能与其所含丰富的Ⅰ型和Ⅱ型胶原蛋白密切相关。该研究可为进一步开发利用鹿角蛋白质提供有效的技术支持。该研究下一步将分离纯化上述目标蛋白质,以进一步明确鹿角中胶原蛋白质与中医临床疗效之间的联系。
