蛋白质氧化和酶对草鱼重组鱼肉品质及体外模拟消化的影响
2021-10-19秦求思毛海萍戴志远
孟 粉,秦求思,董 烨,毛海萍,戴志远,2,3*
(1 浙江工商大学海洋食品研究院 杭州310012 2 浙江省水产品加工技术研究联合重点实验室 杭州310012 3 海洋食品精深加工关键技术省部共建协同创新中心 大连工业大学 辽宁大连116034)
草鱼是我国较为普遍的淡水鱼,因生长速度快,饲料效率高,营养价值高,价格相对低廉而被青睐。鱼类蛋白质氧化为近年来研究的热点之一,蛋白质氧化会导致氨基酸残基侧链的氧化修饰、肽链的断裂、蛋白质分子间的交联等[1]。赵冰等[2]研究发现蛋白质氧化使流变学特性降低,蛋白质结构被破坏;岳开华等[3]研究发现羟自由基氧化能改变海鲈鱼肌原纤维蛋白结构,导致其乳化性能下降;刘娟等[4]研究发现氧化会改变蛋白质的结构和功能性质;李学鹏等[5]研究发现羟自由基氧化使蛋白质分子产生交联和聚集,蛋白质构象发生显著变化,网络结构变疏松,进而对肌原纤维蛋白凝胶性质和持水性产生一定影响;王汉玲等[6]研究发现蛋白质氧化可以改变草鱼肌原纤维蛋白理化特性,导致其肌肉保水性能下降。
谷氨酰胺转氨酶(transglutaminase,简称TGase,EC.2.3.2.13)是一种具有很强交联能力的酶[7],可以改善食品的口感、风味、质地等,没有副产物生成,且不会使营养成分损失[8-9],被广泛用于水产品加工、肉制品加工、乳制品加工中等。TGase可以催化蛋白质上的ε-氨基与谷氨酸的γ-羟酰胺行成蛋白质分子内或分子间交联,以增强蛋白质凝胶性能[10]。陈秋妹等[11]研究发现TGase 可以催化鱼肉蛋白与大豆蛋白发生共价交联,显著提高重组鱼排的凝胶特性和持水能力;何晓萌[12]研究发现TGase 可以促进肌原纤维蛋白交联,进而提高混合鱼糜的凝胶特性;郑雅爻等[13]研究发现TGase 可使鲢鱼皮明胶膜具有更致密均匀的表面结构;马静蓉等[14]研究发现TGase 和辅料可以提高鸢乌贼鱼糜凝胶特性;程琳丽等[15]研究发现TGase 具有明显的保水作用,当TGase 质量分数在0.6%时能有效保持鱼肉的持水性能,提高鱼肉品质。
氧化和TGase 均会促进蛋白质分子内或分子间的交联,蛋白质分子的聚集会影响重组鱼肉品质和消化性[16],因此有必要探究蛋白质氧化和TGase 对其品质及体外模拟消化的影响。张海璐等[17]研究发现随着蛋白质氧化时间的延长,持水性、凝胶特性和质构特性均降低;姜晴晴等[18]研究发现羟自由基氧化体系可以加速带鱼蛋白质和脂肪的氧化,但适度的氧化对高蛋白质体外消化率有促进作用。本研究通过测定质构、色差、持水力来探究蛋白质氧化和TGase 对重组鱼肉品质的影响;通过测定干物质消化率、蛋白质消化率、BCA蛋白浓度来探究蛋白质氧化和TGase 对重组鱼肉体外消化的影响,为草鱼的保鲜贮藏提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜草鱼、NaCl(食品级),购于杭州教工路物美超市。
谷氨酰胺转氨酶(食品级),江苏一鸣生物有限公司;黏蛋白酶、过氧化物酶等(生物试剂),美国Sigma 公司;胃蛋白酶、胰酶等(生物试剂),国药集团化学试剂有限公司;KCl、KSCN、NaHCO3等(分析纯),国药集团化学试剂有限公司;BCA 试剂盒(生物试剂),碧云天生物技术有限公司。
1.2 仪器与设备
电子天平(BSA124S-CW),赛多利斯科学仪器(北京)有限公司;恒温水浴锅(JOANLAB),宁波市群安实验仪器有限公司;美的多功能电磁炉,美的集团有限公司;紫外可见分光光度计,赛默飞世尔科技(中国)有限公司;均质机(FJ200-S),上海力辰科技有限公司;酶标仪(SPECTRA MAX190),美国分子仪器有限公司;冷冻离心机(HETTICH 420R),德国HETTICH 公司;质构仪(TMS-PRO),美国FTC 公司;色差仪(Color Quest XE),美国HunterLab 公司。
1.3 试验方法
1.3.1 样品制备
1.3.1.1 草鱼鱼肉重组 对照组样品:向草鱼碎肉中加入2.0% NaCl,机器混匀,入模(4 cm×4 cm×4 cm)后40 ℃水浴凝胶3 h;试验组样品:向草鱼碎肉中加入2.0% NaCl 和1 U/g TGase,机器混匀,入模(4 cm×4 cm×4 cm)后40 ℃水浴凝胶3 h。水浴结束后,于4 ℃冰箱过夜,次日沸水浴100 min。
1.3.1.2 重组鱼肉氧化处理 参考Huang 等[19]的方法并适当修改,将预处理后的重组鱼肉样品均匀切成4 份,吸干其表面水分,置于Fenton 氧化体系(1.0 mmol/L FeCl3、10 mmol/L H2O2和0.1 mmol/L 抗坏血酸(Ascorbic Acid)),样品与氧化液比例为2∶1(g/L)。分别于25 ℃恒温水浴中密封避光氧化 0,1,3,5 h,添加1.0 mmol/L EDTA 溶液10 mL,螯合氧化体系中剩余的Fe2+,终止反应。置于4 ℃冰箱中2 h 后备用。
1.3.2 肌原纤维蛋白提取及氧化性测定 参考Lin 等[20]方法并适当修改,取1.3.1.2 节中的重组鱼肉2 g,加入20 mL 超纯水,均质并离心,向沉淀中加入20 mL 50 mmol/L KCl,均质并离心,沉淀用20 mL 0.6 mol/L KCl- 20 mmol/L Tris-马来酸(pH 7.0)溶解,均质后于4 ℃提取1 h,离心取上清液。上述所有均质条件为:10 000 r/min、30 s;离心条件为:4 ℃、8 000×g、10 min。
1.3.2.1 羰基含量的测定 参考颜明月[21]、Koutina等[22]方法并适当修改,取1.3.2 节中的肌原纤维蛋白溶液用0.6 mol/L KCl-20 mmol/L Tris-马来酸(pH 7.0)稀释至2 mg/mL,加入1 mL 10 mmol/L DNPH,空白组加入1 mL 2 mol/L HCl。在磁力搅拌器上37 ℃摄氏度水浴1 h,结束后加入1 mL 20% TCA 溶液,再水浴10 min,然后离心,用1 mL 1∶1 的乙醇-乙酸乙酯(V/V)洗涤沉淀3 次,用3 mL 6 mol/L 盐酸胍溶解沉淀,37 ℃水浴30 min,离心,取上清液,测其在370 nm 处的吸光值,每个样品平行测定3 次。上述所有离心条件为:4 ℃、8 000×g、10 min。
1.3.2.2 总巯基含量的测定 取1.3.2 节中提取的肌原纤维蛋白溶液用0.6 mol/L KCl-20 mmol/LTris-马来酸(pH 7.0)稀释至5 mg/mL。总巯基含量的测定参照曹淑敏等[23]、仪淑敏等[24]方法。
1.3.3 质构特性的测定 参考Chanarat 等[25]方法并适当修改,利用质构仪程序中TPA 进行测定。将氧化后的重组肉切成2 cm×2 cm×2 cm 的正方体,采用P5 圆柱形探头测定,每个样品平行测定3 次。TPA 参数设置为:测试速度:60 mm/min;触发力:0.1 N;形变量:75%。记录各质构特性指标。其中凝胶强度(g·mm)=破裂力(g)×破裂位移(mm)。
1.3.4 色差的测定 用全自动色差仪对样品进行测定,分别记录L*、a*、b*值,用下式计算白度值,每个样品平行测定3 次。
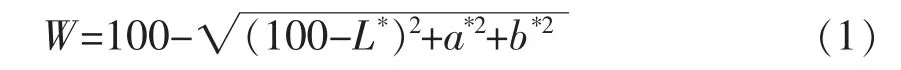
1.3.5 持水力的测定 参考Cando 等[26]方法并适当修改,取重组鱼肉约2 g 切成小块,然后用3层滤纸包裹,放入离心管中,离心(4 ℃、3 000×g、10 min)。每个样品平行测定3 次。
1.3.6 体外模拟消化模型 参考Van 等[27]、胡吕霖等[28]模拟消化液配制方法并适当修改,具体如表1所示。称取5 g 重组鱼肉,加入15 mL 模拟胃液(pH 2.0±0.2,含胃蛋白酶),37 ℃恒温振荡器消化1 h;再加入15 mL 模拟肠液(pH 8.0±0.2,含胰蛋白酶),37 ℃恒温振荡器消化2 h。消化结束后100 ℃水浴5 min,待冷却后加入15 mL 无水乙醇,4 ℃冰箱冷藏过夜后,8 000×g 离心20 min,分别留取胃消化后及经过整个消化过程的上清液和沉淀,存于-80 ℃超低温冰箱待用,每个样品重复3次消化试验。
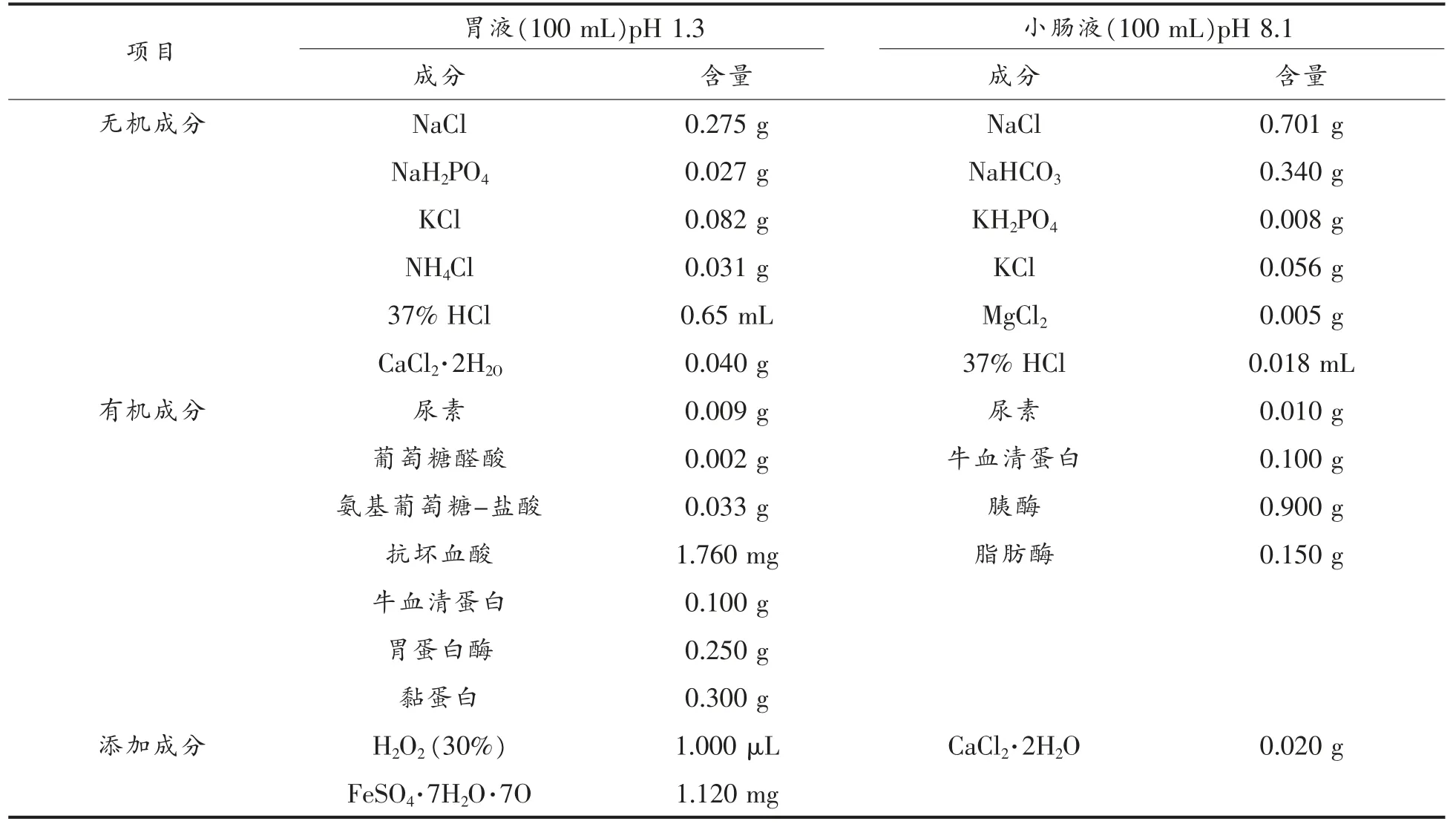
表1 模拟消化液(唾液、胃液、肠液)成分Table 1 Compositions of digestive juices used for in vitro digestion
1.3.7 消化率测定
1.3.7.1 干物质消化率 参考Fang 等[29]的方法并适当修改,分别称取1 g 消化前的样品和1 g 消化后的样品,于105 ℃烘箱,烘至恒重,称量,干物质消化率计算公式如下:

式中:W0——消化前的干物质含量,g;W1——消化后的干物质含量,g。
1.3.7.2 蛋白质消化率 参考韦婕妤等[30]的方法并适当修改,取消化前和消化后样品各5 g 左右,于烘箱50 ℃烘至恒重。分别取消化前烘干样品和消化后烘干样品进行凯氏定氮。蛋白质消化率计算方程如下所示:
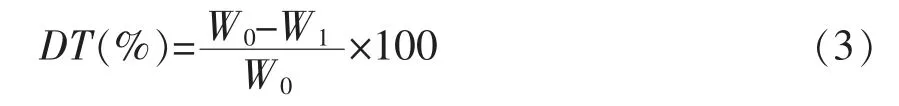
式中:DT——蛋白质体外消化率,%;W0——消化沉淀中蛋白质的含量,g;W1——消化前重组鱼肉中蛋白质的含量,g。
1.3.7.3 BCA 蛋白浓度 用BCA 试剂盒测定消化后上清液中蛋白质浓度。以全蛋白提取液在562 nm 下吸光度为空白对照。参考李黎[31]的方法并适当修改,标准曲线配制如下。
1.4 数据处理
用One-way ANOVA 进行方差分析和显著性检验,由P<0.05 判定存在显著差异。作图使用origin 8.5 软件。
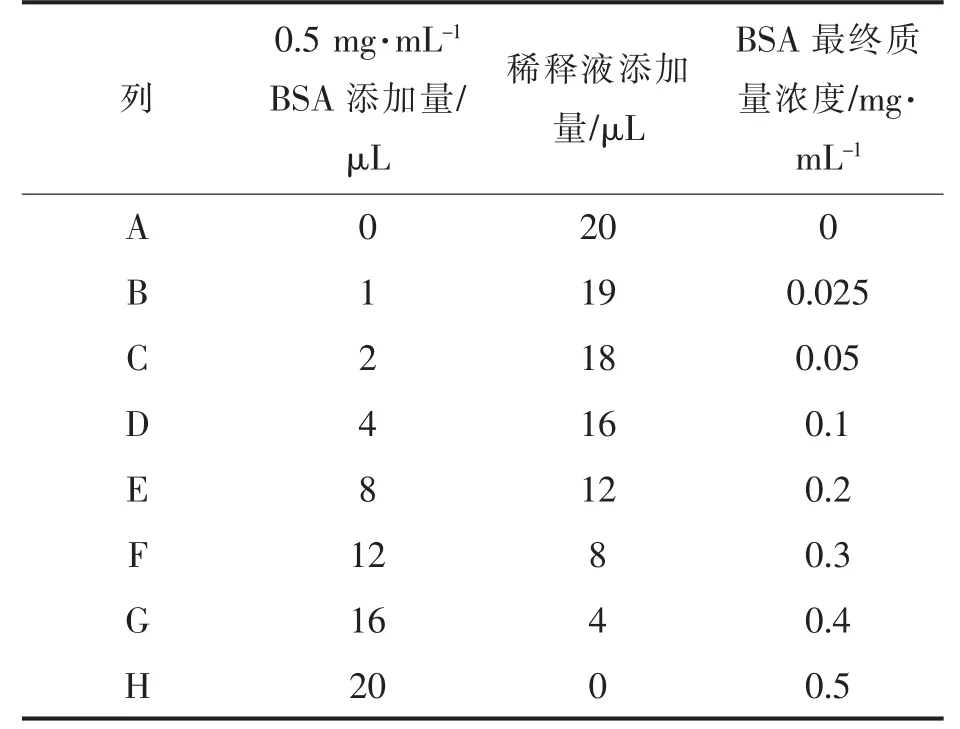
表2 稀释蛋白浓度标准曲线Table 2 Preparation of diluted albumin(BSA)standards
2 结果与讨论
2.1 肌原纤维蛋白的羰基与总巯基变化
由图1 可知,羰基含量与氧化时间呈正相关(P<0.05),总巯基含量与氧化时间呈负相关(P<0.05)。羰基含量作为判定蛋白质氧化的主要指标,随着氧化时间的延长其含量上升,主要因为羟自由基与氨基酸侧链或肽链不断发生氧化[32],这与朱文慧等[33]研究结果一致。总巯基含量也常常被认为是判定蛋白质氧化程度的一个指标,蛋白质中的半胱氨酸残基以游离巯基形式或氧化的胱氨酸形式存在,当样品置于氧化体系时,导致总巯基含量下降[34]。由图1 还可知,试验组羰基含量明显低于对照组,试验组的总巯基含量明显高于对照组,这表明加入TGase 会加速蛋白质的氧化,可能是因为加入TGase 导致蛋白质结构的改变,从而改变了铁离子的结合位点,从而使铁离子和过氧化物靠近,并引发氧化[35],这与Moreno 等[7]研究结果一致。

图1 羰基和总巯基含量的变化Fig.1 Change in carbonyl and total sulfhydryl content
2.2 蛋白质氧化对重组鱼肉质构特性的影响
由表3 可知,随着氧化时间的延长,硬度、弹性、咀嚼性、胶黏性、凝胶强度均下降。硬度、弹性、咀嚼性的降低,可能是因为氧化引起蛋白质分子内或分子间构象发生改变[36];胶黏性、凝胶强度的降低,可能是因为蛋白质在氧化过程中发生了去折叠反应,导致其三维结构发生破裂,也可能是由于蛋白质分子内或分子间二硫键遭到破坏[34],从而使胶黏性和凝胶强度降低。且试验组的各项指标值均高于对照组,这可能是因为加入TGase 可促进蛋白质分子内或分子间交联,有利于蛋白质三维结构的稳定[37]。这与娄忠纬[38]研究结果一致。有报道指出,存在TGase 的情况下蛋白质氧化时凝胶特性会下降[7],对比表3 可知,试验组中凝胶强度下降幅度更大。
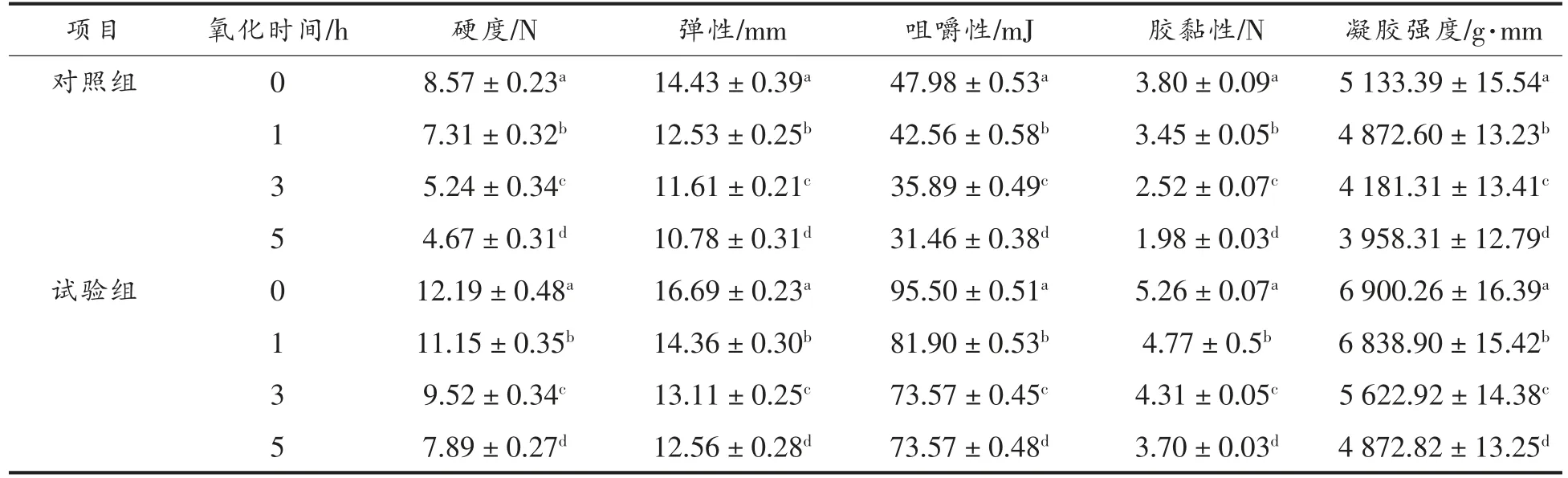
表3 蛋白质氧化对重组鱼肉质构特性的影响Table 3 Effect of protein oxidation on textural properties of restructured minced grass carp
2.3 蛋白质氧化对重组鱼肉色泽的影响
由表4 可知,随着氧化时间的延长色度值L*、a*、W均下降。蛋白质的白度可以间接反映蛋白质变性情况,蛋白质的氨基酸可能会与其氧化产物相互作用,从而导致其白度值下降[17]。Nyaisaba等[39]研究发现鳕鱼鱼糜凝胶的白度会随氧化程度的增加而下降,本试验研究结果与其一致。由表4还可知,试验组的白度比对照组高,这可能是因为TGase 的加入影响凝胶的微观结构,使其孔隙更小、更均匀,不透明性增加,光吸收能力降低,从而有较高的白度[40]。这与何芳[37]研究结果一致。

表4 蛋白质氧化对重组鱼肉色差的影响Table 4 Effect of protein oxidation on color changes of restructured minced grass carp
2.4 蛋白质氧化对重组鱼肉持水力的影响
持水率作为评价凝胶制品优劣的重要指标,持水率越高表明凝胶保持内部游离水分的能力就越强[41]。由图2 可知,随着氧化时间的延长,对照组和试验组的持水率均下降,氧化1 h 时持水率显著降低(P<0.05);这可能是因为蛋白质原有的三维网络结构被破坏,分子间发生解聚,持水率下降。这与李学鹏等[5]研究结果一致。由图2 还可知,试验组的持水率比对照组高,可能是因为添加TGase 促进蛋白质分子内或分子间的交联,从而形成更稳定的三维网络结构[42],这与Chanarat 等[25]研究结果一致。

图2 蛋白质氧化对重组鱼肉持水性的影响Fig.2 Effect of protein oxidation on water-holding capacity of restructured minced grass carp
2.5 蛋白质氧化对体外消化率的影响
食物的生物利用度通常通过胃蛋白酶的消化率来评估,即胃蛋白酶分解后的干物质分解的容易程度和颗粒大小。由于蛋白质在穿过小肠壁进入血液之前必须分解成氨基酸或小肽,因此肉类和肉类产品的营养质量在很大程度上取决于蛋白质的消化率[43]。蛋白质氧化可能会通过改变蛋白质疏水性、聚集性和二级结构来改变体外消化率[44]。由表5 可知,在胃消化和肠消化过程中,对照组和试验组的干物质消化率、蛋白质消化率、BCA 蛋白浓度均呈现先增加后减小的趋势,这可能是因为前期氧化导致蛋白质分子结构发生变化,从而暴露出更多消化酶的作用位点,但随着氧化时间的延续,蛋白质分子内或分子间不断聚集,从而掩藏了消化酶的作用位点,蛋白质消化率降低[42]。这与姜晴晴等[18]研究结果一致。同时,胃蛋白酶和胰蛋白酶都有其特定的作用位点,当作用位点附近的氨基酸被氧化时,蛋白质消化率也下降[43]。由表5 还可知,试验组样品消化率均低于对照组,这可能是因为加入TGase 促进蛋白质分子的聚集,蛋白质被不同程度的修饰,TGase 形成的异肽键对水解酶具有抵抗力,且加入TGase 会促进蛋白质发生不同程度的氧化,从而使蛋白质消化率较低[35]。
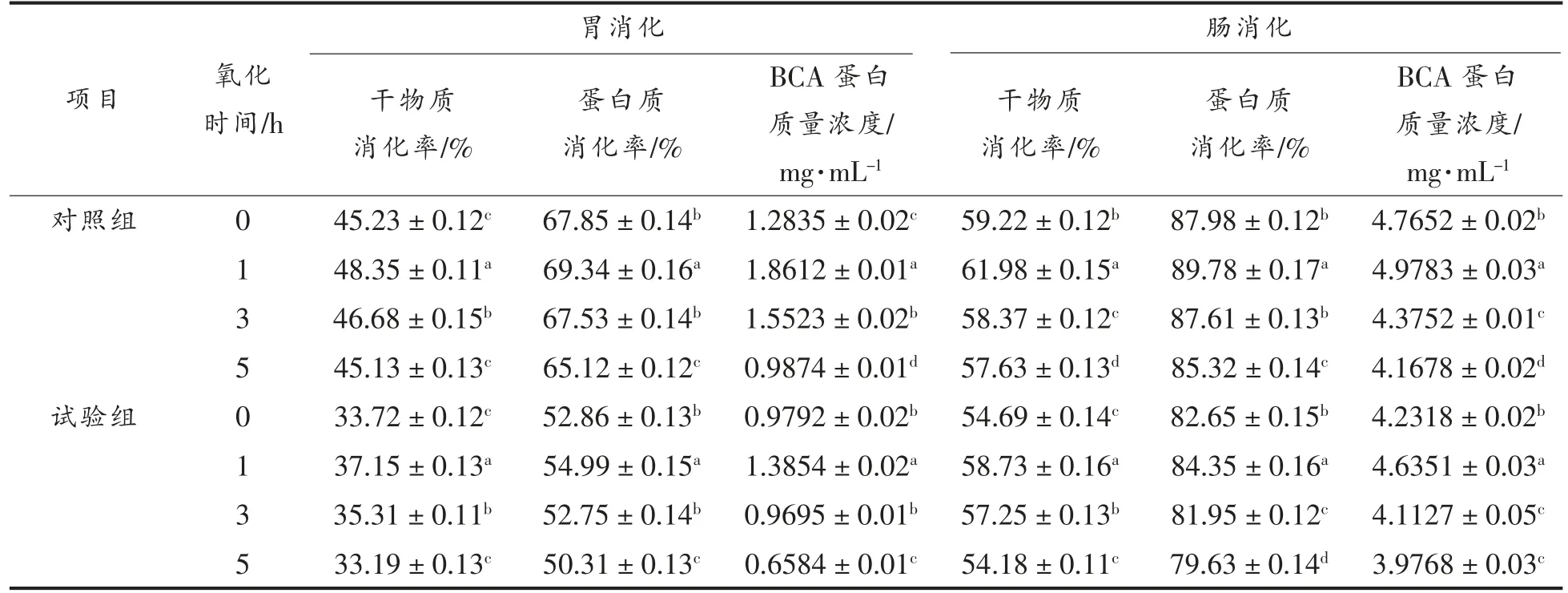
表5 蛋白质氧化对重组鱼肉体外消化率的影响Table 5 Effect of protein oxidation on in vitro simulated digestion of restructured minced grass carp
3 结论
本试验研究了蛋白质氧化和TGase 对草鱼重组鱼肉品质及体外模拟消化的影响,结果表明重组鱼肉肌原纤维蛋白羰基含量与氧化时间成正比,总巯基含量与氧化时间成反比,且加入TGase会加速其氧化。随着氧化时间的延续,重组鱼肉品质发生劣变,硬度、弹性、咀嚼性、胶黏性、凝胶强度、L*值(亮度)、a*值(红度)、W值(白度)和持水性均降低。蛋白质氧化也会导致重组鱼肉消化性发生改变,氧化前1 h 各消化率均上升,随着氧化时间的延长而下降,虽然适当的氧化可以提高消化率,但蛋白质氧化会导致食物营养成分的流失,因此实际加工生产中蛋白质氧化对重组鱼肉品质的影响还需要进行深入研究,以期为草鱼综合利用提供理论支持。
