果实角质层研究进展
2021-10-19刘港帅李泓利田慧琴傅达奇
刘港帅,李泓利,田慧琴,傅达奇
(中国农业大学 食品科学与营养工程学院 果实生物学实验室 北京100083)
角质层是水生植物向陆生植物的进化过程中,为适应陆地相对干燥、温度波动范围大、紫外辐射强烈等环境特点,由植物气生器官表皮细胞合成并覆盖于其表面的一层疏水性结构。它可将植物的气生器官与外界胁迫因素相对隔离,从而保护植株正常的生长发育[1]。由于研究方法的缺乏,在过去很长一段时间,植物角质层的重要性被忽视。目前,植物角质层的研究受到广泛关注,但大多数的研究集中于模式植物拟南芥、番茄等的营养器官,对于果实角质层的研究不够深入、全面,而果实角质层对果实的生理状态和品质形成具有重要的调节作用,例如可有效抵御外界病虫害,平衡果实内部膨压,减缓果实采后失水[2],因此研究果实角质层可为提高果实采前品质和采后贮藏性能提供重要的理论基础。本文整理近年来的文献报道,对果实角质层的组成、功能、生物合成、调控及研究方法5 个方面进行综述,为未来果实角质层的深入研究提供研究思路。
1 果实角质层的组成
果实角质层主要由角质基质和覆盖并嵌入其中的蜡质两部分组成[3-4]。角质是由羟基化或环氧羟基化的脂肪酸(C16和C18,其中C16主要是9,16-二羟基棕榈酸和10,16-二羟基棕榈酸,C18主要是9,10,18-三羟基硬脂酸和9,10-环氧,18-羟基硬脂酸)共价连接而形成的聚酯[5-6]。蜡质是由长链和超长链脂肪酸及其烃类、醇类、醛类、酮类、酯类、三萜类、甾醇类化合物等各类衍生物所组成的混合物[3]。此外,角质层还含有一定数量的酚类化合物和来源并定位于表皮细胞细胞壁,整合在角质基质中的多糖[7-8]。一些果实的角质层中还可能含有无法水解的胶膜,这是一类由脂肪族化合物通过醚键连接形成的非酯网状核心基质[9]。在植物的不同物种之间和相同植物的不同器官之间,角质和蜡质的含量及其组成成分都存在差异[1]。不同种类果实角质层中的角质主要单体和蜡质主要成分在之前的研究中已被先后分析阐明,并在Lara 等[3]的综述中进行了详细汇总。
2 果实角质层的功能
2.1 抵御非生物和生物胁迫
果实角质层的主要功能之一是抵御内部和外界非生物和生物胁迫,在果实的发育和成熟阶段,果实角质层通过调整自身结构和成分以承受果实不断膨大和细胞壁降解所带来的内部膨压,以保持果实的完整性[2]。此外,果实角质层作为一种天然屏障将果实与外界环境相对隔离,其中,角质、多糖、酚类物质分别为角质层提供延展性、刚度、硬度等机械性能。同时,蜡质(主要为其中的烷烃)和多糖可以增加果实的持水能力。蜡质和酚类物质可以过滤紫外线。而角质和蜡质又可作为一种温度调节器,维持植物体自身的温度稳定[3,10]。因此果实角质层有利于避免或减轻例如干旱、紫外线辐射、温度波动、各类病虫害、机械挤压和碰撞等外界胁迫对果实本身造成的伤害,这种保护作用可能还与角质层对外界信号的敏感性相关,角质层通过接收外界信号并转导至植物体内以激活植物体内的生理应答,进而增强植物体对各类外界胁迫的抗性[11-13]。
2.2 减缓果实采后失水
另一方面,近年的研究表明,果实角质层对于调控果实的采后品质也具有重要的作用[2]。在果实的采后贮藏过程中,失水是导致其品质劣变的重要因素,而果实水分损失程度的主要决定因素之一是覆盖于果实外表皮的角质层[14-15]。“delayed fruit deterioration(dfd)”基因型的番茄果实由于其果实角质层的组成和性质发生改变,导致角质层透性降低,果实的持水能力增强,从而延缓了采后果实的软化和品质劣变[14]。Romero 等[16]发现,水分胁迫条件诱导“Ailsa Craig(AC)”和“M82”番茄果实上调了角质层生物合成相关基因的表达,导致角质层含量增加,并降低了角质层的透性,因此降低了采后果实的蒸腾速率,进而延缓了果实的软化,在一定程度上延长了“AC”和“M82”番茄果实的货架期。柑橘果实表皮的角质层可防止水分流失、抵御外界微生物侵入、调节生理代谢,从而有效保护柑橘果实的采后贮藏品质[17]。在生产中,也经常通过在果实表面打蜡以减少果实采后的水分损失,从而延长果实的采后贮藏期[18]。一些转基因技术的应用也证实果实角质层与果实采后失水密切相关。罗志丹[19]利用RNAi(RNA interference,RNAi)技术沉默“中蔬6 号”番茄中一个非特异性脂转移蛋白(nsLTP),发现nsLTP沉默会影响角质层生物合成途径中关键酶基因CYP86和MS2的表达模式,并与参与角质层形成的关键转录因子CD2 互作来调控番茄果实蜡质的合成与沉积,nsLTP沉默株系番茄果实角质层蜡增厚,蜡质组分与野生型相比存在明显差异,且在采后贮藏阶段失水率较低,表现出良好的持水性。转录因子FUL1 和FUL2 属于MADS-box 家族,参与番茄果实成熟调控且功能冗余,利用RNAi 技术共沉默“Micro-Tom”番茄果实中的FUL1和FUL2,通过转录组分析发现转基因株系番茄果实的角质层代谢发生改变,且与野生型果实相比,转基因株系果实的采后失水率增加[20]。同时,最近的研究发现,果实角质层的组成、结构和特性在果实采后处于一个动态的变化过程,不同果实种类及同一种类不同品种之间,角质层的动态变化过程都存在明显差异,并显著影响果实采后的贮藏性能[21-25]。
3 果实角质层的生物合成
3.1 脂肪酸的生物合成
脂肪酸是角质和蜡质生物合成的共同前体,通过从头合成途径在质体中合成,其中,脂肪酸合酶系统(FAS,一种多酶复合体,包括1 种酰基载体蛋白(ACP)和6 种酶:乙酰CoA:ACP 酰基转移酶(AT)、丙二酸单酰CoA:ACP 转移酶(MT)、β-酮脂酰-ACP 合酶(KS)、β-酮脂酰-ACP 还原酶(KR)、β-羟脂酰-ACP 脱水酶(HD)、烯酯酰-ACP还原酶(ER))为该生物合成途径的主要催化工具。下面对脂肪酸前体的生物合成途径作简要概述(图1)。
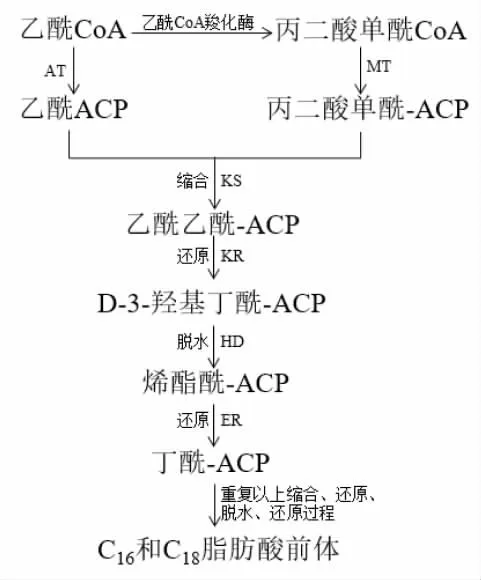
图1 脂肪酸前体的生物合成途径[26-29]Fig.1 Biosynthetic pathway of fatty acid precursors[26-29]
首先,乙酰CoA 在乙酰CoA 羧化酶的作用下生成丙二酸单酰CoA,然后在FAS 作用下,乙酰CoA 转化为乙酰-ACP(AT 催化),丙二酸单酰CoA 转化为丙二酸单酰-ACP(MT 催化)。此后先后经历乙酰-ACP 和丙二酸单酰-ACP 的缩合(KS催化)、乙酰乙酰-ACP 的还原(KR 催化)、D-3-羟基丁酰-ACP 的脱水(HD 催化)、烯酯酰-ACP 的还原(ER 催化)这四个过程生成丁酰-ACP。丁酰-ACP 重复经历上述缩合、还原、脱水、还原这四个循环过程而不断获得丙二酸单酰-ACP 的二碳单位,进而形成C16和C18等长链脂肪酸。其中饱和的C16和C18脂肪酸为蜡质生物合成的主要前体,C16:0和C18:x羟基脂肪酸为角质生物合成的主要单体[26-29]。
3.2 角质的生物合成
角质单体的生物合成在内质网中进行,首先C16和C18前体通过酰基-ACP 硫酯酶去除ACP,再通过长链酰基-CoA 合成酶(LACS)连接CoA 进行活化[27-28,30]。角质生物合成的前体长链脂肪酸向角质单体转化的过程中,细胞色素P450 酶家族催化了转化过程中羟基化和环氧化过程,其中CYP77A,CYP86A 和CYP94B 亚家族负责链中和链末端的羟基化过程[31-35]。甘油-3-磷酸酰基转移酶如GPAT6 负责角质单体向单脂酰甘油转化[36],而单脂酰甘油通过ABCG 运载体如ABCG36 和ABCG42 被转运至胞外(未酯化的ω-羟基十六烷酸和十六烷二酸也可作为潜在的角质前体被转运至胞外)[37],随后在定位于胞外的酰基转移酶如CD1/GDSL1/CUS1 的作用下连接到已有角质聚合体游离的ω-羟基上,形成酯键,这个过程需要消耗ATP。而角质聚合单链中的链中羟基则参与酯链间的交叉连接从而形成最终的复杂网状聚合物结构[6,38-41]。主要存在于质膜附近和外层表皮细胞壁的角质小体也被发现参与角质的生物合成,角质小体是由酯化的角质单体形成的自组装粒子,主要在果实发育前期的细胞分裂阶段参与角质的形成,并为细胞膨大阶段依赖于酰基转移酶的进一步角质聚合提供模板[41]。同时,近期研究发现,聚合角质可在角质:角质脂肪酸内转酰酶(CCT)的作用下发生裂解与重组[42],在角质:木葡聚糖转移酶(CXT)的作用下与表皮细胞壁多糖形成共价连接[43](图2)。
3.3 蜡质的生物合成
在蜡质的生物合成过程中,C16和C18前体同样需要通过酰基-ACP 硫酯酶和LACS 活化为脂酰CoA 的形式,才能进一步在内质网延长为超长链脂肪酸[27-28,30]。脂肪酸延长酶(FAE,一种多酶复合物,主要包括β-酮脂酰-CoA 合成酶(KCS)、β-酮脂酰-CoA 还原酶(KCR)、β-羟脂酰-CoA 脱水酶(HCD)、烯脂酰-CoA 还原酶(ECR))为脂肪酸前体进一步延长的主要工具。活化后的脂酰CoA 在ATP 存在的情况下,先后经历与丙二酸单酰CoA缩合(KCS 催化)、还原(KCR 催化)、脱水(HCD 催化)、还原(ECR 催化)这四个类似于脂肪酸从头合成途径的循环过程,从而不断获得丙二酸单酰CoA 的二碳单位以形成长链及超长链脂肪酸。而超长链脂肪酸可以通过脱羰基途径和酰基还原途径形成醛、烃、醇、酮、酯、三萜、甾醇等各类衍生物,即蜡质的主要成分[44-46]。目前,SlCER6[47-48]和StKCS6[49]被报道分别参与番茄果实和马铃薯块茎表皮蜡质的生物合成,其编码一个蜡质生物合成过程中的KCS,优先负责C28以上脂肪酸链的延长。而CsCER1和CsWAX2/CER3可能参与脱羰基途径,在黄瓜果实角质层尤其是超长链烷烃的生物合成中起到重要作用[50-51]。SlTTS1和SlTTS2被报道编码番茄中两个氧鲨烯环化酶(oxidosqualene cyclases,OSCs),其负责三萜生物合成的第一步,催化环氧角鲨烯环化成各种三萜醇异构体。酵母表达系统和番茄的过表达系统分析表明,SlTTS1 是一种产物特异性的β-amyrin 合成酶,而SlTTS2 是一种多功能的OSC,其主要产物为δamyrin[52](图2)。苹果中鉴定出的MdOSC1、MdOSC4、MdOSC5和CYP716A175参与苹果果实三萜类物质的生物合成并控制三萜类产物的相对比例,其中MdOSC1、MdOSC2、MdOSC3 均为多功能的OSC,而CYP716A175 是一个多功能的三萜C-28 氧化酶,负责将三萜氧化为各类三萜酸[53]。
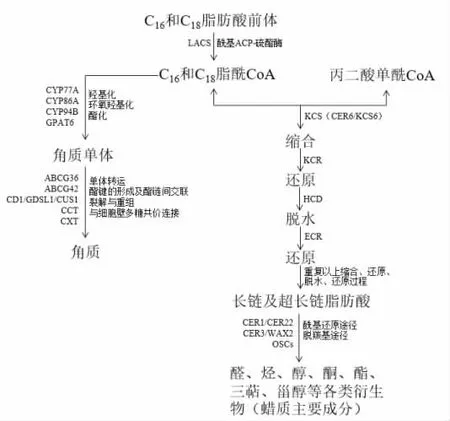
图2 角质和蜡质的生物合成途径[6,27-28,30-53]Fig.2 Biosynthetic pathway of cutin and wax[6,27-28,30-53]
3.4 果实角质层形成的候选基因
果实角质层生物合成途径除上述已经阐明的部分,目前通过生物信息学比对、多组学联合、实时荧光定量PCR(RT-qPCR)等多种分析技术,获得了许多参与果实角质层形成的候选基因,例如黄瓜中的CsCER4[54],甜樱桃中的PaWINA、PaWINB、PaLipase、PaLTPG1、PaATT1、PaLCR、PaGPAT4/8、PaLACS1、PaLACS2、PaCER1[55],越桔中的CER26-like、FAR2、CER3-like、LTP、MIXTA、BAS[56],枣中的BCCP2[57],苹果中的CER1、CER2、CER4、CER10、LACS2、KCS7/2、LCR、FDH、PAS2、WBC11、LTPG1、WIN1、SHINE2、MYB30[58-64],柑橘中的KCS6、CER3、CER1-1、MYB96、GL1-like[65-66],芒果中的MiSHN1、MiCD2、MiCER1、MiCER2、MiCER3、MiKCS2、MiKCS6、MiWBC11、MiLTP1、MiLTP2、MiLTP3、MiLTPG1、MiCUS1、MiCUS2、MiPEL1[24],番茄中的SlSHN1、LIN5[67-68],这些基因被预测在果实角质层生物合成中发挥重要作用,但仍需通过转基因等生物技术手段进一步验证其功能。
4 果实角质层的调控
直接参与果实角质层生物合成过程的关键基因在前述内容已经进行介绍,本节主要综述近年来报道的转录因子及植物激素层面对果实角质层形成的调控作用。
4.1 转录因子调控
在果实发育和成熟的进程中,果实角质层的成分和结构处于一个动态的变化过程,这是果实角质层代谢相关基因时空特异性表达的综合结果,而这种基因的时空特异性表达很大程度上取决于转录因子的转录调控,因此,对角质层代谢相关转录因子的挖掘及其靶基因的鉴定是未来果实角质层研究中的重点内容。随着近年基因编辑、角质层分析等生物技术的快速发展,在角质层代谢的转录调控研究上也取得了一定进展。例如,HDZip IV 家族中的CD2 是第一个在番茄果实中通过图位克隆鉴定的参与角质层代谢的转录因子,其可能通过对角质装配过程中关键基因进行转录调控从而参与角质层代谢。“cd2”突变体番茄果实角质层的角质含量降低了95%~98%[69-71]。同时在番茄果实中,AP2 家族的转录因子SHN3 也被证明通过调控角质层代谢和表皮细胞结构的一系列相关基因参与果实角质层的发育,SHN3 在绿熟期番茄果实的外果皮表达活跃,沉默SHN3 会导致番茄果实角质层中角质和蜡质含量显著降低[72-73]。此外,Giménez 等[74]通过RNAi 技术大幅降低MADS-box 家族转录因子TAGL1 在番茄果实中的丰度,发现TAGL1 沉默显著影响番茄果实的角质层发育,沉默株系果实角质层的厚度、刚度及角质层主要组分(角质、蜡质、多糖、酚类化合物)含量显著降低,进一步研究发现,TAGL1 通过调控番茄果实中CD2、CER6、SHN1、SHN3等角质层合成中关键基因的表达以参与番茄果实角质层的发育。此外,MIXTA-like 被发现是番茄果实角质层形成的一个正调控因子,相较于野生型果实,MIXTA-like-RNAi 果实角质层厚度显著降低,果实的采后失重率显著升高,抗病能力下降,表皮细胞模式出现缺陷,进一步研究表明,MIXTA-like作用于SHN3 的下游,并通过调控CYP77A和CYP86A亚家族、LACS2、GPAT4、ATP-BINDING CASSETTE11的表达水平促进番茄果实的角质层形成[75]。将近年来报道的对不同果实角质层形成有调控作用的转录因子及其功能、靶基因和间接调控的基因汇总为表1。
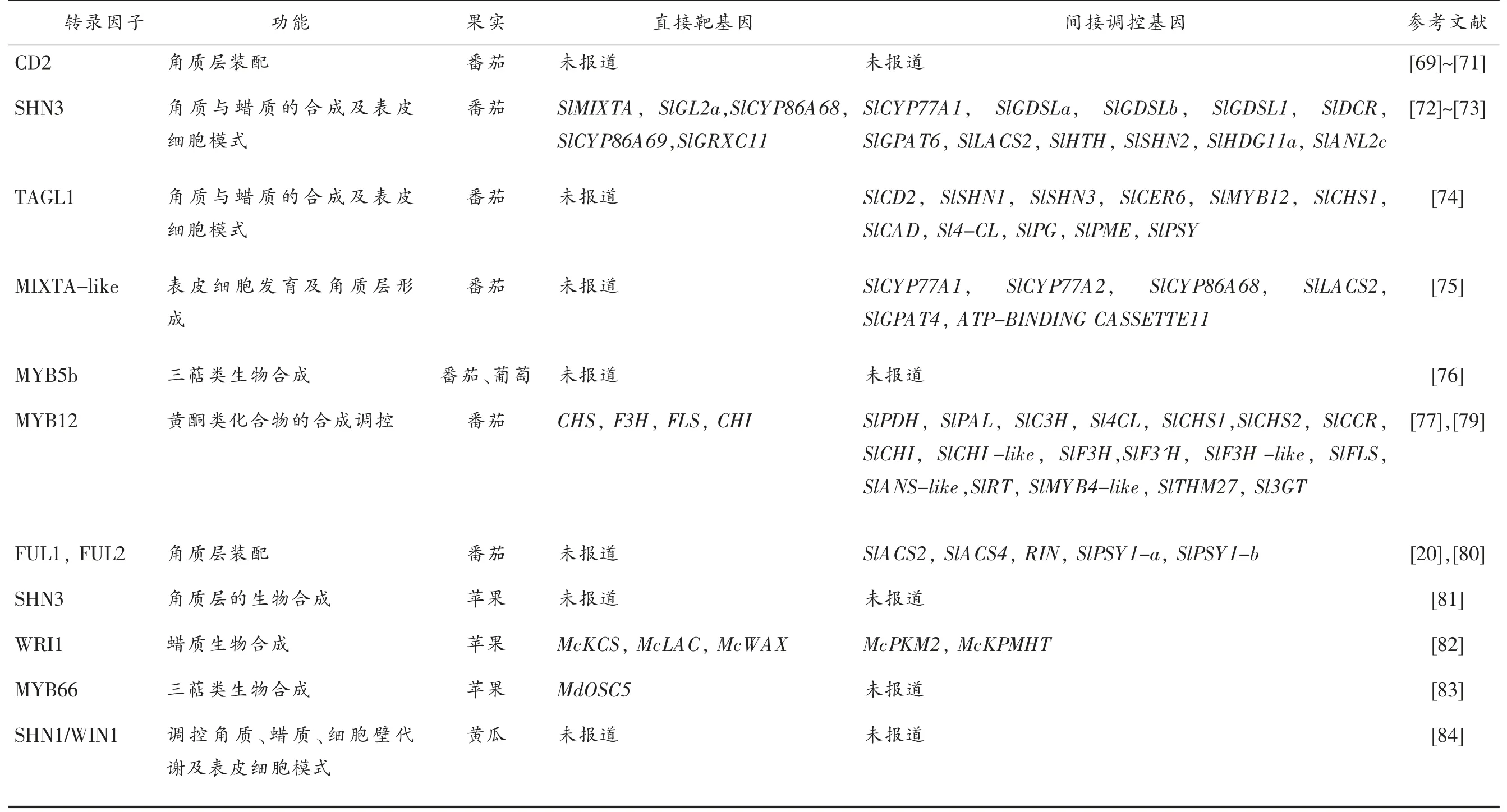
表1 果实角质层形成相关转录因子Table 1 Transcription factors related to cuticle formation in fruits
4.2 植物激素调控
在果实发育和成熟的过程中,果实内部植物激素的水平也在不断变化,果实角质层的发育除了受到一系列转录因子的转录调控外,在一定程度上也受到植物激素的调控,下面对近年来所发现的可能调控果实角质层发育的植物激素进行简要介绍。
4.2.1 脱落酸 水分胁迫会诱导植物体脱落酸的积累,而脱落酸信号则会激活一系列生理响应,例
如促进蜡质的积累来增强植物的持水能力以降低干旱条件对植物体的伤害[85]。而Martin 等[86]的研究表明脱落酸对番茄植株角质层形成的调控作用不单单是干旱诱导的结果,同时也是与器官自然发育进程密切相关的,并不依赖于干旱胁迫的诱导,且发现脱落酸对番茄叶片的调控作用较果实而言更为显著。近期,Romero 等[87]发现,ABA 可通过调控角质层代谢基因的表达模式影响蜡质代谢,ABA 缺乏会导致甜橙果实成熟过程中蜡质组成发生改变,同时角质层透性增加。然而,目前脱落酸对果实角质层的具体调控机制还需要进一步阐明。
4.2.2 赤霉素 目前赤霉素广泛应用于预防由于角质层破损或形成不当诱发的苹果锈果病[88]。研究发现,外源赤霉素处理可有效促进番茄果实和苹果果实表面角质层的沉积[88-89],Li 等[90]研究发现,FIS1 编码一个GA2 氧化酶,该位点的突变将提高番茄果实的活性赤霉素含量,进而诱导提高了一系列角质层形成相关基因的表达水平,从而促进番茄果实角质和蜡质的沉积,但目前赤霉素促进角质层生物合成的具体机制尚不明确。
4.2.3 乙烯 乙烯是呼吸跃变型果实成熟进程中最重要的内源植物激素之一,乙烯信号通过一系列信号转导元件传导至细胞核区,最终启动大量成熟相关基因的表达,促进果实成熟[91]。Kosma 等[92]发现乙烯合成受阻的 “ripening inhibitor(rin)”、“non-ripening(nor)”及一种延迟成熟的地方品种“Alcobaça”3 种突变体番茄果实的角质层组分尤其是蜡质组分相较于“AC”番茄果实存在明显差异,且这种差异贯穿于整个果实发育及成熟进程。Giménez 等[74,93]在番茄中利用RNAi 技术沉默TAGL1,番茄果实乙烯合成受阻,果实无法正常成熟,且沉默株系的果实角质层发育异常。以上研究结果提示,果实角质层的发育是果实成熟进程的一部分,而乙烯可能通过调控果实成熟相关基因控制果实成熟,进而调控果实角质层的发育。然而目前尚未有研究直接证明乙烯和果实角质层发育之间的相关性。
5 果实角质层的研究方法
5.1 果实角质层研究的材料选择
在早年有关于角质层的组成、结构、生物合成与调控的研究发现大都是基于拟南芥模型,但是拟南芥的角质层存在过薄、易碎、含有气孔的特点,这并不利于角质层的生物学研究[94]。而番茄果实的角质层较厚、表面连续、不含气孔、易于分离,且对番茄果实角质层的研究将有助于推动理解角质层对肉质果实生理和品质的作用机制,因此对于果实角质层的研究来说,番茄是一种更加合适的模式植物[1,47]。
5.2 果实角质层研究的试验技术
5.2.1 果实角质层的分离 果实角质层的分离是研究果实角质层的基础。目前在果实角质层分离上运用最广泛的方法是酶分离法,通常利用不同浓度的酶解液获得果实的角质层,例如果胶酶和纤维素酶的混合酶解液。角质层分离速度主要受到酶浓度、酶解温度和酶解液pH 值的影响,提高酶浓度或温度会加速角质层的分离,而角质层分离速度与酶解液pH 值呈负相关性[11]。此外,角质和蜡质的单独分离技术也在不断改良与创新,目前表面覆盖蜡通常用黏合剂等机械方式剥离,嵌入蜡在表面覆盖蜡剥离后用氯仿等有机溶剂浸提,而角质的提取则在脱蜡果实的基础上用酶解法结合有机溶剂萃取法分离[17,28,86]。
5.2.2 果实角质层的分析 目前已趋于成熟的测试分析技术例如气相色谱法(GC)、气相色谱-质谱联用仪(GC-MS)、气液色谱-质谱联用仪(GLCMS)、甲苯胺蓝染色法、苏丹III 染色法、苏丹IV染色法、金胺O 荧光染色法、光学显微镜、扫描电子显微镜(SEM)、透射电子显微镜(TEM)、原子力显微镜(AFM)等都可用于角质层组分的定性、定量分析和角质层结构勘测,而一些新兴的高精度技术如二维GC、串联色谱分析技术、高温GC(HTGC)、高温GC-MS 联用技术(HTGC-MS)、红外和Raman 显微光谱分析将成为有价值的补充工具进而实现更精确的果实角质层多样性分析[3,74]。而目前成熟的各种分子生物学手段如RT-qPCR与各类高效率的生物技术服务则为阐明果实角质层生物合成与调控网络提供了有力支持。此外,一系列计算机辅助技术也在果实角质层的研究中发挥重要的作用。
5.3 果实角质层的研究思路
果实角质层中的角质和蜡质使得果实表面具有明显的光泽。通过果实表皮亮度改变的表型来识别角质层的突变体,以发现调控果实角质层形成的候选基因[95]。
利用组学技术对果实角质层发生改变的突变体与野生型进行全面分析与比较,找到控制突变的候选关键基因及相关代谢途径[3]。目前大量研究结果提示果实角质层的形成是果实成熟进程中的一部分,因此,可以尝试通过一些基因工程技术例如病毒诱导基因沉默(virus-induced gene silencing,VIGS)技术筛选出一些能够调控果实角质层形成的成熟相关基因,可能的思路如下:
(1)角质层的组学分析,包括利用转录组、代谢组和蛋白组筛选可能参与果实角质层形成的候选基因;(2)通过VIGS 技术高通量筛选候选基因;(3)通过果实贮藏失水和表皮细胞结构观察等试验分析角质层变化;(4)确定候选基因在果实角质层形成网络中的作用。
对拟南芥中已报道的角质层代谢相关基因和番茄果实中已鉴定出的角质层数量性状位点[96]进行转基因功能验证,通过CRISPR/Cas9、RNAi、过表达等转基因技术获得该基因位点的突变体,并对突变体果实的角质层组成、结构,表皮代谢模式进行系统分析,以解析该基因在果实角质层形成中的功能。
6 展望
果实是植物体上极具食用价值和经济价值的繁殖器官,角质层对于保护果实的生长发育和维持其采后贮藏品质具有重要的作用,然而目前对于角质层的研究主要还是集中在拟南芥和番茄等模式植物的叶片等营养器官上,对非模式植物及果实角质层的研究尚不充分。
果实角质层复杂的生物合成和调控网络至今尚不完全清晰,其中涉及的相关分子机制应是今后研究需要重点关注的领域。目前大量研究提示角质层的形成是果实成熟进程的一部分,因此控制果实成熟的相关基因有望成为接下来果实角质层生物合成与调控分子机制的研究方向。
当前研究发现果实角质层组分、结构、特性在采后的变化对于果实的采后贮藏性能具有显著的影响,因此明确重要经济作物果实角质层的采后变化规律对于指导果实采后处理,更好地维持其采后贮藏品质具有重要的意义。
近年来对于果实角质层的组分、结构、功能特性及生物合成与调控的研究虽然取得了长足的进步,但其中还是存在很大的知识空缺,在深入研究的同时应该与果蔬产业链的各个环节相结合,并进一步转化为食用健康价值和社会经济价值。
