雪莲菌颗粒形成机制研究进展
2021-10-19李佳乐毛可敏桑亚新
李佳乐,毛可敏,桑亚新,高 洁
(河北农业大学食品科技学院 河北保定071000)
雪莲菌(Tibet Kefir),又称藏灵菇,是源于我国西藏的一种天然混菌发酵体系,由乳酸菌、酵母、醋酸菌等多种微生物附着在蛋白质、多糖等基质上形成肉眼可见的颗粒[1],对牛乳等具有发酵作用。多菌相的共生发酵使得雪莲菌发酵乳具有独特醇香及起泡性[2],被誉为“香槟酸奶”,深受大众喜爱。不仅如此,国内外多项研究表明,雪莲菌颗粒及其发酵乳具有降脂[3],抑制肿瘤[4],调节胃肠道[5],免疫调节[6]等多种有益功能,并具有良好的抑菌性能[7],在传统的家庭制作过程中,非无菌操作的情况下也能保持自身微生态的稳定。雪莲菌发酵乳作为牧区传统发酵乳制品,未形成规模化生产故仅限于当地民间流行。
雪莲菌粒只在原粒的基础上,以传统的培养方式增殖,不仅增殖速度缓慢,而且其微生态体系为动态平衡,使得发酵过程难以控制,发酵乳风味和品质不均一。目前通过纯培养发酵剂模拟雪莲菌发酵乳的尝试,涉及的菌种组成简单,所得产品无法达到原粒发酵乳所具有的风味和功能特性。曲宜[8]、石海波[9]、刘克营[10]、Chen[11]、Ng[12]等学者致力于人工模拟雪莲菌颗粒的研究,尝试构建菌相组成清晰,发酵过程可控的发酵剂,然而,尚未得到理想的结果。了解雪莲菌粒的形成机制和生长特性,是实现雪莲菌粒人工模拟的必要条件。本文结合国内外的研究进展,以雪莲菌颗粒理化组成为出发点,根据目前已有的雪莲菌颗粒形成机制的相关研究,凝练出生物膜假说、聚集假说、共生假说3 种颗粒形成机制的推论。
1 雪莲菌粒理化组成规律
不同于天然形成的混菌发酵体系,人工重组雪莲菌颗粒,能够形成菌相组成明确,发酵条件可控,发酵乳品质稳定的发酵剂,是实现其规模化生产的必要条件,也是目前亟待打破的瓶颈。尽管不同培养环境雪莲菌颗粒菌相组成差别较大[13],但是通过对多项研究的综合分析发现,其在物理结构、化学组成及微生物组成分布等方面还是具有一定的规律性,为人工模拟雪莲菌颗粒提供了切入点。
1.1 物理结构
雪莲菌粒呈乳白色,颗粒成团,形状不规则,大小不一,粒径在5~20 mm(图1)。雪莲菌粒的生长在宏观上主要体现为菌粒的体积增大、数量增多;而在微观上是其微生物群体的生长和繁殖。为更进一步了解雪莲菌粒的结构,学者们进行了积极探索。Wang 等[14]发现kefir 粒可以打开拉伸成为一层厚的膜状物质(图2)。Lu 等[15]通过显微镜观察发现雪莲菌粒由呈中空球状结构的小颗粒单元组成(图3)。这些研究表明,与花椰菜结构类似,雪莲菌粒是由无数个由膜状物质形成的中空颗粒单元组成。此外,从解剖的角度研究雪莲菌粒(复杂的团状物质),可为进一步揭示雪莲菌粒结构提供参考。
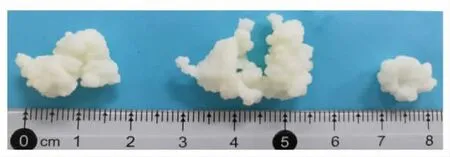
图1 雪莲菌粒的宏观结构Fig.1 Macroscopic structure of Tibet kefir grains
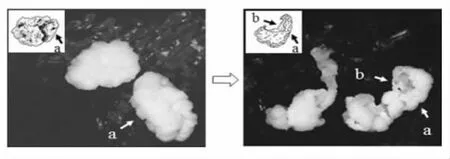
图2 kefir 粒形态[14]Fig.2 Morphology of kefir grain[14]
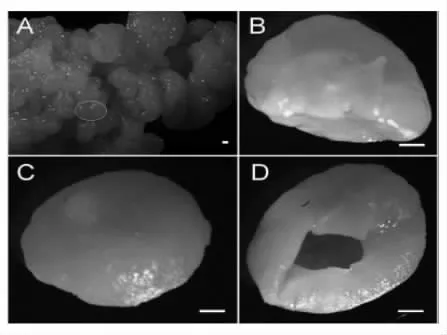
图3 雪莲菌粒的立体显微镜图像[15]Fig.3 Stereomicroscope images of Tibet kefir grain[15]
1.2 化学成分
雪莲菌粒是一种由蛋白质和多糖等物质组成的包含着复杂微生物菌系的特殊共生系统。研究发现,除了80%的水分,kefir 粒含约4%~6%的蛋白质,6%~9%的糖类以及1%~2%的脂肪等[1,16-17]。其中乳酸菌能够分泌生成一类特殊的蛋白质-表层蛋白(surface-layer protein,SLP)以及独特的糖类物质——胞外多糖开菲尔多糖(kefiran)。
在许多真细菌和古生菌的菌株表面都含有一层规则的蛋白质晶体阵列(图4),称为SLP,分子质量为40~200 ku,自组装能力是其关键特性之一[18]。目前已证实多种乳酸杆菌含有SLP[19],如嗜酸乳杆菌(Lactobacillus acidophilus)、短乳杆菌(Lactobacillus brevis)、瑞士乳杆菌(Lactobacillus helveticus)、高加索乳杆菌(Lactobacillus kefir)、类高加索乳杆菌(Lactobacillus parakefir)、卷曲乳杆菌(Lactobacillus crispatus)等,分子质量在25~71 ku 之间,疏水性氨基酸和碱性氨基酸占主体,带正电荷的氨基酸含量高于带负电荷的氨基酸含量,使得乳酸杆菌SLP 的等电点较高(9.4~10.4)[20]。研究发现,短乳杆菌ATCC 14869、卷曲乳杆菌JCM 5810、嗜酸乳杆菌ATCC 4356 等菌株存在多个SLP 编码基因,且这一现象并不是乳酸菌独有[19]。乳酸杆菌SLP 在基因序列上存在一定规律。Malamud 等[21]研究分离自kefir 粒的聚集性和非聚集性高加索乳杆菌表达的SLP 编码基因,发现其基因序列在N-末端区域相对保守,菌株间的主要差异在C-末端区域。尽管分离自不同的kefir 粒,其中的聚合菌株的SLP 还是100%同源的。

图4 透射电镜下SLP 的冰冻蚀刻图[18]Fig.4 Transmission electron micrograph of a freeze-etched preparation of SLP[18]
在kefir 粒中还有一种独特的胞外多糖开菲尔多糖(kefiran),它是由葡萄糖(glucose)和半乳糖(galactose)通过糖苷键连接的水溶性杂多糖(图5),由马乳酒样乳杆菌(Lactobacillus kefiranofaciens)、高加索粒乳杆菌(Lactobacillus kefirgranum)、类高加索乳杆菌、高加索乳杆菌及德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.Bulgaricus)等乳酸杆菌产生[22]。黏度和弹性是kefiran 的两个重要流变特性,kefiran 低质量浓度(4 g/L)时具有牛顿流体特性,而在较高质量浓度时表现为假塑性[22]。对于雪莲菌粒复杂的组成目前还未明晰,而SLP 和多糖的结构解析及特性分析可为揭示其形成机制提供重要参考。
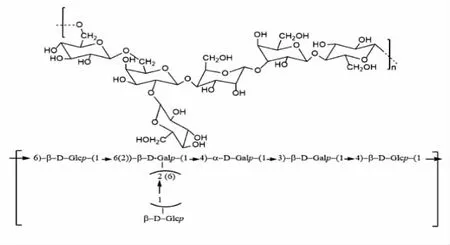
图5 kefiran 化学结构推测[22]Fig.5 Proposed chemical structure of kefiran[22]
1.3 微生物组成及分布
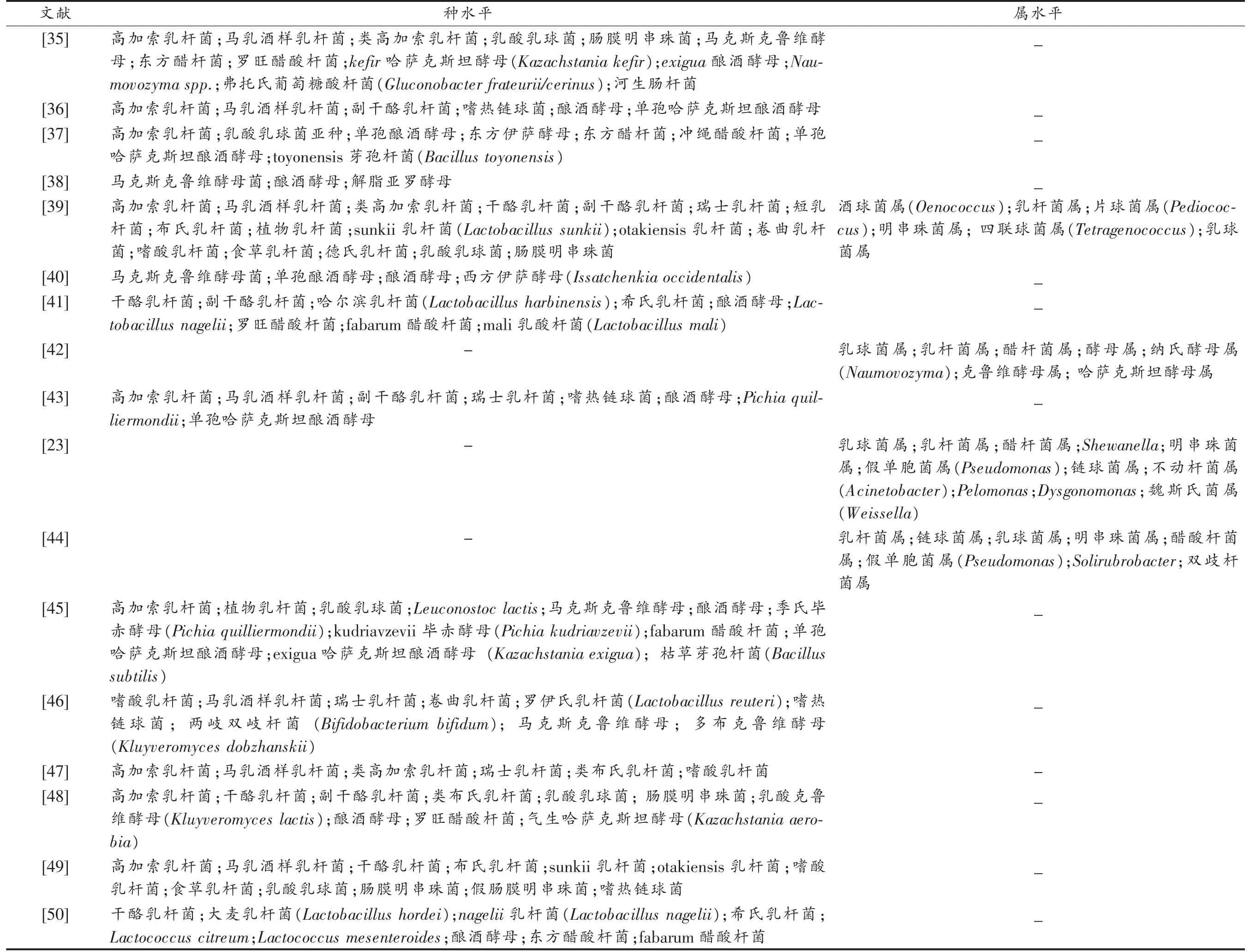
不同的雪莲菌粒微生物组成有所不同,地理来源和培养环境是影响组成菌相的主要因素[13]。此外,由不同的微生物菌相鉴定方法得出的菌相组成也会存在差别[23]。对2011-2020年间发表的26 篇关于雪莲菌和kefir 粒菌相组成研究结果进行总结,发现尽管不同菌粒之间的菌相组成差异很大,优势菌相在属水平上还是具有一致性,包括乳酸杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、明串珠菌属(Leuconostoc)、链球菌属(Streptococcus)、克鲁维酵母属(Kluyveromyces)、假丝酵母属(Candida)、酵母属(Saccharomyces)和醋酸菌属(Acetobacter)(表1),它们之间的相互作用和共生关系使雪莲菌粒稳定生长。其中,出现频率最高的菌株为马乳酒样乳杆菌、高加索乳杆菌、酿酒酵母(Saccharomyces cerevisiae)、乳酸乳球菌(Lactococcus lactis)(图6)。总结发现,乳酸菌和酵母菌的数量较多,醋酸菌数量最少,其中乳酸菌数量范围在104~108CFU/mL,酵母菌数量范围在105~108CFU/mL,醋酸菌菌数在105CFU/mL[16-17,24]。另外,高洁等[25]运用宏基因组学技术研究kefir 粒的细菌菌相组成,共鉴定到8 个属,其中乳球菌属、醋酸菌属和乳杆菌属分别占细菌总数的74%,10%和5%。

表1 不同kefir 样品的菌相组成Table 1 Microbial composition of different kefir samples

图6 2011—2020年雪莲菌菌相组成研究词云图Fig.6 Word cloud picture of study on the Tibet kefir grain microbial composition from 2011 to 2020
除菌相组成外,菌粒中微生物分布位置也存在一定规律。Wang 等[14]的扫描电镜结果显示,雪莲菌粒外表面的微生物密度大于内部,大量的短棒状乳酸菌附着在菌粒外表面,而内表面分布的多为长链状的乳酸菌(图7)。Lu 等[15]研究也发现从外表面到内表面酵母菌和细菌的菌体密度呈下降趋势,并在组成菌粒的颗粒单元壁上观察到由细菌组成的多面体网状结构,酵母菌镶嵌其中(图8)。与其结果一致,Gao 等[45]研究4 个来源于不同地区的雪莲菌粒,发现酵母菌主要分布在细菌群落表面或镶嵌其中(图9)。虽然天然发酵体系雪莲菌粒的复杂组成尚未明确,但是已发现的雪莲菌粒的理化组成规律为全面认识雪莲菌粒,探究其形成机制提供了重要线索。即雪莲菌颗粒是以酿酒酵母、高加索乳杆菌、马乳酒样乳杆菌、单孢酿酒酵母、乳酸乳球菌、马克斯克鲁维酵母等菌相组成为主的微生态体系,其中酵母菌镶嵌聚集在杆状菌中。

图7 扫描电镜观察雪莲菌粒的微观结构[14]Fig.7 Microstructure of Tibet kefir grain observed by scanning electron microscope[14]
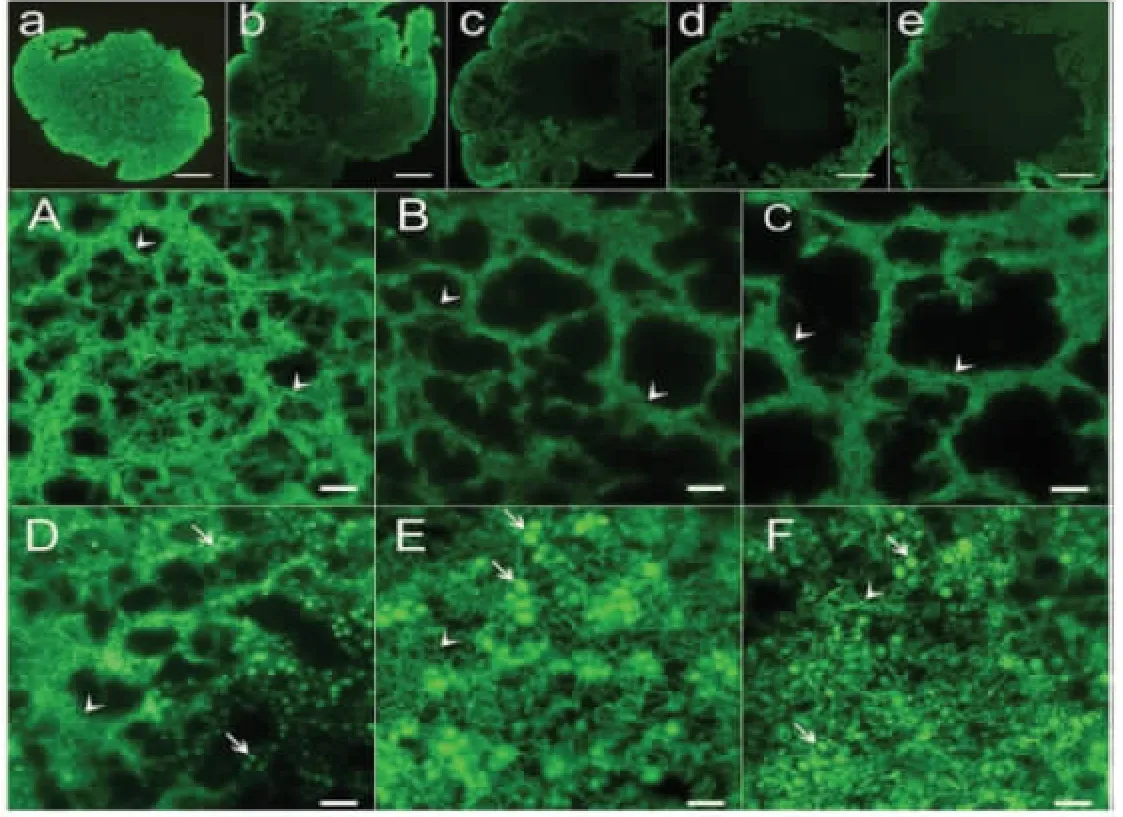
图8 西藏雪莲菌粒中的微生物分布[15]Fig.8 Microbial distribution of Tibet kefir grain[15]

图9 来自西藏及周边地区的4 个雪莲菌粒的扫描电子显微镜图[45]Fig.9 Scanning electron microscope images of four Tibet kefir grains from Tibet and the surrounding areas[45]
(续表1)
2 雪莲菌颗粒形成机制假说
2.1 生物膜假说
雪莲菌粒作为一个复杂的微生态系统,其形成过程中涉及多种因素。要探究一个微生物复杂聚集体的形成,首先要明确微生物聚集的基础是什么,其次是什么因素使得各种复杂微生物聚集成团而不是自由分散。2012年,有学者基于菌株间的聚集作用研究提出这样的假设,认为在菌粒形成初始,马乳酒样乳杆菌和turicensis酵母相互聚集形成菌团颗粒;随着pH 值逐渐降低,由于菌株表面特性和聚集能力的影响,乳杆菌和酵母菌等逐渐吸附到菌团颗粒上,形成薄层生物膜;接着,随着培养时间的延长,浮游菌株继续聚集,逐渐形成三维立体颗粒,直至kefir 粒的形成[14]。基于此,作者认为微生物菌体的成膜特性、相互聚集能力以及微生物间的共生关系等可能和菌粒的形成息息相关。
生物膜是微生物菌体的集群现象,是与浮游微生物相对的概念,由菌体细胞及胞外聚合物(胞外多糖、蛋白质等)附着在生物或非生物表面混合形成[51]。胞外基质如多糖、蛋白质、DNA 等是生物膜的重要组成。生物膜不是微生物简单地聚集,而是连续、有组织的,具有三维空间结构和信息传递系统,被自身分泌物包裹,复杂性极高的细菌群体,代表着一个高水平的生物系统,能够帮助微生物抵抗环境中的不良因素,减少菌体的死亡,提升菌粒的稳定性[52]。生物膜的形成是一个复杂的过程:首先形成一个用于附着的表面→细胞牢固黏附在此表面→浮游细胞通过胞间相互作用继续黏附→形成生物膜结构[53]。
Wang 等[14]提出的kefir 粒的成粒假说中生物膜是雪莲菌粒产生的基础。Han 等[54]从kefir 发酵乳形成的生物膜中分离筛选到马克斯克鲁维酵母、乳酸乳球菌、肠膜明串珠菌、高加索乳杆菌、sunkii 乳杆菌和东方醋酸杆菌,研究其表面疏水性、zeta 电位、菌体聚集情况等,发现除东方醋酸杆菌外其余菌株都表现出一定的生物膜形成能力,其中,马克斯克鲁维酵母的生物膜形成能力最强。井雪萍[55]对来自青海和东北民间的雪莲菌粒的研究表明,两种来源的雪莲菌粒均具有较强的生物膜形成能力,其生物膜上含有丰富的微生物,细菌主要有6 种,真菌2 种。与之对比,原粒中细菌主要有12 种,真菌7 种。Wang 等[14]从kefir 粒中分离出4 株乳酸菌:马乳酒样乳杆菌HL1,高加索乳杆菌HL2,肠膜明串珠菌HL3,乳酸乳球菌HL4;3 株酵母菌:马克斯克鲁维酵母HY1,turicensis 酵母(Saccharomyces turicensisHY2),发酵毕赤酵母(Pichia fermentansHY3)。研究发现HL2、HY1、HY2、HY3 单独培养以及HY1、HY3 分别和4 株乳酸菌共培养均能形成致密的生物膜。生物膜的研究现状为雪莲菌粒的形成机制研究打下基础,然而,目前研究中菌体形成的生物膜生物量小,无法保证微生物的持续增长。这一问题的解决将成为菌粒形成研究的重大突破。
2.2 聚集假说
菌株的聚集能力是菌体形成生物膜的基础,雪莲菌粒中菌株之间的相互聚集与菌株的表面特性、胞外多糖及表面蛋白密切相关[56]。
2.2.1 微生物表面特性 菌株的表面特性(疏水性、表面电荷等)被认为是菌株间聚集或与其它介质结合的影响因素之一。有学者对双歧杆菌的表面性质及黏附性的研究表明,具备自聚力和菌体表面疏水性高的双歧杆菌具有更高的黏附力[57]。汤华成[58]在研究来自water kefir 的半乳糖霉菌(Galactomyces geotrichum)表面特性发现,其具有很强的疏水性,表面呈碱性,表现出极强的自聚能力,同时与高加索乳杆菌之间表现出一定的共聚能力,只是随着时间的推移共聚速率减缓。井雪萍[55]从kefir 粒生物膜上分离出6 种菌,其疏水性、zeta电位、自聚集、共聚集和生物膜成膜试验表明,菌体疏水性越强,zeta 电位值越低,菌体自聚集越强,生物膜形成能力也越高。Wang[14]及Han[54]的研究中也发现雪莲菌粒或kefir 粒中微生物菌株表面的疏水性与菌株的成膜能力、聚集能力呈正相关。此外,细胞表面存在的蛋白、多糖、菌毛、脂磷壁酸等物质和细胞器也会影响菌体表面疏水性的强弱,进而影响菌体间的聚集。
2.2.2 表层蛋白和胞外多糖 乳酸杆菌SLP 具有保护菌体,影响菌体表面性质,参与菌体黏附肠道过程和抑制病原菌对肠道入侵等作用[59]。其中,SLP 的主要功能之一是参与介导菌体与不同表面的黏附,如菌株间的自聚集,不同菌株间的共聚集,对肠上皮细胞的黏附等。Alp 等[60]研究分离自奶酪、腌菜等发酵食品的乳酸菌(干酪乳杆菌、cibaria 魏斯氏菌(Weisella cibaria)、植物乳杆菌、棒状乳杆菌(Lactobacillus coryniformis)),发现去除SLP 的菌体,其自聚集、共聚集、黏附性显著降低,而菌活性未受到较大影响。Golowczyc 等[61]研究SLP 对高加索乳杆菌和解脂酵母(Saccharomyces lipolytica)间共聚作用的影响,结果发现氯化锂处理去除SLP 后,二者间的共聚率明显下降。Fina 等[62]从嗜酸乳杆菌ATCC 4356 细胞中提取纯化SLP,研究其与原核生物细胞壁成分(如肽聚糖、脂磷壁酸)、真核生物细胞壁成分(如黏蛋白、甲壳素)以及与病毒、细菌、酵母菌和血细胞的相互作用。结果表明,SLP 的C-端部分具有凝集素样活性,能与不同的糖表位发生相互作用。
雪莲菌胞外多糖kefiran 具有极强的胶黏性。Piermaria 等[63]证实从kefir 粒中提取的多糖kefiran 具有成膜特性,且这种多糖形成的薄膜厚度随多糖溶液浓度的增加而增大(图10)。此外,发酵食品中酵母菌细胞表面的甘露聚糖在菌体共聚方面发挥着重要作用。Hirayama 等[64]对比研究甘露聚糖基因缺失的酵母菌突变株,发现福山壶醋中植物乳杆菌ML11-11 细胞SLP 与酿酒酵母细胞表面甘露聚糖相互作用介导的细胞共聚集,对混合生物膜的形成有重要作用。作者认为SLP 对菌体黏附的介导作用,胞外多糖的胶黏性及识别作用对微生物菌体间的聚集发挥着重要作用,可进一步运用分子技术从基因层面研究雪莲菌表层蛋白和胞外多糖,揭示SLP 和kefiran 多糖的作用机制。

图10 kefiran 多糖形成的薄膜切片[63]Fig.10 Cross-section micrographs of kefiran films[63]
2.3 共生假说
作为天然的混菌发酵体系,雪莲菌上多种微生物的共生关系是维持菌粒形成及稳定生长的基础。乳酸菌与酵母菌的双重发酵是雪莲菌发酵乳的重要特征,也是通过两种菌相共生而实现的。雪莲菌粒内的微生物相互关系可以总结为细菌与酵母菌间相互作用、细菌与细菌间相互作用以及酵母菌与酵母菌间相互作用3 类[13],其中细菌与酵母菌间的相互作用是最主要的,也是大多数发酵食品的核心部分。酵母菌(非乳糖消耗型)不仅可利用乳酸菌代谢产生的乳酸作为碳源,提高环境中pH 值,促进乳酸菌生长,而且酵母菌可以消耗环境中氧气,为乳酸菌提供更适宜生长环境。此外,酵母菌能够供给细菌丰富的维生素、生长因子和必需的氨基酸。
Mendes 等[65]通过转录组学方法研究kefir 粒的酿酒酵母与德氏乳杆菌保加利亚亚种的相互作用,确定以下相互作用机制:德氏乳杆菌保加利亚亚种分解消耗乳糖产生半乳糖,为酿酒酵母提供碳源,而酿酒酵母发酵产生二氧化碳,促进德氏乳杆菌保加利亚亚种的生长。Cheirslip 等[66]研究发现来自kefir 粒的酿酒酵母和马乳酒样乳杆菌的相互作用增加了马乳酒样乳杆菌的多糖产量。这种微生物间强大的共生关系可能是雪莲菌颗粒形成的重要前提。曾有学者尝试利用人工载体复配雪莲菌粒发酵剂,虽然模拟出的西藏灵菇粒与原粒相似,发酵乳特性相近,但是在传代培养过程中载体质量有所损失,增殖率为负[8]。共生形成颗粒的假说解释现有人工模拟雪莲菌颗粒失败的原因之一,可能是未建立起二者之间的共生关系。
3 结语
雪莲菌粒作为天然发酵体系,在自然环境下形成和增殖,其中多种不可控因素赋予其复杂的理化组成及菌粒形成机制,涉及菌株的表面性质、聚集黏附能力、共生关系等多个方面。现有的人工模拟菌粒研究并未全部满足这些成粒假说的条件。在接下来的研究中,可考虑用多个因素的共同作用来阐明雪莲菌粒的形成机制,构建理化组成明确、发酵性能稳定的人工模拟菌粒。
