鳙鱼骨酶解产物的抗氧化活性及相对分子质量分布
2021-10-19张益奇姚洪正何光喜戴志远
董 烨,张益奇,2,3,姚洪正,何光喜,戴志远,2,3*
(1 浙江工商大学海洋食品研究院 杭州310035 2 浙江省水产品加工技术研究联合重点实验室 杭州310035 3 海洋食品精深加工关键技术省部共建协同创新中心 辽宁大连116000 4 杭州千岛湖发展集团有限公司 杭州311701)
水产加工过程中通常产生大量的副产物,如鱼鳞、鱼鳍、鱼皮、鱼骨及内脏等,约占活鱼体重的50%~70%[1-2],其中,鱼骨含有丰富的胶原蛋白、钙和磷等营养成分。然而,鱼骨质构坚硬,内部的胶原蛋白由3 条螺旋链缠绕而成,基质附着羟基磷灰石,较难利用[3]。我国目前对鱼骨的开发利用技术较为落后,大多数被直接丢弃,导致环境问题和宝贵营养物质的浪费。利用一些新技术手段对这些低值鱼骨进行高值化、生态化利用具有一定的意义。
酶解法制备鱼类蛋白生物活性物质是近年来研究的热点,如Garcia-moreno 等[4]研究了不同DH 蓝鳕鱼酶解产物的抗氧化活性、ACE 抑制活性和抗原性。Lima 等[5]研究了不同DH 石首鱼副产物酶解产物的抗氧化和抗菌活性。李军等[6]酶解鲢鱼骨,分离纯化得到具有高抗氧化活性的胶原多肽。水产品加工过程中产生的副产物通常作为制备酶解产物的来源。然而,作为副产物之一的鱼骨,其内部胶原蛋白分子通过次级键形成稳固的结构,并与羟基磷灰石牢固结合,包埋了酶的催化位点,导致酶解效率低下。因此亟需探索一些简单高效的鱼骨预处理方法。汽爆技术是一种物理化学预处理技术,可以破坏材料结构,从而提高酶解效率[7]。将原料在高压蒸汽中保压一段时间后瞬时泄压,饱和蒸汽急剧膨胀而绝热做功,产生的冲击波对原料进行机械剪切,解离原料组分间的紧密结构[8]。因汽爆技术投资成本低,能耗低且绿色环保,在原料预处理中得到广泛的应用[9-11]。本文以鳙鱼骨为原材料,采用汽爆技术预处理鱼骨,酶解制备不同水解度的鱼骨酶解产物,评估鱼骨酶解产物的抗氧化活性,探究鱼骨酶解产物分子质量分布情况,为鱼骨资源高值化的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜鳙鱼骨,杭州千岛湖;中性蛋白酶,源叶生物技术有限公司;复合蛋白酶、碱性蛋白酶3.0T、风味蛋白酶,诺维信公司;木瓜蛋白酶、三氯乙酸、磷酸二氢钠、磷酸氢二钠、水杨酸、氯化亚铁、氯化铁、30%过氧化氢、95%乙醇、铁氰化钾,国药集团化学试剂有限公司;DPPH、ABTS、马尿酰-组氨酰-亮氨酸(429 u)、碳酸酐酶(29 ku)、细胞色素C(12.4 ku)、抑肽酶(6.5 ku)等,美国Sigma 公司。
1.2 试验仪器与设备
e2695 高效液相色谱,美国Waters 公司;FE20 pH 计,梅特勒仪器有限公司;SPECTRA MAX190酶标仪,美国Molecular Devices 公司;QBS 200B汽爆机,正道生物能源公司;紫外-可见分光光度计、Fresco 21 冷冻高速离心机,美国Thermo Fisher 公司;400Y 多功能粉碎机,永康铂欧五金制品有限公司;DGG-9123A 电热恒温鼓风干燥箱,上海森信实验仪器有限公司;Ultra-Turrax T-18 basic 均质机,德国IKA 公司。
1.3 试验方法
1.3.1 汽爆处理[8]用0.1 mol/L NaOH 溶液浸泡鱼骨去除杂蛋白,每隔2 h 更换1 次浸泡液,浸泡4 h 后,将鱼骨取出洗至中性,沥干备用。将汽爆机预热,至压力为0.6 MPa。取200 g 鱼骨置汽爆机内,保压2 min 后瞬间泄压(前期通过对不同汽爆条件鱼骨酶解特性的研究发现,当汽爆压力0.6 MPa,保压时间2 min 时,酶解效果较好),收集汽爆后的鱼骨置40 ℃干燥箱烘干后粉碎,于-20 ℃保存待用。
1.3.2 酶解试验 采用碱性蛋白酶(50 ℃,pH 8.0)、木瓜蛋白酶(50 ℃,pH 7.0)、复合蛋白酶(50℃,pH 7.0)、中性蛋白酶(50 ℃,pH 7.0)和风味蛋白酶(50 ℃,pH 7.0)5 种蛋白酶,在各自最适条件下进行酶解反应。将6%汽爆鱼骨粉溶液均质5 min,水浴加热至各蛋白酶对应的最适温度,用0.05 mol/L NaOH 调节至最适pH 值,蛋白酶添量为2%,开始反应并计时,反应过程中滴加0.05 mol/L NaOH 维持蛋白酶的最适pH 值,同时记录NaOH 溶液的消耗量。通过消耗的NaOH 量计算DH,评价各蛋白酶的酶解效果。
1.3.3 水解度(DH)的测定 采用pH-stat 法[12]测定水解过程中的NaOH 消耗量,计算酶解产物的DH。
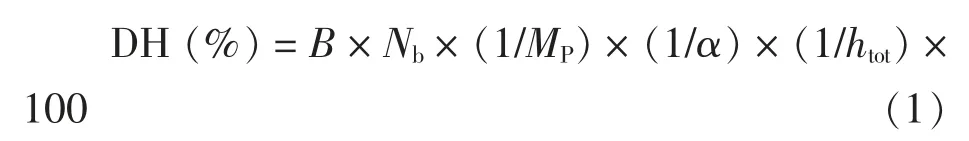
式中:B——消耗NaOH 体积,mL;Nb——NaOH 浓度,mol/L;α——α 氨基的解离度;MP——底物中蛋白质总量,g;htot——底物中蛋白质肽键总数,mmol/g。
1.3.4 不同DH 的鱼骨酶解产物的制备 使用碱性蛋白酶和复合蛋白酶制备不同DH 的鱼骨酶解产物,分别记为HA 和HP。通过控制NaOH 消耗量来制备不同DH 的酶解产物。当DH 分别达到5%,10%,15%时,停止滴加碱液,置沸水浴中灭酶10 min,8 000 r/min 离心15 min,取上清液(分别记为HA5、HA10、HA15、HP5、HP10 和HP15),冷冻干燥,备用。
1.3.5 抗氧化活性评价
1.3.5.1 DPPH 自由基清除率的测定 参考Chen等[13]方法,稍作修改。取将1 mL DPPH 溶液(0.15 mmol/L),与1 mL 酶解液混合,室温(25 ℃)下避光静置30 min,在波长517 nm 处测定该混合物的吸光度A1,将1 mL 酶解液与1 mL 95%乙醇混合后测定其吸光度A2,1 mL 超纯水与1 mL DPPH 乙醇(95%)混合后测定其吸光度A3。计算DPPH 清除率公式:
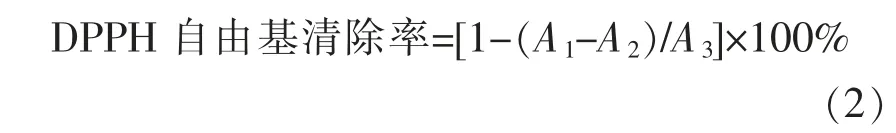
1.3.5.2 ABTS 自由基清除率的测定 参考Ketnawa 等[14]方法配制ABTS 母液,于室温避光反应12~16 h,用pH 7.4 的0.2 mol/L PBS 缓冲液稀释ABTS 母液,使其在波长734 nm 处的吸光值为0.7±0.02。移取50 μL 样品与150 μL ABTS 溶液于96 孔酶标板上混匀,室温下避光反应6 min后,于波长734 nm 处测定吸光值(A1)。用50 μL超纯水代替样品的反应体系为控制组(A2),以150 μL PBS 代替ABTS 溶液的反应体系为样品空白组(A3),以50 μL 超纯水和150 μL PBS 缓冲液分别代替样品和ABTS 溶液的反应体系为空白组(A4)。

1.3.5.3 羟基自由基清除率的测定 参考崔帅[15]的方法,稍作修改。依次加入350 μL 超纯水、50 μL 9 mmol/L 水杨酸-乙醇溶液、50 μL 样品、50 μL 9 mmol/L 的氯化亚铁溶液、50 μL 8.8 mmol/L过氧化氢溶液,混匀后于37 ℃保温15 min,在波长510 nm 处测溶液的吸光度。A1为样品的吸光度;A2为50 μL 超纯水代替氯化亚铁溶液测得的吸光度;A3为50 μL 超纯水代替样品测得的吸光度。
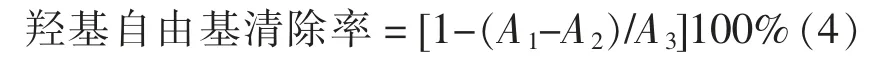
1.3.5.4 还原力的测定 参考贾韶千等[16]的方法,移取200 μL 样品与500 μL 1%铁氰化钾溶液混合,50 ℃水浴20 min,加入500 μL 10% TCA 终止反应。将反应液以6 000 r/min 离心5 min,取上清液500 μL 于离心管中,分别加入500 μL 超纯水和200 μL 0.1%氯化铁溶液,摇匀后置50 ℃水浴10 min。取200 μL 溶液于波长700 nm 处测定吸光值。将200 μL 超纯水代替氯化铁作为空白对照。
1.3.6 相对分子质量 参照Zhang 等[17]的方法,采用Waters e2695 高效液相系统,色谱柱为TSKgel G2000 SWxl(7.8 mm×300 mm,Tosoh),UV/Vis 检测器,检测波长220 nm,洗脱液为45%乙腈-55%水溶液(0.1% TFA),0.5 mL/min 等度洗脱,时间30 min,进样量10 μL。采用细胞色素C、碳酸酐酶、抑肽酶和马尿酰-组氨酰-亮氨酸作标准品。以分子质量的对数(lgM)为纵坐标,各标准品保留时间(t)为横坐标作图,通过标准曲线计算样品相对分子质量分布情况。
1.4 数据处理
用OriginPro2018 作图,SPSS 21.0 软件处理数据,以平均数±标准差(±s)表示,用多重比较分析法进行显著性检验(P<0.05)。
2 结果与分析
2.1 不同蛋白酶对鳙鱼骨的酶解效果
水解度(DH)可作为肽键断裂的一个指标[18]。不同种类的蛋白酶的底物特异性和作用的酶切位点不同,导致酶解产物DH 和氨基酸序列不同,从而影响产物的结构、组成和功能[19]。由图1 可知,DH 随酶解时间的延长逐渐增大,在前30 min DH增加较快,随后逐渐趋于平缓,这可能是由于随着酶解的进行,有效酶切位点逐渐减少。不同蛋白酶对鱼骨的酶解效果差异较大,碱性蛋白酶处理的水解产物的DH 最高,在300 min 时达21.03%,其次为复合蛋白酶,而风味蛋白酶处理的酶解产物的DH 最低。最终选择碱性蛋白酶和复合蛋白酶作为后续鱼骨酶解用酶。
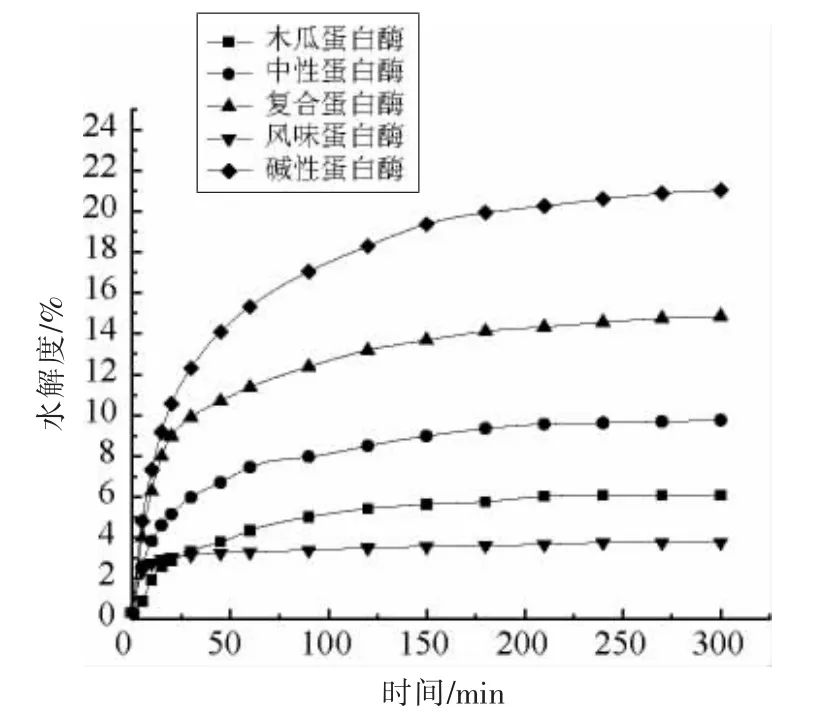
图1 蛋白酶对鱼骨水解度的影响Fig.1 Effect of proteases on DH of fish bone
2.2 鱼骨酶解产物的抗氧化活性
2.2.1 DPPH 自由基的清除能力 DPPH 是一种大分子自由基,反映酶解产物的自由基清除能力,是评价酶解产物体外抗氧化能力的重要指标[20]。不同酶的酶解产物的氨基酸序列不同,对DPPH自由基的清除能力也不同。由图2 可看出,碱性蛋白酶酶解产物(HA)和复合蛋白酶酶解产物(HP)对DPPH 自由基的清除活性均随样品浓度的增加而显著增加(P<0.05)。HP 对DPPH 自由基的清除活性高于HA,这可能是由于复合蛋白酶获得的酶解物具有更强的供氢作用,从而对DPPH 自由基具有更好的清除活性。当DH 为10%时,HP 表现出较强的DPPH 自由基清除率,其IC50值为2.85 mg/mL,而HA10 的IC50值为6.67 mg/mL,差异显著(P<0.05),表明HP10 中含有较多的抗氧化组分。
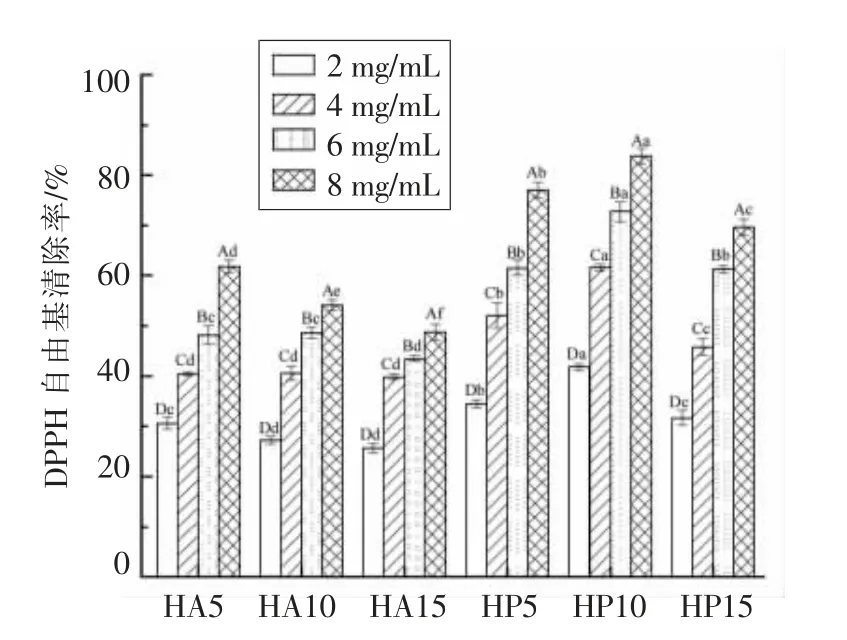
图2 不同水解度鱼骨酶解产物的DPPH 自由基清除率Fig.2 DPPH scavenging activity of fish bone hydrolysates with different DHs
2.2.2 ABTS 自由基清除能力 ABTS 自由基清除法常用于评价亲水性和亲脂性化合物的抗氧化活性[21]。图3 显示不同DH 条件下酶解产物的ABTS自由基清除能力,表明ABTS 自由基清除活性受酶解液浓度的影响,在试验浓度范围,随着酶解液浓度的增大,其清除活性增大,具有一定的量效关系。随着DH 的增大,两种酶解物对ABTS 自由基清除能力呈先增大后减小的趋势。HP10 具有较好的ABTS 自由基清除能力,这与DPPH 自由基清除能力的结果相同。酶解产物清除自由基的能力不仅与肽链的分子质量大小有关,还与酶解过程中所用酶的特异性有关[22],在同一DH 下,HP10 的IC50值为0.99 mg/mL,而HA10 的IC50值为1.59 mg/mL,差异显著(P<0.05)。从两种酶解产物对ABTS 自由基清除能力的IC50值可看出,酶解产物对ABTS 自由基的清除能力优于DPPH 自由基清除能力,这与Latorres 等[23]的研究结果一致。

图3 不同水解度鱼骨酶解产物的ABTS自由基清除率Fig.3 ABTS scavenging activity of fish bone hydrolysates with different DHs
2.2.3 羟自由基清除能力 羟基自由基可与生物体内的任何物质发生反应,特别是与蛋白质、DNA和脂类等大分子物质,会导致细胞衰老、癌症和一些疾病的发生[24],因此,清除羟基自由基对生物体至关重要。HA 和HP 不同DH 清除羟基自由基的能力如图4所示。羟基自由基清除能力与酶解液浓度呈正相关。当酶解液质量浓度为6 mg/mL 时,HA15(54.40%)具有与HP15(54.96%)相似的羟基自由基清除能力。HA 对羟基自由基的清除能力随DH 的增加而增加,HA15 的IC50值为7.09 mg/mL,而HP 对羟基自由基清除能力随DH 呈先增大后减小趋势,这与ABTS 自由基清除能力相似。HP10 羟基自由基清除能力较高,IC50值为4.91 mg/mL,而HA10 的IC50值为8.33 mg/mL,差异显著(P<0.05)。
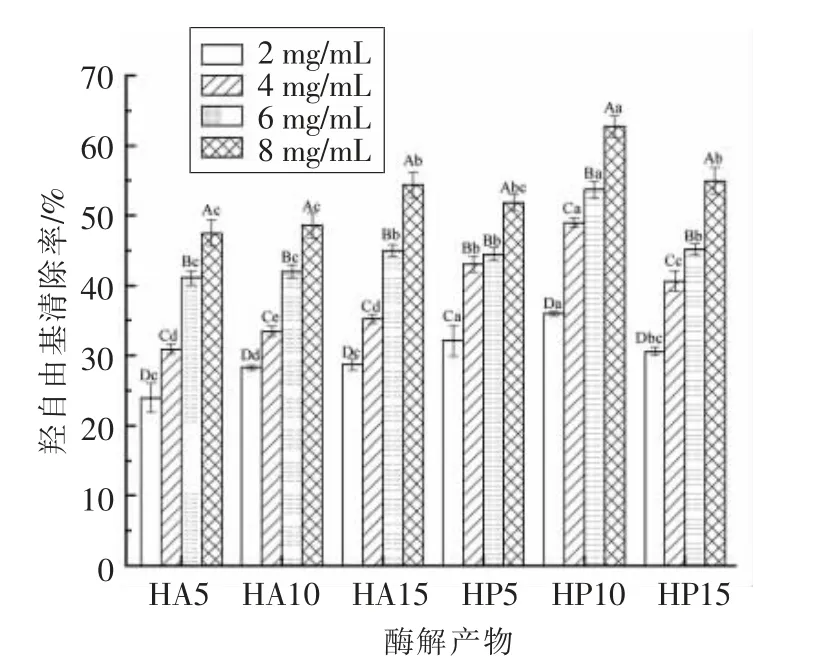
图4 不同水解度鱼骨酶解产物的羟自由基清除率Fig.4 Hydroxyl radical scavenging activity of fish bone hydrolysates with different DHs
2.2.4 还原力的测定 Fe3+还原试验常用于评价抗氧化剂提供电子或氢将Fe3+还原为Fe2+的能力,具有抗氧化活性的小分子肽和氨基酸的存在会影响样品的还原能力[25]。酶解产物的还原能力可用来测量其抗氧化能力,在波长700 nm 处,吸光度值越大,酶解产物的还原力越强,其抗氧化能力越高。如图5所示,所有酶解产物的还原力水平均随浓度的增加而增加。在相同浓度下,HA 的还原力高于HP。HA15 的还原能力最强,当质量浓度为8 mg/mL 时其吸光度值为0.75。酶的种类影响酶解产物的还原能力,在相同的DH 下,HA 和HP 酶解物还原能力差异显著(P<0.05)。在HA 体系,酶解物随DH 的升高,还原力显著增强(P<0.05)。而在HP 体系,DH 对其还原力影响不大(P>0.05)。
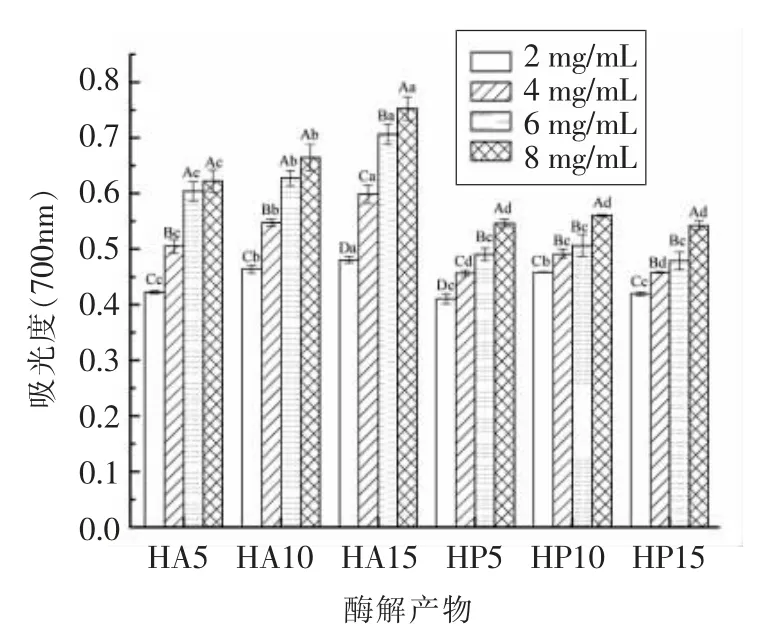
图5 不同水解度鱼骨酶解产物的还原能力Fig.5 Reducibility of fish bone hydrolysates with different DHs
2.3 分子质量分布
测定了6 种酶解产物的分子质量分布。将其分为4 个部分:>1 500 u、1 000~1 500 u、1 000~200 u 和<200 u。由图6 可知,随着水解程度的加大,酶解产物的分子质量发生显著变化,大分子肽的比例下降,小分子肽的比例上升(P<0.05)。由图7 可知,当水解度达15%时,HA15 和HP15 的分子质量在1 000 ~200 u 的比例分别达到96.92%和85.95%,酶解效果较好。这是由于随着酶解时间的增加,蛋白质分子间的肽键不断断裂,形成越来越多的小分子肽,分子质量减小。
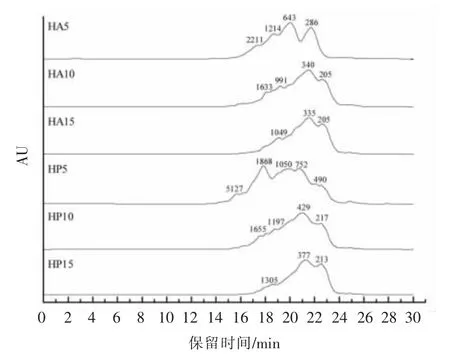
图6 鱼骨酶解物的分子质量分布色谱图Fig.6 Chromatogram of molecular weight mass distribution of fish bone hydrolysates
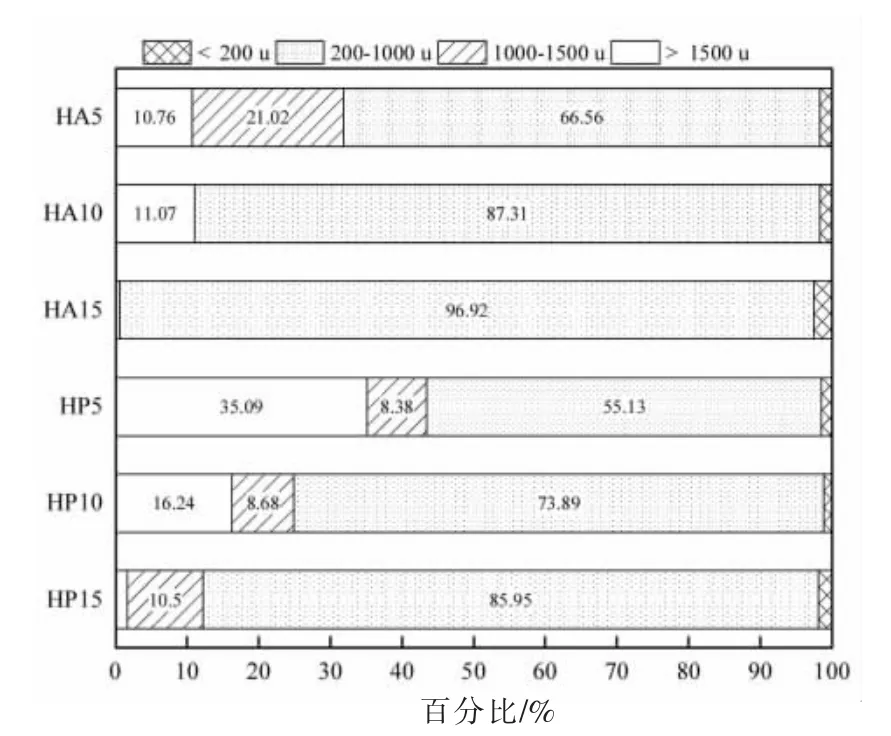
图7 鱼骨酶解物的分子质量分布Fig.7 Distribution of molecular weight of fish bone hydrolysates
3 结论
以汽爆鳙鱼骨为原料,以DH 为指标,筛选出碱性蛋白酶和复合蛋白酶两种蛋白酶酶解汽爆鱼骨粉,制备不同DH 的鱼骨酶解液,研究其抗氧化活性及分子质量分布。结果表明,不同DH 的鱼骨酶解物的抗氧化活性随酶解产物浓度的增大而增强,呈现良好的量效关系。HA 具有较好的还原能力,而HP 具有较好的DPPH 自由基、ABTS 自由基和羟自由基清除能力,当DH 为10%时,HP10对这3 种自由基清除率的IC50值分别为2.85,0.99 mg/mL 和4.91 mg/mL,分子质量主要分布在500 u以下,达75.08%。在还原力和羟自由基体系,随着DH 的增加,HA 的抗氧化活性随DH 的增大而逐渐增强,而HP 与DH 之间没有显著的一致性规律。在ABTS 体系,HA 和HP 的抗氧化活性随DH的增大呈现先增强后减小的趋势。随着DH 的增大,蛋白质间的肽键不断断裂,大分子逐渐降解,HA 和HP 的小分子质量肽不断增多。鱼骨质构坚硬,利用率低,采用汽爆技术预处理鱼骨,研究其酶解产物的抗氧化性,可为提高鱼骨资源利用率提供理论依据。今后还需开展汽爆处理对鱼骨结构影响及酶解产物应用的研究。
