植物乳杆菌和棒状乳杆菌对发酵萝卜干风味品质的影响
2021-10-19李庆羊吴祖芳翁佩芳洪松虎胡丹丹
李庆羊,吴祖芳*,翁佩芳,洪松虎,胡丹丹
(1 宁波大学食品与药学学院 浙江宁波315211 2 杭州萧山农业发展有限公司 杭州311200)
萝卜,又称大根、菜头、菜服,是十字花科萝卜属的一年或二年生草本植物,可食用部位是地下的块茎。萝卜作为蔬菜中的佳品,营养成分很丰富,吃法也多种多样[1]。萝卜泡菜是一种重要的发酵蔬菜,具有丰富的色泽和质地,每年生产成吨的产品供国内外消费[2]。其中,萝卜干因制作简单,条件要求不高,并且口味独特,干脆爽口而成为一种萝卜加工贮藏的方法。我国大部分地区采用的是传统的自然发酵,虽操作简单,但由于原辅料本身带有很多细菌以及操作不规范,因此很容易导致萝卜干在腌制过程中发生腐坏变质,降低了萝卜干的安全及营养[3]。
近些年,传统食品的加工使用发酵剂的研究越来越多,陈大鹏等[4]研究发现与自然发酵相比,人工接种发酵可以明显缩短泡菜发酵周期,提高发酵泡菜风味和品质。邓风等[5]从鲊广椒中分离得到的植物乳杆菌对泡菜水中的甲烷、有机硫化物、萜类物质以及乙醇等风味物质有较强的作用。王芮东等[6]研究发现自然发酵的萝卜泡菜在发酵过程中挥发性香气成分的种类随之增多。酯类呈整体上升趋势,含硫化合物呈先下降后上升再下降趋势,醇类、酮类、酸类、烃类和醛类呈先上升后下降趋势,醚类呈整体下降趋势。刘宗敏等[7-9]研究了肠膜明串珠茵、玉米乳杆菌、副干酪乳杆菌、乳酸乳球菌和植物乳杆菌对萝卜干发酵品质的影响,发现乳酸菌纯种发酵萝卜干,可以降低亚硝酸盐含量,改善产品风味,提高产品质量,不同菌种对发酵萝卜干品质的影响也有差别。
植物乳杆菌是蔬菜自然发酵中常见的乳酸菌物种之一,已广泛地用作发酵蔬菜的发酵剂。陈亚楠等[10]采用陈皮柑果肉为主要原料,应用植物乳杆菌发酵制作乳酸菌发酵饮料,发现该菌株对ABTS 自由基和DPPH 自由基的清除率分别高达99.14%和93.58%,其生产的饮料具有很强的抗氧化能力。Zhai 等[11]通过调节小鼠肠肝循环,发现口服植物乳杆菌菌株可以增加镉的排泄。棒状乳杆菌虽然没有植物乳杆菌应用广泛,但在发酵中也扮演重要的角色。冯婷婷[12]研究发现棒状乳杆菌不产生物胺,可以抑制一株精胺产生菌——沙克乳杆菌的生长。此外,还发现棒状乳杆菌还可以降解氨基甲酸乙酯。李晓颖[13]从东北酸菜中分离出棒状乳杆菌,经研究发现该菌株发酵液在pH 值为3.0~4.5 时对4 种指示菌(金黄色葡萄球菌、大肠埃希氏菌、铜绿假单胞菌及腐生葡萄球菌)均有抑菌活性,其抑菌活性主要依赖于发酵产生的乳酸。
广义上的食品风味是指人以口腔为主的感觉器官对食品产生的综合感觉(包括嗅觉、味觉、视觉和触觉)。本文以浙江地区的白萝卜为研究对象,经初步脱水制成半成型萝卜干,分别接入经前期筛选得到的植物乳杆菌L1(简称L1)和棒状乳杆菌L3(简称L3)以及两者混合菌种发酵。测定萝卜干在发酵过程中pH 值、总酸的变化,并对发酵后萝卜干的质构、色差、氨基酸成分和挥发性风味物质进行分析,研究2 种乳酸菌对萝卜干发酵品质的影响,为浙江地区萝卜干发酵产品的开发等提供科学依据。
1 材料与方法
1.1 材料与仪器
白萝卜、食盐、白砂糖,购买于宁波市春晓镇物美超市;植物乳杆菌L1(L.plantarumL1)、棒状乳杆菌L3(L.coryniformisL3),宁波大学食品生物技术实验室保藏。
Agilent 7890B7000C 气相色谱质谱联用仪、Agilent1260 高效液相色谱仪,美国安捷伦公司;PHS-3C 型pH 计,上海圣科仪器设备有限公司;TA.XTplus 物性测试仪,英国Stable Micro System公司;TE214S 型分析天平,成都浩驰仪器有限公司;DNP-9162 型新型电热恒温培养箱,宁波江南仪器厂;MX-GX1011 型搅拌机,厦门建松电器有限公司;LD2F-50L-Ⅱ型立式高压蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-2D 型超净工作台,苏州净化设备有限公司;5804R 型高速大容量冷冻离心机,德国Eppendorf 公司;HH-4 型数量恒温水浴锅,国华电器有限公司;HWS 型智能型恒温恒湿培养箱,宁波江南仪器厂;DHG-9203A 型鼓风干燥箱,上海捷呈实验仪器有限公司;RH 基本型磁力搅拌器,德国艾卡集团;Spectramax190 型全波长酶标仪,美国美谷分子仪器(Molecular Devices)有限公司。
1.2 萝卜干发酵工艺
1.2.1 种子液的制备 将L1 和L3 菌株从试管斜面接种至50 mL 的MAS 液体培养基,37 ℃,静置培养12 h,备用。
1.2.2 萝卜干发酵方式 自然发酵:将制好的萝卜干放入泡菜坛中,加入4%萝卜干质量的白砂糖和5 倍萝卜干质量的水,不接任何菌种,进行自然发酵;接种L1(或L3)发酵:坛中接入4%萝卜干质量的L1(或L3)菌液,其余操作均与自然发酵相同;混菌发酵:坛中接入2%萝卜干质量的L1 菌液和L3 菌液,其余操作均与自然发酵相同。
1.3 试验方法
1.3.1 菌种生长曲线的测定 将菌种分别接种到MRS 液体培养基中,混合均匀后,取少量作为0 h的样品,用酶标仪测其OD600,以未接种的培养基作为空白对照进行调零。37 ℃恒温培养,每隔2 h取样测3 次,取其平均值。
1.3.2 理化指标的测定 pH 值:采用PHS-3C 型pH 计直接测定。总酸:采用GB/T 12456-2008 酸碱滴定法测定[14]。色差分析:采用手持色差仪直接测定[15]。质地分析:经过不同发酵方式处理的萝卜干,用物性测试仪进行质地剖面分析测定,采用P362 平底圆柱探头,触发点负载0.05N,测试前速度2 mm/s,测试中速度1 mm/s,测试后速度1 mm/s,试样压缩形变70%,两次压缩间停顿3 s。测定参数参照梅明鑫等[16]的方法设定。
1.3.3 高效液相色谱仪测游离氨基酸 样品前处理:用分析天平称取1.0 g 左右萝卜干样品,精确到小数点后4 位。然后用5%三氯乙酸(5 g/100 mL TCA),定容至25 mL,混匀,常温下超声20 min,静置2 h,然后双层滤纸过滤,取1 mL 澄清滤液于1.5 mL 离心管内离心,15 000 r/min,30 min。最后用0.22 μm 水膜再次过滤后取400 μL 上清液于取液相样品瓶。
色谱条件:流动相:柠檬酸钠缓冲溶液,控制流速:0.4 mL/min;进样量:20 μL;分离柱柱温:57℃;反应柱柱温:135 ℃;检测波长:脯氨酸检测波长440 nm,其它氨基酸检测波长570 nm。以峰面积作为检测结果,采用外标法计算氨基酸含量。
1.3.4 GC-MS 分析挥发性风味成分 样品的前处理:取适量发酵萝卜干,剪碎得到待测样品,取2 g 样品放入标准顶空进样小瓶内,其气相部分(顶空)导入顶空进样装置连接的气相色谱。萃取头老化:按照SUPELCO 公司推荐的条件,第一次使用时将50/30 μm DVB/CAR/PDMS 萃取头在气相色谱进样口210 ℃老化1 h;之后每次使用前老化0.5 h,至无干扰峰出现。样品顶空固相微萃取:准确加入2 g 剪碎的萝卜干于顶空瓶中,于60 ℃下平衡15 min。将活化好的固相微萃取器插入平衡后的样品顶空恒温振荡萃取30 min,振荡速率为250 r/min。取出插入气相色谱柱的进样口解吸附7 min,解析温度为210 ℃。
色谱条件:毛细管柱为Vocal(60 m×0.32 mm×1.8 μm)。载气为高纯氦气,恒定流速3mL/min,进样口温度210 ℃,不分流进样模式。柱温箱采用程序升温,起始温度35 ℃,保持3 min,以3℃/min 升至40 ℃,保持1 min,再以5 ℃/min 升至200 ℃,保持20 min。
质谱条件:采用全扫描模式采集信号,电离方式EI,电子轰击能量为70 eV;接口温度220 ℃,离子源温度230 ℃,四级杆温度150 ℃,扫描质量范围m/z 40~600,扫描频率3.6 scans/s。
定性定量分析:化合物经计算机检索与NIST 14 Library 相匹配,选择较高匹配度的检索结果与质谱图库中的标准谱图对照、复合,进行人工谱图解析确认挥发性成分,并结合文献报道的已知化合物确认检测物成分,按面积归一化法进行定量分析,求得各化学成分的相对百分含量。并进行比较分析。
1.4 数据统计分析
每个样品平行测定3 次,所有数据用SPSS 22.0 软件进行差异显著性(P<0.05)分析,使用OriginPro 9.1 作图。
2 结果与分析
2.1 L1 和L3 的生长曲线
考察2 种乳酸菌在37 ℃条件下纯培养的生长曲线,结果如图2所示。
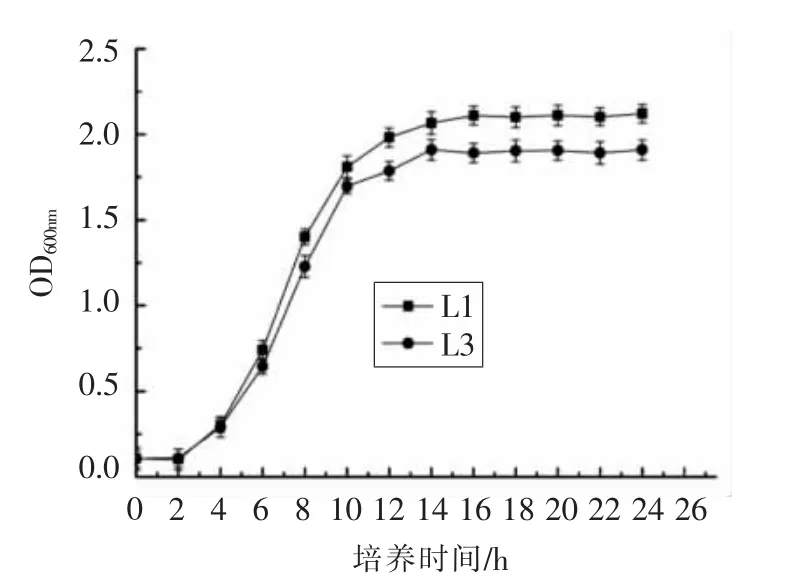
图2 菌株生长曲线Fig.2 Growth curves of the strains
通常以600 nm 波长下的OD 值变化来反映菌株的生长和繁殖情况。2 种乳酸菌在37 ℃条件下培养24 h 过程中,在液体培养基中的生长情况如图2所示。两种乳酸菌的生长基本都是从2 h开始大量繁殖,然后进入对数期,并到14 h 后开始趋于稳定。进入稳定期后的植物乳杆菌的OD值要比棒状乳杆菌的略高,生长情况要好一些。在后续试验中统一选择菌种培养12 h 为接种时间。
2.2 萝卜干发酵过程中pH 值和总酸的变化
产酸能力的强与弱是评判菌种发酵活力的重要指标[17],也是影响腌制菜品质量的一个关键因素。2 种乳酸菌对萝卜干发酵过程中pH 值和总酸的测定结果如图3 和图4所示。
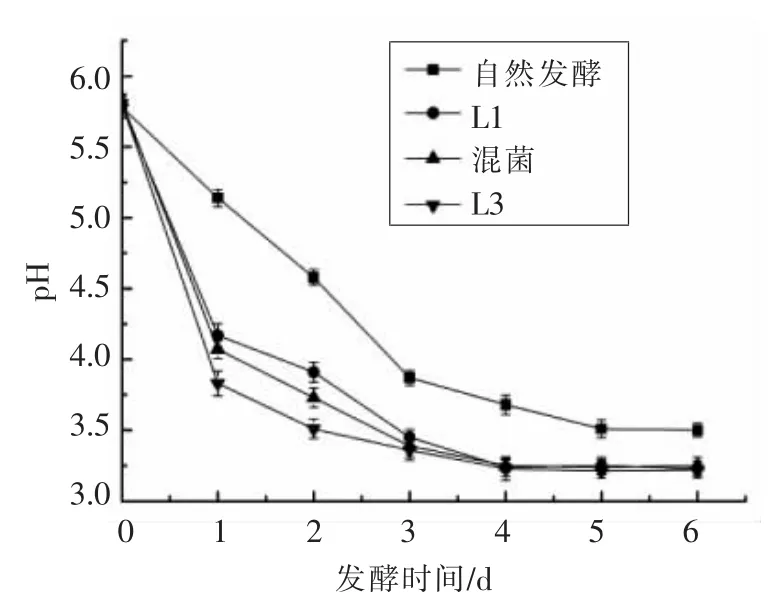
图3 萝卜干发酵过程中pH 值的变化Fig.3 Changes of pH in dried radish fermentation
由图3 可知,接种乳酸菌发酵的萝卜干pH值下降非常迅速,仅发酵3 d 其pH 值就降到了3.5 左右,并在第4 天达到最低值,随后逐渐趋于稳定,达到稳定后的pH 值分别为3.23,3.25 和3.22;而自然发酵的萝卜干在发酵过程中pH 值下降得较为缓慢,pH 值在发酵第5 天才下降到3.5,最后稳定在3.5 左右。发酵初期pH 值的迅速降低能够有效抑制其它不耐酸杂菌的繁殖,从而减少有害代谢产物的积累,并且菌株产酸速度的快慢也决定着发酵周期的长短。相比于接种乳酸菌进行发酵的萝卜干,自然发酵下的萝卜干在达到稳定期后的pH 值略高。推测是在自然发酵条件下,发酵前期一些有害菌的生长繁殖产生的代谢物质抑制了乳酸菌的产酸过程。由图4 可知,在萝卜干的发酵过程中随着发酵时间的进行,总酸含量也在逐渐增加,第5 天开始趋于稳定。在发酵完成后总酸含量分别达到0.61,0.68,0.79,0.73 g/100 g。其中混菌发酵的萝卜干稳定后的总酸含量最高,而自然发酵的总酸含量最低。
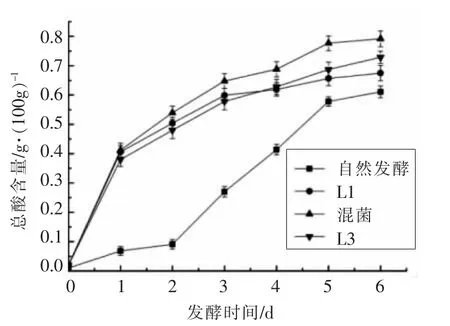
图4 萝卜干发酵过程中总酸含量的变化Fig.4 Changes of total acid content in dried radish fermentation
2.3 L1 和L3 对发酵萝卜干色泽的影响
色泽作为食品感官评价的重要组成部分,直接影响消费者对产品的满意程度,是决定腌制品食用价值的重要因素。2 种乳酸菌对发酵萝卜干色泽影响的测定结果如表1所示。

表1 萝卜干发酵前后色泽的变化Table 1 Changes of color before and after fermented dried radish
色差系统L*值增大代表样品颜色变白、变亮,数值变小则是颜色变黑、变暗。a*值增高代表其颜色变红,减小则表示颜色变绿。b*值增大表示颜色向黄色转变,b*值减小表示颜色向蓝色转变[18]。
由表1 可知,相比于未经发酵的萝卜干,4 组发酵后的萝卜干L*值都有不同程度的下降。其中自然发酵和接种L1 发酵的L*值较低,萝卜干的颜色有一定的变暗;而混菌发酵和接种L3 发酵的L*值较高,与未发酵萝卜干的L*值最为接近,萝卜干颜色为浅白色,与未发酵萝卜干颜色相差较小。未发酵萝卜干的b*值最大,经过发酵后,萝卜干的b*值都有一定程度的下降,说明发酵有助于萝卜干中黄色素的降解。蔬菜腌制过程中,微生物生长及生理生化变化是导致腌制过程颜色变化的重要因素,而萝卜的黄变则是最为常见的一种现象,这种黄变主要是与发酵过程中黄色素形成有关[19]。研究表明,当△E值(色差值)越小时,样品间颜色变化越不显著。接种L3 发酵的△E值最小,则认为其颜色与未发酵萝卜干最为接近。
2.4 L1 和L3 对发酵萝卜干质地的影响
腌制菜品的质地也是感官评价的一项重要指标,直接影响到产品的口感。2 种乳酸菌对发酵萝卜干质地影响的测定结果如图5、图6、图7 和图8所示。
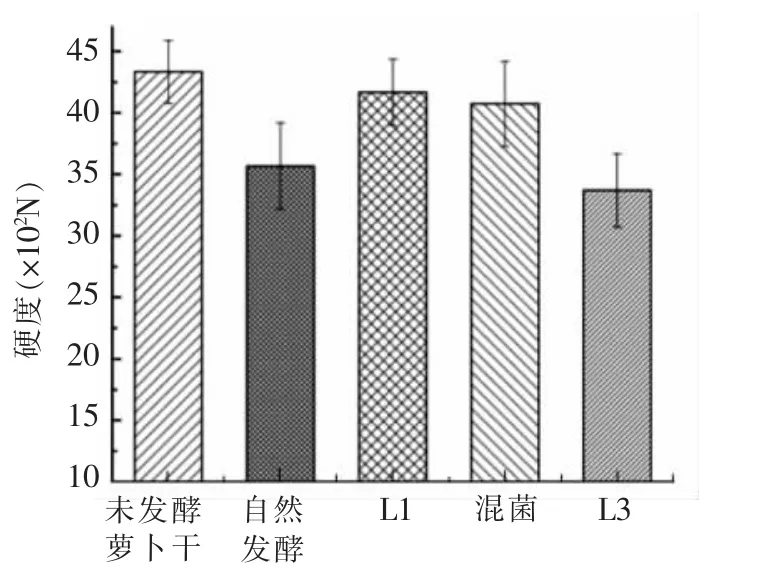
图5 L1 和L3 对发酵萝卜干硬度的影响Fig.5 Effect of L1 and L3 on the hardness of fermented dried radish
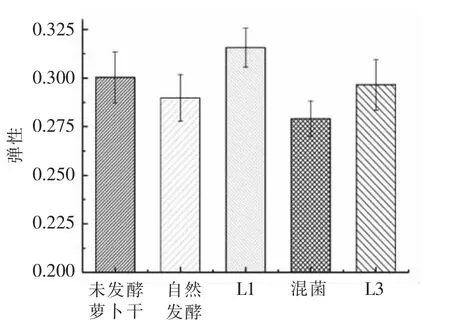
图6 L1 和L3 对发酵萝卜干弹性的影响Fig.6 Effect of L1 and L3 on the resilency of fermented dried radish
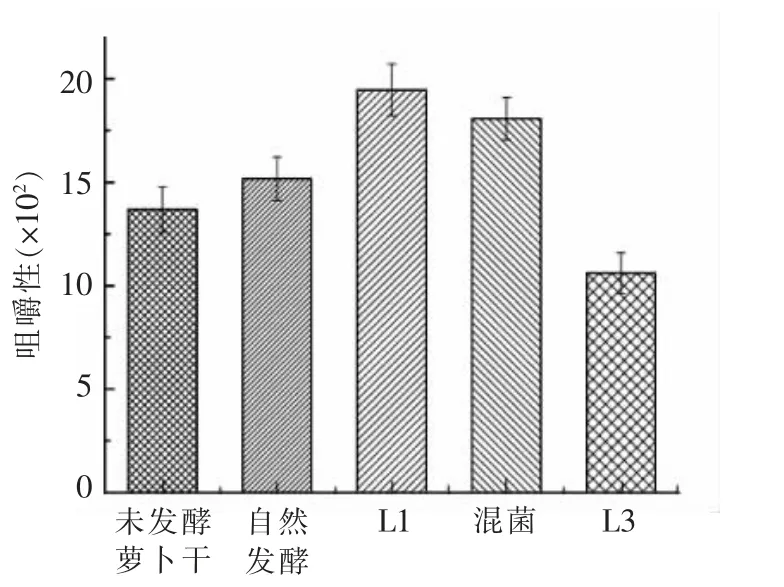
图7 L1 和L3 对发酵萝卜干咀嚼性的影响Fig.7 Effect of L1 and L3 on the chew ability of fermented dried radish
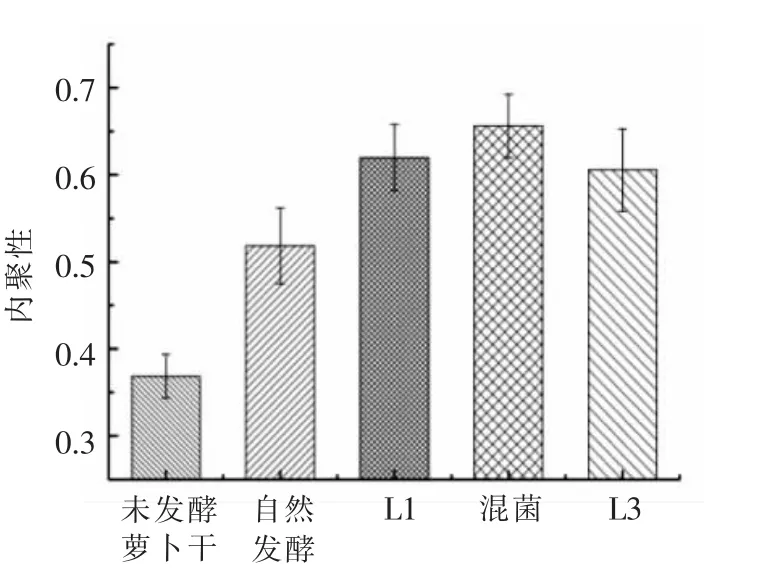
图8 L1 和L3 对发酵萝卜干内聚性的影响Fig.8 Effect of L1 and L3 on the cohesion of fermented dried radish
由图5 可知,无论是自然发酵还是接种乳酸菌发酵,萝卜干硬度都有一定的程度的下降,其中,接种L3 发酵的硬度最低,自然发酵的其次,而接种L1 发酵和混菌发酵的萝卜干硬度较高并且相差不大,都只比未发酵萝卜干略低。硬度的降低主要是由细胞变形和破裂造成的,在发酵过程中微生物参与发酵而产生分解细胞结构的酶,使得萝卜干细胞结构遭到破坏,从而导致其硬度降低[20]。由图6 可知,接种L1 发酵的萝卜干的弹性最高,比未发酵的萝卜干弹性还要高一些,而其它3 组萝卜干的弹性在发酵结束后都有一定程度的下降,其中混菌发酵的弹性下降得最多,弹性最低,自然发酵的次之,接种L3 发酵的弹性则比自然发酵的略高。
咀嚼性是指将食品咀嚼到可吞咽时需要做的功,综合反映了样品对持续咀嚼的抵抗能力。食物的咀嚼性与其硬度存在一定的相关性[21]。由图7可知,接种L3 发酵的萝卜干咀嚼性最差,咀嚼性比未发酵的萝卜干要低,而其它3 组在发酵结束后的咀嚼性都有所增加。其中接种L1 发酵的萝卜干咀嚼性最好,混菌发酵的萝卜干咀嚼性则略低一点。内聚性反映了组织细胞间结合力的大小和组织结构的完整性[22]。由图8 可知,未发酵萝卜干的内聚性只有0.37,经过发酵后,萝卜干的内聚性都有很大程度的提升。混菌发酵的内聚性最高,达到了0.65,接种L1 发酵和接种L3 发酵的内聚性则略低一点,但都比自然发酵的要高。
综合硬度、弹性、内聚性和咀嚼性4 个方面,接种L1 发酵的萝卜干质地较好。
2.5 L1 和L3 对发酵萝卜干氨基酸的影响
食物中所含氨基酸由两部分组成:游离氨基酸和非游离氨基酸。游离氨基酸对食品滋味贡献较大,其中呈味氨基酸对发酵蔬菜的风味形成发挥了重要的作用[23]。2 种乳酸菌对发酵萝卜干氨基酸影响的测定结果如表2 和图9所示。

表2 萝卜干发酵完成后氨基酸的含量Table 2 Amino acid content of radish after fermentation
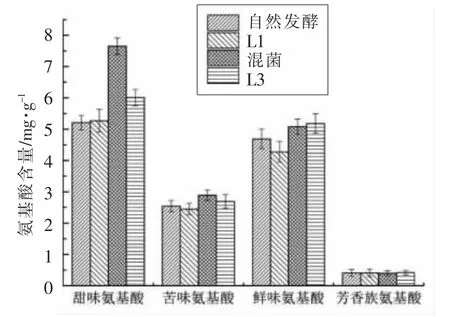
图9 L1 和L3 对发酵萝卜干氨基酸的影响Fig.9 Effect of L1 and L3 on amino acids of fermented dried radish
按照氨基酸的味觉强度,可以大致把游离氨基酸分为甜味氨基酸(Ser、Thr、Gly、Ala、His、Pro)、苦味氨基酸(Leu、Val、Arg、Ile、Trp、Met)、鲜味氨基酸(Glu、Asp、Lys)和芳香族氨基酸(Tyr、Cys、Phe)4 种[24]。4 组发酵萝卜干中,混菌发酵萝卜干的游离氨基酸含量最高,为16.01 mg/g,其它3 组游离氨基酸含量相对较低。4 组发酵萝卜干中甜味氨基酸的含量都是最高的,其次是鲜味氨基酸的含量,苦味和芳香族氨基酸的含量相对较低,其中芳香族氨基酸含量最低。甜味氨基酸中,混菌发酵的含量最高,达到了7.65 mg/g,远远高于其它3组;其中组氨酸的含量就达到了4.19 mg/g,对甜味氨基酸含量的贡献最大,其次是苏氨酸,含量为1.7 mg/g,其含量是自然发酵的5 倍左右,也远远高于其它两组。在鲜味氨基酸中,接种L3 发酵的含量最高,其次是混菌发酵的,而接种L1 发酵的鲜味氨基酸含量最低。鲜味氨基酸中4 组萝卜干的谷氨酸含量最高,贡献最大,其含量分别达到了3.3,2.98,3.31,3.60 mg/g。4 组萝卜干的苦味氨基酸和芳香族氨基酸含量都比较低,对萝卜干风味的贡献比较低。
2.6 L1 和L3 对发酵萝卜干挥发性风味的影响
泡菜类风味的形成是多种挥发性香气共同作用的结果,而酯类、醛酮类、含硫化合物和烯烃类化合物都具有独特的气味[25],对于发酵萝卜干风味形成有很大的贡献。2 种乳酸菌对发酵萝卜干挥发性风味物质影响的测定结果如图10 和表3所示。

图1 萝卜干发酵工艺流程Fig.1 Process flow of dried radish fermentation
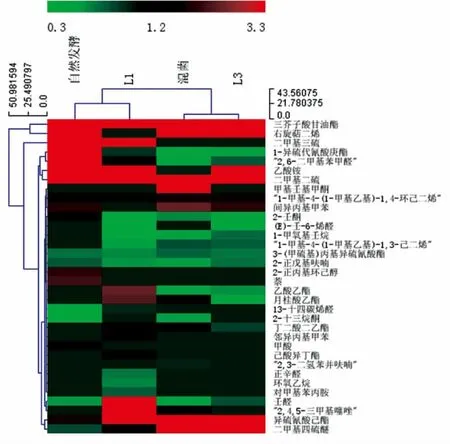
图10 发酵萝卜干中检测出的部分挥发性风味物质Fig.10 Some volatile flavor substances in fermented dried radish
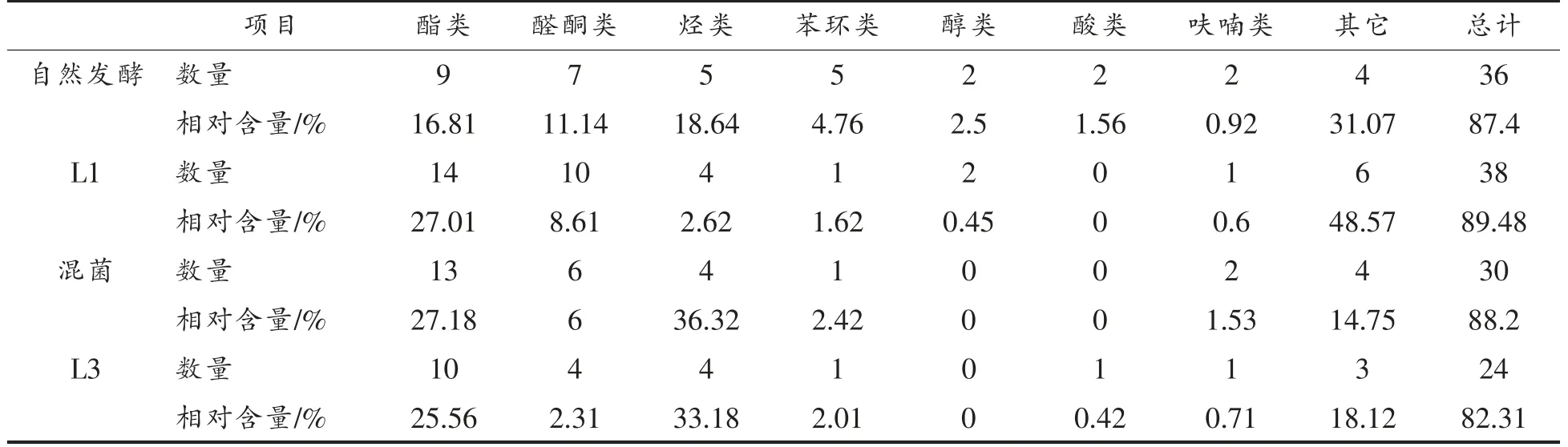
表3 发酵萝卜干中挥发性风味物质种类和相对含量(%)Table 3 Types and relative contents of volatile flavor substances in fermented dried radish(%)
从4 组萝卜干中共检测出61 种挥发性风味化合物。其中酯类17 种、醇类4 种、酸类2 种、醛酮类15 种、烃类8 种、呋喃类3 种、苯环类6 种以及其它化合物6 种。4 组萝卜干(自然、接种L1、混合菌和接种L3)中分别检测出36 种、38 种、30 种和24 种挥发性风味化合物。
酯类化合物种类最多,其中自然发酵的萝卜干酯类9 种,接种L1 发酵的14 种(最多),这增加了萝卜干的风味复杂性;而混菌发酵和接种L3 发酵的分别为13 种和10 种。很多酯类物质都有愉快的水果香气,使腌制菜品呈现果香味[26]。4 组的酯类物质相对含量也很高,分别为16.81%,28.01%,27.18%和24.67%,这主要与三芥子酸甘油酯含量高有关,其相对含量分别为9.10%,14.10%,18.83%和18.43%。三芥子酸甘油脂赋予了一种特有的萝卜香味,使发酵结束后的萝卜干仍带着一种独特的萝卜香味。经过接种发酵的萝卜干,其三芥子酸甘油脂含量都比自然发酵的高,说明接种发酵不仅能赋予萝卜干独特的发酵风味,还能保持产品特有的萝卜香味。混菌发酵组三芥子酸甘油脂含量最高,其萝卜香味更为浓郁。
检测出的醛酮类物质共15 种,4 组萝卜干中醛酮类含量分别为9.50%,8.42%,5.37%和3.88%。发酵中产生的醛类化合物来源于发酵过程中的脂质氧化[27]。醛类化合物的阈值低,分为饱和醛和不饱和醛,都具有特殊香气,酮类一般具有甘草味道。自然发酵组2,6-二甲基苯甲醛含量最高,达到8.01%。2,6-二甲基苯甲醛有一种肉味和蒜味。接种L1 发酵的任醛含量最高,为4.14%。壬醛有愉快的玫瑰和柑橘香。混菌发酵组甲基壬基甲酮含量最高为3.61%,它有蜡味和带有奶油奶酪的水果味。
4 组萝卜干共检测出8 种烃类物质,包括烷烃和烯烃,烷烃每种香气的含量都相对较少,而烷烃的香气阈值比较高,所以烷烃对萝卜干风味的贡献较小。烯烃类香味物质的阈值较小并有一类比较特殊的香味,对萝卜干的风味有一定的贡献[28]。从试验结果可以看出,自然发酵、混菌发酵和接种L3 发酵的萝卜干中右旋萜二烯含量都非常高,分别达到了16.74%,33.34%和29.97%,而接种L1发酵组中并没有检测出这种物质,推测可能是L1并不产生这种物质而L3 产生这种物质。右旋萜二烯具有甜味,带有清新的橙子、柠檬与燕麦香味,混菌发酵的萝卜干中右旋萜二烯含量最高,其萝卜干这种风味则会比较突出。
含硫化合物是萝卜干中的主要风味物质,检测出的含量也很高。4 组萝卜干中二甲基二硫含量都比较高,分别为9.17%,5.88%,5.69%和5.91%。二甲基二硫具有洋葱味和奶油香味,对萝卜干的风味形成有一定的贡献。而二甲基三硫则只在自然发酵和接种L1 发酵组检测到,含量分别为15.99%和27.71%。二甲基三硫具有肉的香味和洋葱蔬菜味,丰富了萝卜干的风味。此外,4 组萝卜干中都检测到二甲基四硫醚,含量分别为0.84%,1.55%,6.45%和5.31%,其中混菌发酵含量最高。二甲基四硫醚有坚果味和甘蓝香味,赋予萝卜干独特的风味。含硫化合物的形成主要原因是萝卜中原有的含硫化合物部分保留以及乳酸菌发酵过程中,由于芥子苷酶的作用,一些芥子苷被分解成了硫化物[29]。其中二甲基三硫和二甲基二硫香气阈值极低,因此香味浓郁,是萝卜泡菜的重要风味物质[30]。
4 组萝卜干中共检测到6 种苯环类物质,其中,自然发酵组检测到5 种苯环类物质,而其它3组各只检测到1 种苯环类物质。有研究报道,苯环类化合物可能是由芳香氨基酸分解代谢产生的,大多具有芳香味[31]。自然发酵组苯环类物质含量最高的是萘,但萘有一定的辛辣味,会产生不好的风味;苯丙氨酸的热降解会促进萘的产生[32]。
此外,4 组萝卜干中还含有少量的酸类、醇类和呋喃类。其中自然发酵组和接种L3 发酵组分别检测出2 种和1 种酸类物质,其它2 组未检测到酸类物质。醇类物质只有在自然发酵和接种L1 发酵的萝卜干中检测出,其它两组并未检测出。醇类化合物具有芳香味、植物香和酸败味等,许多代谢途径参与了醇类物质的生成,如甲基酮还原、氨基酸代谢和脂质氧化[33]。4 组都含有的呋喃类是2-正戊基呋喃,它有一种果味,熟焦糖味和霉味。这些风味物质虽然含量和种类都很低,但对萝卜干风味的形成提供了巨大的价值。
经挥发性风味分析和感官评价,3 组接种乳酸菌发酵的萝卜干都比自然发酵的口感和风味更好,而在接种乳酸菌发酵的3 组萝卜干中,混菌发酵的风味物质种类不是最多但是风味评价最好,某些特有的香气比较突出,如其中的三芥子酸甘油脂、右旋萜二烯和二甲基四硫醚风味物质与其它3 组相比含量都是最高的,对萝卜干特殊风味的形成具有很大贡献。
3 结论
接种乳酸菌发酵能提高萝卜干的风味品质,并加快发酵速度。混菌发酵的萝卜干中总酸和游离氨基酸含量最高,其呈味氨基酸中的甜味氨基酸含量远远高于其它3 组,在挥发性风味方面,混菌发酵的三芥子酸甘油脂、右旋萜二烯和二甲基四硫醚3 种风味物质含量与其它3 组相比都是最高的,且这3 种物质的相对含量非常高,其含量之和占了挥发性风味物质总量的58.62%,对产品特殊风味的形成有很大贡献。综合各方面风味指标数据和感官评价,最后选用混合菌种作为发酵剂,得到的产品色泽、质地和风味俱佳,品质高于自然发酵和单一菌种发酵的萝卜干。
