产肌醇的植物乳杆菌ZJ2868菌粉制备工艺
2021-10-19胡淳玉黄星星杨柳贞
于 平,胡淳玉,黄星星,刘 航,杨柳贞,贺 敏,马 健
(浙江工商大学食品与生物工程学院 杭州310018)
肌醇,又名肌糖、环己六醇,是一种具有生物活性的环化醇[1-2],广泛分布于哺乳动物的组织细胞、高等植物、真菌和一些细菌中,是组织培养中许多细胞不可缺少的一种生长因子[3]。肌醇具有降血脂、降胆固醇、抗衰老、抗焦虑和抗抑郁等多种功效[4-5]。它的代谢也与神经管缺陷、唐氏综合征、阿尔茨海默病和糖尿病肾小球病变等许多临床疾病息息相关,其在食品、饲料、医学和医药等方面有着广泛的应用。目前肌醇的制备方法主要有水解法、化学合成法和微生物发酵法。水解法和化学合成法生产肌醇,制备工艺繁琐,生产成本高,严重制约了其产业化生产。微生物发酵法生产肌醇,具有高效率和低成本等优点,成为产业化生产肌醇的新趋势。目前用于发酵生产肌醇的菌株主要有酿酒酵母[6]、假丝酵母[7]和黑曲霉[8]等,未见利用植物乳杆菌发酵生产肌醇的报道。
植物乳杆菌是一类革兰氏阳性厌氧细菌,呈无芽孢的球状或杆状[9-10],主要存在于人类和动物的黏膜、植物、发酵食品、污水和饲料中,大多数是促进健康的有益菌[11-12]。植物乳杆菌因具有独特的益生特性而引起社会各界的密切关注。目前的研究表明,植物乳杆菌具有提高食物营养价值,抑制病原菌的生长,抗氧化,降胆固醇,增强免疫力和预防癌症等多种益生特性[13-14]。植物乳杆菌定植于动物肠道内,能产生一些消化酶类,将食物中的蛋白质和糖类等物质分解成易于机体吸收的小分子物质,促进食物的消化吸收[15]。植物乳杆菌发酵产生的有机酸和醛类等物质能改善食品风味,产生的叶酸和维生素B12等能增强食物的营养性。Molina 等[16]研究发现,利用产维生素B12的植物乳杆菌发酵大豆,制备出含维生素B12的豆乳食品,可用于预防维生素缺乏症,是一种有效的替代疗法。Bhavsar 等[17]将筛选到的两株高产植酸酶活性的戊糖片球菌KTU05-8 和KTU05-9 用于制作全麦面包,结果发现全麦面包中钙、铁和锌的含量平均增加了30%。
菌粉因具有运输方便、保藏性和安全性高等优点而在食品工业中备受青睐,是目前工业上保藏菌种的方式之一。菌粉制备工艺主要是通过干燥工艺将高浓度菌液进行固化处理,将菌体以活菌形态保存下来的工艺[18]。真空冷冻干燥是一种常用的菌粉干燥技术,主要包括3 个步骤:冷冻、真空干燥和复水[19-20]。冷冻干燥不会使菌体过度收缩,可以得到完全可溶的菌粉,很容易再水化[21]。微生物细胞在真空干燥过程中的存活取决于许多因素,包括初始微生物浓度、保护介质和复水条件等[22-23]。保护性添加剂在生物活性保护中起着重要的作用。适合的保护剂在冷冻过程中为细胞提供低温保护,易于干燥,并提供良好的基质,使细胞稳定,易复水。
随着益生菌在食品、药品和保健品等领域的广泛应用,菌粉在益生菌市场的占有比例也越来越大[24-25],开发高品质、高活力和高贮藏性的菌粉是工业生产者的目标。不同的菌粉制备方法对益生菌的大量存活和功能表达均有影响。尽管冷冻干燥是制备益生菌粉的最温和的脱水技术[25],但它还会将益生菌暴露在不利的条件下,如极低的温度和干燥引起的细胞损伤以及冻干过程中冰晶的形成等。在制备菌粉的过程中,必须建立生产和维护技术,最大限度地提高细菌细胞的储存稳定性、活力和活性[26]。
前期研究中,项目组成员从泡菜中筛选了1株能够高产肌醇的植物乳杆菌ZJ2868[27]。本文主要研究其菌粉制备工艺。首先研究菌粉制备过程中的离心条件和保护剂配方,然后对菌粉的复溶条件和贮藏稳定性进行研究,以期得到高存活率、高品质的植物乳杆菌ZJ2868 冻干菌粉。
1 材料与方法
1.1 菌株
植物乳杆菌ZJ2868,由项目组成员从泡菜中分离得到,该菌能够发酵生产肌醇,为功能性益生菌[27]。
1.2 主要试剂和培养基
MRS 培养基:蛋白胨10 g/L,牛肉膏10 g/L,酵母粉5 g/L,磷酸氢二钾2 g/L,柠檬酸三铵2 g/L,乙酸钠5 g/L,吐温-80 1 mL/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,葡萄糖20 g/L(单独分装灭菌),pH 6.5,121 ℃灭菌20 min。
发酵培养基:葡萄糖36.56 g/L,酵母粉35.21 g/L,乙酸钠5.80 g/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,吐温-80 1 mL/L。
脱脂乳保护剂:称取一定量的脱脂乳粉溶解于盛有50 mL 蒸馏水的锥形瓶中,108 ℃灭菌15 min。
海藻糖保护剂:称取一定量的海藻糖溶解于盛有50 mL 蒸馏水的锥形瓶中,121 ℃灭菌20 min。
谷氨酸钠保护剂:称取一定量的谷氨酸钠溶解于盛有50 mL 蒸馏水的锥形瓶中,121 ℃灭菌20 min。
葡萄糖、柠檬酸三铵、乙酸钠、硫酸镁、硫酸锰、吐温-80、乙酸钠、谷氨酸钠、海藻糖和无水硫酸钠等试剂,上海生工生物工程有限公司。脱脂乳粉,购于杭州永辉超市。
1.3 主要仪器
ME204 电子天平,梅特勒-托利多仪器有限公司;YXQ-LS-5011 压力蒸汽灭菌器,上海博迅有限公司;LRH 系列生化培养箱,上海一恒有限公司;2K15 型高速低温离心机,SIGMA 公司;-80 ℃超低温冰箱,THERMO 公司;SCIENTZ-10Z 冷冻干燥机,宁波新芝生物有限公司;SW-CJ-1FD 洁净工作台,苏州金净净化有限公司;电热鼓风干燥箱,上海一恒有限公司。
1.4 试验方法
1.4.1 菌株ZJ2868 冻干菌粉的制备工艺 菌株ZJ2868 冻干菌粉的制备工艺流程:
菌种复苏→菌株ZJ2868 在培养基中增殖培养→离心收集菌体→菌体与保护剂融合液的制备→预冻→真空冷冻干燥→菌株ZJ2868 冻干菌粉。
1.4.2 离心收集最佳条件的选择 收集培养48 h 的5 mL 菌液4 份,分别装入无菌的10 mL 离心管中离心,离心条件为4 000 r/min、10 min、4 ℃,4 000 r/min、20 min、4 ℃,6 000 r/min、10 min、4 ℃,6000 r/min、20 min、4 ℃。收集离心的发酵上清液,对剩余菌体添加5 mL 灭菌的生理盐水涡旋混匀,分别取样稀释,梯度涂平板,计算其活菌数。根据下述公式计算离心损失率、离心存活率以及离心收获率。

1.4.3 冻干菌悬液的制备 收集离心的菌体,加入配制好的保护剂(体积为离心前培养液的1/5),涡旋混匀,得到冻干菌悬液,室温放置1 h,使保护剂和菌体充分融合。
1.4.4 菌悬液的真空冷冻干燥 将冻干菌悬液置于-80 ℃冰箱预冻2 h,取出后立即放入冷冻干燥机中,避免因温度突然上升而致菌体受损。将样品置于冷冻干燥机中持续冻干24 h(冷冻干燥机要预先开启,使冷阱温度降至-55 ℃,工作时真空度降至1 Pa)。
1.4.5 冻干保护剂的优化 真空冷冻干燥虽然是目前最常见的菌粉制备方法,但是其会对菌体造成很多不利的影响。产生的冰晶会破坏某些酶蛋白,从而影响益生菌的活性[28]。为在脱水过程中保护益生菌的生存能力,糖类物质、蛋白质类物质和氨基酸类物质等常被用作低温保护剂。确定合适的保护剂是提高细胞存活率的关键。单一的保护剂往往不能使冻干的菌粉活力达到最佳值,一般需要使用多种保护剂组合。通过查阅文献并结合试验成本,选择3 种常用的对植物乳杆菌保护效果较优的保护剂,通过单因素试验确定各保护剂的最佳浓度范围,然后以菌株ZJ2868 冻干存活率为指标,设计正交试验确定最佳复合保护剂配方。
1.4.5.1 谷氨酸钠质量浓度对菌株ZJ2868 冻干存活率的影响 收集离心的菌泥5 份,分别加入质量分数为2%,5%,8%,11%和14%的谷氨酸钠保护剂1 mL,平衡1 h,预冻2 h,真空冷冻干燥24 h,加入生理盐水复溶30 min,计算活菌数及存活率。
1.4.5.2 脱脂乳质量浓度对菌株ZJ2868 冻干存活率的影响 收集离心后的菌泥5 份,分别加入质量分数为2%,6%,10%,14%和18%的脱脂乳保护剂1 mL,平衡1 h,预冻2 h,真空冷冻干燥24 h,加入生理盐水复溶30 min,计算活菌数及存活率。
1.4.5.3 海藻糖质量浓度对菌株ZJ2868 冻干存活率的影响 收集离心的菌泥5 份,分别加入质量分数为3%,6%,9%,12%和15%的海藻糖保护剂1 mL,平衡1 h,预冻2 h,真空冷冻干燥24 h,加入生理盐水复溶30 min,计算活菌数及存活率。
1.4.5.4 保护剂正交试验 依据上述单因素试验确定的谷氨酸钠、脱脂乳、海藻糖的最佳浓度取值范围,用SPSS 17.0 软件设计四因素三水平共9个试验点的正交试验。以谷氨酸钠(A)、脱脂乳(B)、海藻糖(C)作为正交设计的自变量,以菌株ZJ2868 冻干菌粉存活率作为因变量,每个因素的3 个水平分别以(1,2,3)编码,每个试验点做3 次平行试验来减小试验误差。正交试验因素与水平的设计见表1。
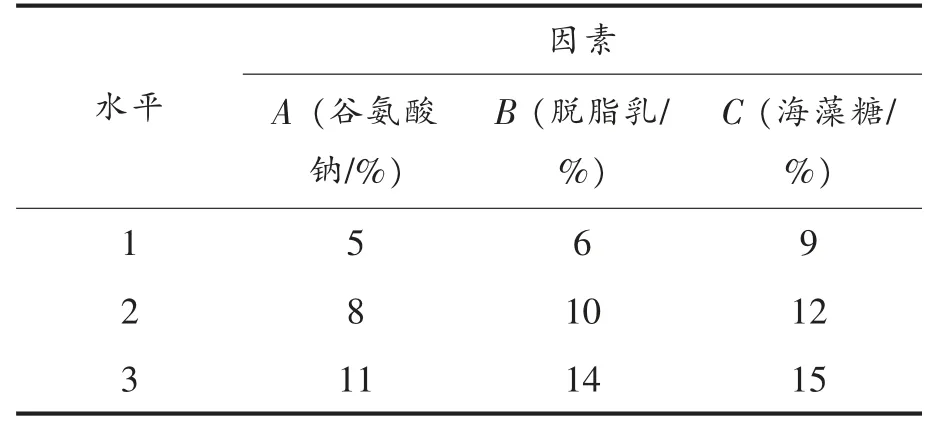
表1 正交试验因素与水平设计Table 1 Factors and levels of orthogonal experiment
1.4.6 菌粉复水溶剂及时间的确定 取冷冻干燥的菌粉若干管,加入与冻干前相同体积培养液的复水溶剂(无菌水、0.85%生理盐水和原保护剂),于室温下复水0,30 min 和60 min,分别取样,按照10-1,10-2和10-3进行梯度稀释后涂平板,计算活菌数,比较不同复水溶剂与复水时间对冻干菌粉存活率的影响。
1.4.7 菌粉贮藏稳定性的研究 将制备好的菌粉封口,分别置室温和4 ℃条件下贮藏,于贮藏的第6,12,18,24 天和30 天分别取样,加入原保护剂介质,复水30 min 后计算活菌数,与贮藏前的活菌数比较,研究贮藏时间和温度对菌粉存活率的影响。
1.4.8 分析方法
1.4.8.1 菌粉活菌计数 菌粉活菌计数采用稀释梯度平板计数法[29]。
1.4.8.2 冻干后菌体存活率的计算
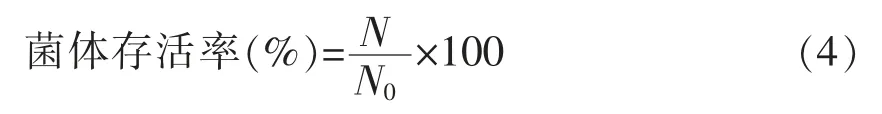
式中,N——冻干菌粉复溶后的活菌数,CFU/mL;N0——冻干前菌悬液的活菌数,CFU/mL。
1.4.8.3 冻干后菌粉水分含量的测定 根据GB 5009.3-2016《食品安全国家标准食品中水分的测定》[30]方法测定菌株ZJ2868 冻干菌粉的水分含量。
1.4.9 数据统计分析 重复试验3 次,结果以平均值±标准偏差表示。试验设计和数据统计分析采用SPSS 17.0 软件,数据绘图采用Origin 8.5 软件。
2 结果与分析
2.1 离心收集最佳条件
表3 显示离心条件对菌株ZJ2868 损失率、存活率和收获率的影响。可以看出菌株ZJ2868 离心存活率最高时的离心条件为4 000 r/min、10 min,离心存活率达90.75%。随着转速提高和离心时间延长,菌株ZJ2868 损失率逐渐减小,这可能是由于转速提高和离心时间延长使得更多的菌体与发酵液分离,上清液中菌体残留量变少,从而降低了损失率。离心收获率是离心效果的表征,离心收获率越高,离心效果越好。菌株ZJ2868 离心收获率与存活率变化趋势一致,在4 000 r/min 条件下离心10 min 最高,为90.68%,因此菌株ZJ2868 离心分离的最佳条件为4 000 r/min、10 min。
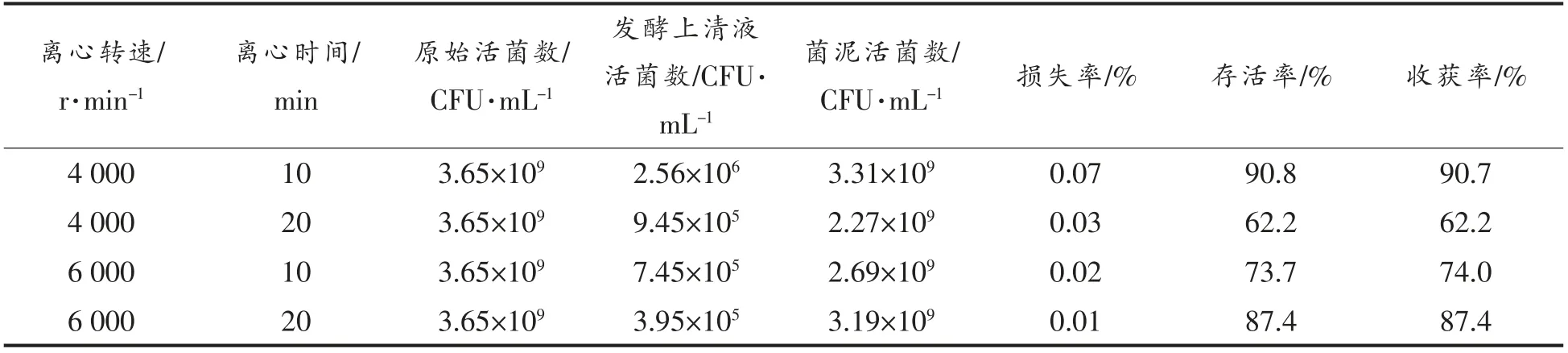
表2 离心条件对菌株ZJ2868 损失率、存活率和收获率的影响Table 2 Effect of the centrifugation condition on the loss rate,survival rate and yield of strain ZJ2868
2.2 谷氨酸钠浓度对冻干菌粉存活率的影响
谷氨酸钠是一种小分子保护剂,亲水性极强,其与菌体蛋白质极性基团形成的氢键代替了周围的水分子,在蛋白质表面形成保护膜,避免氢键联结位置暴露于周围环境中,在冻干过程中保护菌体蛋白质结构和功能的完整性[31-32]。此外谷氨酸钠还能防止三酰基甘油的氧化反应和自由基的形成,避免细胞遭受氧化损伤[33],因此可以提高菌粉存活率。由图1 可看出,随着谷氨酸钠浓度的增大,菌株ZJ2868 冻干菌粉存活率呈先上升后下降的趋势,在谷氨酸钠含量为8%时存活率最高,为64.15%。
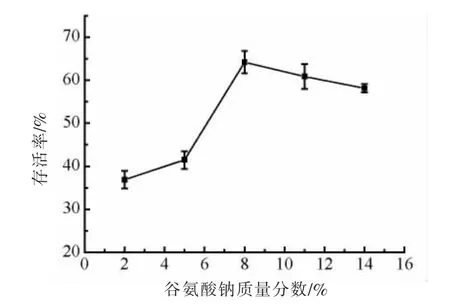
图1 谷氨酸钠浓度对冻干菌粉存活率的影响Fig.1 Effect of the monosodium glutamate concentration on the survival rate of freeze-dried strain powder
2.3 脱脂乳浓度对冻干菌粉存活率的影响
脱脂乳具有良好的低温保护作用,是一种应用较广泛、保护效果较好的冷冻或冻干发酵剂悬浮液。脱脂乳具有稳定的细胞膜成分和在冻干菌体中形成多孔结构的能力,使冻干的菌粉更易复水[34]。由图2 可知,随着脱脂乳浓度的增加,菌株ZJ2868 冻干菌粉的存活率变化幅度较大。在脱脂乳粉含量为10%时,对菌体的保护效果最佳,使冻干菌粉的存活率达到最高值51.70%。这是因为脱脂乳粉是由乳清蛋白、乳糖和维生素等组成的混合物,其中的乳清蛋白能够包裹在细胞表面形成蛋白保护膜[35-36],乳糖能够抑制细胞表面形成自由基[19]。这些物质均能防止菌体细胞受到损伤,保证菌体ZJ2868 在冻干过程中有较高的存活率。
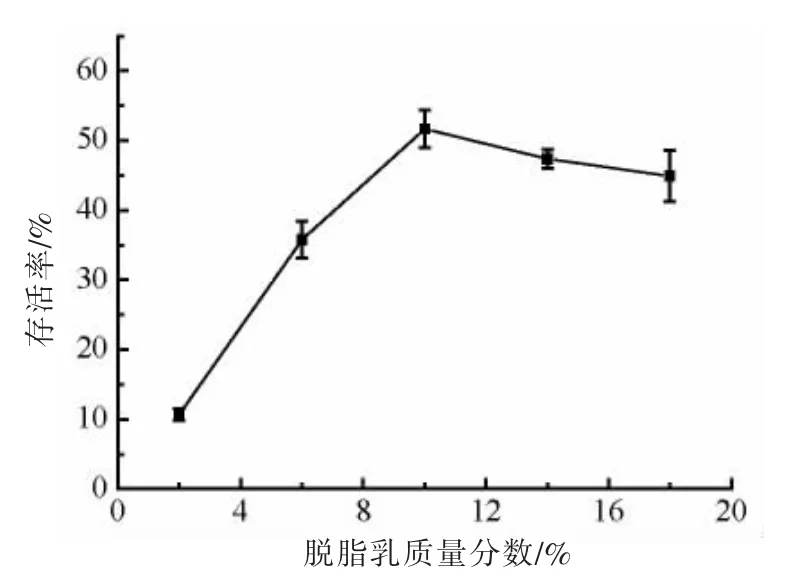
图2 脱脂乳浓度对冻干菌粉存活率的影响Fig.2 Effect of the skimmed milk concentration on the survival rate of freeze-dried strain powder
2.4 海藻糖浓度对冻干菌粉存活率的影响
海藻糖浓度对菌株ZJ2868 冻干菌粉存活率的影响如图3所示。在一定的浓度范围,菌株ZJ2868冻干菌粉存活率随着海藻糖浓度的增加而明显提高。在海藻糖质量分数为12%时,存活率达到最高值65.5%,这可能是由于海藻糖能够快速进入菌体细胞内,通过取代水分子来防止脱水过程对生物分子的损伤,同时它还形成一个薄的玻璃状的层,包裹着生物结构,限制了蛋白质分子内流动性,保持了它们的功能[37],使菌体保持较高的存活率。然而,继续提高海藻糖浓度反而不利于菌体的存活,可能是因为过高浓度的海藻糖会导致玻璃化结构过强[38],影响菌体自身的结构,导致其存活率降低。另外,过高浓度的海藻糖使得成本提高。海藻糖最佳质量分数为12%。
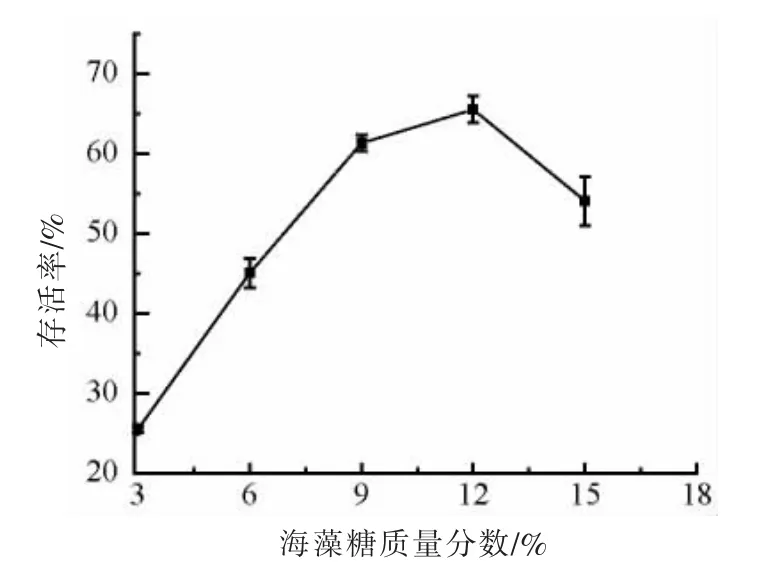
图3 海藻糖浓度对冻干菌粉存活率的影响Fig.3 Effect of the trehalose concentration on the survival rate of freeze-dried strain powder
2.5 冻干保护剂正交试验结果
不同组合冻干保护剂对菌株ZJ2868 冻干存活率的影响如表3所示,存活率最高的组合为A1B3C3,即5%谷氨酸钠、14%脱脂乳、15%海藻糖,此条件下冻干存活率为84.11%。
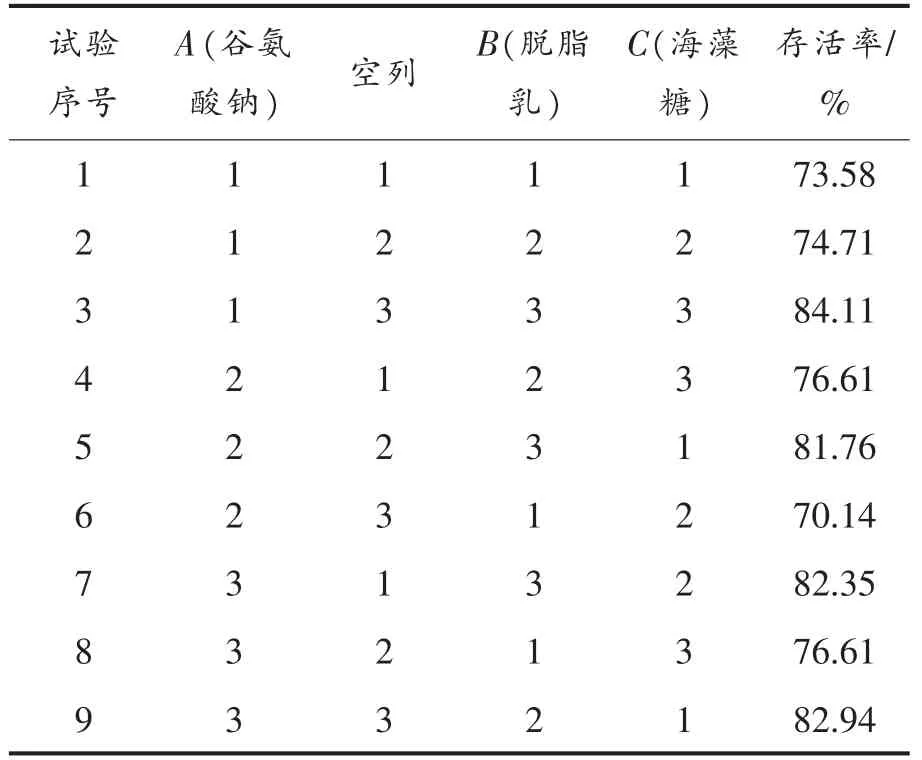
表3 正交试验结果Table 3 The results of the orthogonal experiment
对上述正交试验结果进行方差分析并绘制各因素与指标的趋势图,结果如表4 及图4所示。
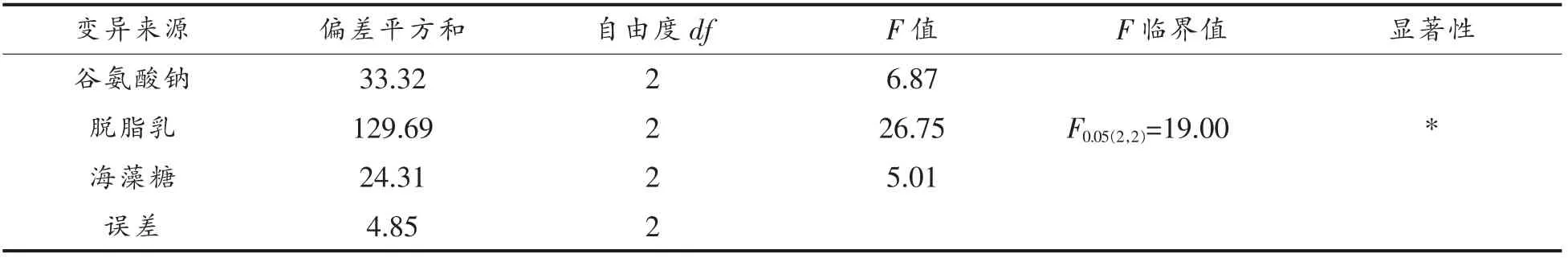
表4 正交试验方差分析Table 4 Variance analysis of orthogonal experiment
由表4 可知,脱脂乳对菌株ZJ2868 冻干存活率的影响最显著,为主要因素,而谷氨酸钠和海藻糖对菌株ZJ2868 冻干存活率的影响不显著,为次要因素,三者的影响程度排序为脱脂乳>谷氨酸钠>海藻糖。
由图4 可知,冻干保护剂的最佳组合为A3B3C1,即谷氨酸钠11%、脱脂乳14%和海藻糖9%,此组合不包含于9 组正交试验内。对组合A3B3C1与组合A1B3C3做验证试验。组合A3B3C1冻干存活率为85.14%,组合A1B3C3冻干存活率为83.24%,组合A3B3C1的保护效果优于A1B3C3,确定菌株ZJ2868 冻干保护剂的最佳组合为A3B3C1。此条件下菌株ZJ2868 冻干存活率为85.14%。
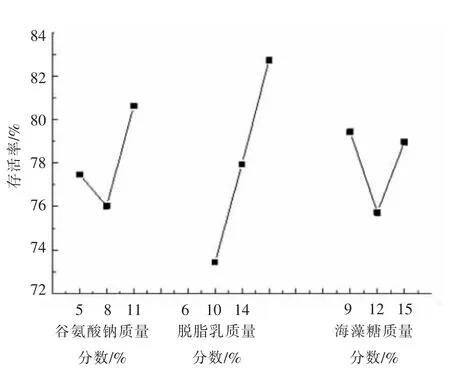
图4 因素与指标趋势图Fig.4 Trend chart of factors and indicators
2.6 冻干菌粉的水分含量
在上述确定的离心及冻干保护剂组合条件下,制备菌株ZJ2868 冻干菌粉,测得其水分含量为3.7%。
2.7 复水溶剂及时间对菌粉存活率的影响
复水是微生物恢复活力的关键步骤,受冻干损伤的细胞如在不适当的条件下再水化,可能无法修复已发生的损伤[39]。本研究探究3 种复水溶剂及复溶时间对菌株ZJ2868 冻干菌粉存活率的影响,结果如图5所示。复溶时间过短或过长均不利于菌株恢复活力,菌株复溶30 min 时能恢复最大活力。复溶时间过短,菌体未完全复苏;复溶时间过长,菌体虽复苏完全但营养物质缺乏而导致部分菌体衰亡。菌株ZJ2868 在不同复水溶剂中的复苏能力也不同,在原保护介质中的复苏能力最强。Lee 等[34]也发现植物乳杆菌JH287 在原保护介质中的复活能力最强。菌株ZJ2868 冻干菌粉在原保护介质中复溶30 min 后的活菌数为2.90×109CFU/mL,存活率达最大值85.4%。
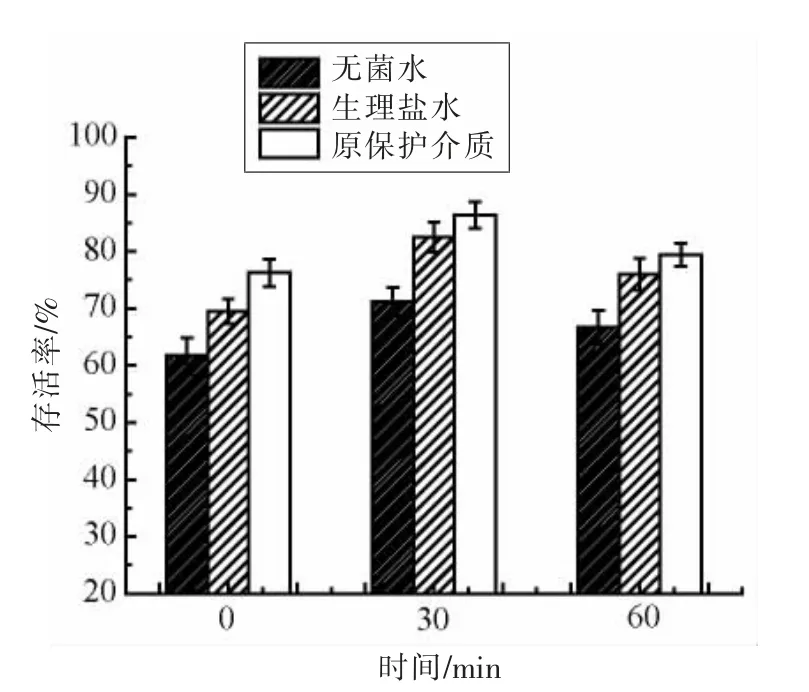
图5 复水溶剂及时间对冻干菌粉存活率的影响Fig.5 Effect of rehydration solvent and time on the survival rate of freeze-dried strain powder
2.8 贮藏时间和温度对菌粉存活率的影响
贮藏时间和温度对菌株ZJ2868 冻干存活率的影响如图6所示。菌株ZJ2868 冻干菌粉的存活率随贮藏时间的延长呈下降趋势。在常温条件下贮藏的菌粉的活力下降更快。在常温和4 ℃条件下贮藏1 个月后,菌株ZJ2868 冻干菌粉的存活率分别为49.78%和63.95%。4 ℃条件贮藏的菌粉稳定性较优。Amine 等[37]发现微生物在较低的温度下更易存活。Capela 等[38]发现冻干后微生物细胞的活力主要取决于贮藏温度,低温有利于保持菌体活力。常温保藏的菌粉细胞内的水活跃,迁移频繁,易导致生存能力的丧失[39]。综上,菌株ZJ2868 冻干菌粉在4 ℃条件下具有较强的稳定性。
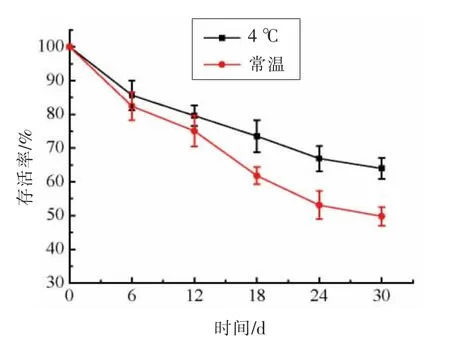
图6 贮藏时间和温度对冻干菌粉存活率的影响Fig.6 Effect of storage time and temperature on the survival rate of freeze-dried strain powder
3 结论
本文对植物乳杆菌ZJ2868 菌粉制备的离心条件、保护剂配方、菌粉复溶条件以及菌粉贮藏稳定性进行研究,确定了菌体收集的最佳离心条件为4 000 r/min、10 min,最佳冻干保护剂配方为谷氨酸钠11%、脱脂乳14%、海藻糖9.0%,最佳复溶条件为在原保护介质中复溶30 min,最佳贮藏温度4 ℃。制得的植物乳杆菌ZJ2868 冻干菌粉的活菌数为2.90×109CFU/mL,存活率达85.40%,水分含量为3.7%。
